Typ 2-diabetes
advertisement

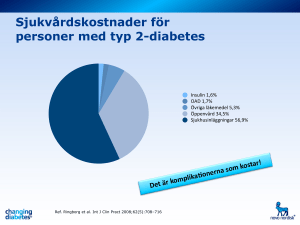
typ 2-diabetes Av Åke Sjöholm Typ 2-diabetes En kardiovaskulär systemsjukdom Kardiovaskulär sjukdom – “silent killer” vid typ 2-diabetes I USA, där diabetes är den fjärde vanligaste dödsorsaken, svarar kardiovaskulär sjukdom (CVD) för häpnadsväckande 75% av den totala dödligheten hos patienter med typ 2-diabetes (1). Personer med typ 2-diabetes har en två till fyra gånger ökad risk för CVD jämfört med personer med normal glukostolerans (NGT) och fatala CVD-incidenter är upp till 70 gånger vanligare än fatala mikrovaskulära komplikationer hos dessa patienter (2,3). Paradoxalt nog har de senaste årens minskning av mikrovaskulära komplikationer, som av hävd anses associerade med diabetes, bidragit till att belysa den betydande börda som CVD representerar. Ett stort problem är det faktum att makrovaskulära komplikationer av typ 2-diabetes utgör en större risk hos yngre individer. Det är ett faktum att den relativa risken för död i kardiovaskulär sjukdom (diabetiker kontra personer med NGT) avtar från ett värde på 3,6 i åldersgruppen 25–44 år till 1,5 i åldersgruppen 65–74 år. Eftersom kardiovaskulär risk således utgör ett tidigt inslag i typ 2-diabetes är det möjligt att även individer i början av trettioårsåldern kan ha utvecklat betydande CVD (4). Den kliniska betydelsen och konsekvenserna för folkhälsan av den höga frekvensen av CVD hos patienter med typ 2-diabetes är enorm och förväntas öka då typ 2-diabetes når upp till epidemiska proportioner i hela världen (5). Inverkan av kardiovaskulära riskfaktorer För nästan 20 år sedan fastställdes en 50 nordisk geriatrik 1 | 02 grupp betydelsefulla riskfaktorer för CVD (förhöjt plasmakolesterol, förhöjt blodtryck och rökning) (6). I normalbefolkningen ökar förekomsten av en eller flera av dessa faktorer den totala risken för CVD, men hos typ 2-diabetiker är dödligheten högre än vad som förväntas med hänsyn till diabetessjukdomen och de klassiska riskfaktorerna sammantaget (Figur 1, sid 51) (3). Dessutom elimineras överrisken för CVD endast med ungefär hälften genom behandling av alla de klassiska riskfaktorerna hos dessa patienter (7). De fysiologiska processer som svarar för denna överrisk för CVD är inte helt kända, men man vet att dålig glykemisk kontroll, dyslipidemi (låga HDL-kolesterol- och förhöjda triglyceridnivåer samt aterogent förändrade LDL-partiklar), hyperinsulinemi/insulinresistens och central (intraabdominell) fetma spelar viktig roll (8). Det är inte möjligt att slutgiltigt fastställa vilken av dessa besläktade avvikelser som primärt är “ansvarig” för den ökade risken för CVD men dålig glykemisk kontroll och dyslipidemi (särskilt höga triglycerider) betraktas som de faktorer som man i första hand kan misstänka. Hyperglykemi och kardiovaskulär risk Den anmärkningsvärda reduktionen av mikrovaskulära komplikationer och tendensen till minskat antal makrovaskulära incidenter efter intensiv behandling av patienter med typ 1-diabetes utgjorde en stark drivkraft till att studera effekterna av hyperglykemi hos patienter med typ 2-diabetes (9). Många studier har därefter bekräftat den avgörande roll som hyperglykemi har i utvecklingen av CVD och de positiva effekter som intensiv glukoskontroll har på sjukdomen (2,10,11). Under mitten och senare delen av 90talet, när dessa studier genomfördes, ansågs den huvudsakliga orsaken till diabeteskomplikationer vara hyperglykemi i fasta och hyperglykemin bestämdes genom mätning av fasteplasmaglukos (FPG) och glykerat hemoglobin (HbA1c). På senare tid har man visat att FPG och HbA1c inte ger en fullständig bild och att andra faktorer, särskilt glukostoppar vid måltid, ökar och förändrar CVD-risken (11–14). I dessa studier identifierades hyperglykemi två timmar efter glukosbelastning och försämrad glukostolerans, men inte FPG, som oberoende riskfaktorer för CVD. Allt eftersom förståelsen av sambandet mellan hyperglykemi och CVD har vuxit fram så har också insikten ökat om nödvändigheten att minimera exponeringen för hyperglykemi genom tidigare diagnos och striktare kontroll av den totala glykemiska risken (både postprandiell glukos och FPG). För det mesta föregås typ 2-diabetes av en symtomfri period med försämrad glukostolerans. Tills helt nyligen var det inte klarlagt vilka blodglukoskoncentrationer som utgjorde en förhöjd risk för CVD. Det tycks nu som om denna risk inte är begränsad till kategorier med försämrad glukostolerans och typ 2-diabetes utan effekten är oförändrad i hela det glykemiska intervallet (15–17). I Framingham Offspring Study visade individer med NGT och kända riskfaktorer för koronar hjärtsjukdom (CHD) en kontinuerlig, graderad riskökning vid (a) 80 Ten-year CHD mortality (per 1.000) Ten-year CHD mortality (per 1.000) Diabetic Non diabetic 60 40 20 10 5 110 120 130 140 150 160 Systolic blood pressure (mmHg) (b) 80 60 Figur 1. Risk för kardiovaskulär sjukdom vid typ 2-diabetes oberoende av klassiska riskfaktorer. I båda bilderna är den övre linjen diabetes och den nedre normal glukostolerans. Anpassad från Stamler J et al 1993 efter tillstånd. 40 20 10 5 4 5 6 7 Serum cholesterol (mmol/l) Figur 2. Kontinuerligt positivt samband mellan postprandiella glukosnivåer och koronar hjärtsjukdom (CHD). Anpassad från Donahue RP et al. Diabetes 1987;36:689–92 efter tillstånd. alla glukostoleransnivåer, dvs från dem med normal glukostolerans till dem med tidigare icke diagnosticerad diabetes (18). Såväl totala antalet CHD-incidenter som fatala incidenter ökar över ett brett glukosintervall oberoende av andra kända riskfaktorer (Figur 2, ovan) (19). Dyslipidemi och risk för kardiovaskulär sjukdom Dyslipidemi är en betydelsefull riskfaktor för CHD hos patienter med typ 2-diabetes. I motsats till studierna av hyperglykemi finns det relativt få prospektiva studier av lipider och lipoproteiner som prediktorer för CVD hos patienter med typ 2-diabetes. Trots att det råder delade meningar huruvida förhöjda triglyceridvärden är en primär riskfaktor, har patienter med typ 2-diabetes och CHD högre total- och VLDLtriglyceridnivåer än dem som inte har CHD (20,21). Behandling av diabetesre- laterad dyslipidemi har historiskt inriktats på att sänka LDL-nivåerna, men förhöjda triglycerider kan vara en bättre prediktor för CVD-risk än LDL vid typ 2-diabetes, eftersom dessa bättre korrelerar med andra komponenter tillhörande insulinresistenssyndromet. Sänkning av triglyceridnivåerna kan höja låga HDLvärden, minska plasminogenaktivatorhämmare-1 och på så sätt reducera den aterogena risken. Dessutom är förhöjda triglyceridnivåer hos typ 2-diabetiker positivt relaterade till hyperglykemi och kontrollen av glukostopparna vid måltid reducerar sålunda i sin tur den postprandiella stegringen av triglycerider (22, 23). Mekanismen för den ökade risken för kardiovaskulär sjukdom Hyperglykemi bidrar till accelererad aterogenes, som i sin tur ökar CVD genom ett antal komplexa mekanismer som ännu inte är helt klarlagda. I det stora material som insamlats visas att bildning av reaktivt syre (oxidativ stress) tillsammans med postprandiella metaboliska avvikelser kan spela en avgörande roll i etiologin av vaskulära komplikationer (24). Patienter med typ 2diabetes har signifikant högre nivåer av hydroperoxider och som följd härav tömda antioxidantreserver av t ex αtokoferol. Detta tycks inte ha något samband med avvikelser i lipidmetabolismen utan är associerat med själva diabetessyndromet. Det tycks helt enkelt som hyperglykemi tillsammans med förhöjda triglycerider i den postprandiella fasen genererar oxidativ stress som förbrukar antioxidanter, inklusive αtokoferol, i serum och celler (Figur 3, sid 52) (25). Denna frekventa oxidativa stress beroende på postprandiell hyperglykemi kan förvärra endotelets dysfunktion och främja ateroskleros. Även tem- nordisk geriatrik 1 | 02 51 typ 2-diabetes Figur 3. Typ 2-diabetes karakteriseras av ökad oxidativ stress (t ex hydroperoxidbildning) och reducerade antioxidantnivåer (t ex α-tokoferol). Återgiven från Nourooz-Zadeh J et al. Diabetologia 1997;40:647–653 efter tillstånd. Figur 4. Effekten av det postprandiella tillståndet på kärlväggen. Anpassad efter tillstånd från Haller H et al. Diab Res Clin Pract 1998;40:S43–S49. porärt stegrade glukoskoncentrationer efter en måltid kan ha en djupgående och långvarig effekt på utvecklingen av ateroskleros (Figur 4, ovan) (26). Sambandet mellan hyperglykemi, hypertriglyceridemi och aterogenes framstår som mer komplext genom effekterna från andra riskfaktorer som innefattar hyperinsulinemi, insulinresistens och ökad central fetma (vanligare hos patienter med hyperglykemi), vilka alla kan förekomma samtidigt och därmed öka CVD-risken. Det relativa bidraget av dessa faktorer till utvecklingen av CVD hos patienter med typ 2-diabetes är för närvarande föremål för debatt. Behandlingsstrategier för att reducera riskfaktorer för kardiovaskulär sjukdom Sambandet mellan ökad CVD-risk och inblandningen av modifierbara riskfaktorer, som t ex postprandiell hyperglykemi och förhöjda triglyceridnivåer, ger ett utmärkt tillfälle till att aggressivt försöka modifiera riskfaktorerna med användande av lämpliga terapeutiska regimer. Till att börja med kan ändrad livsstil vara tillräckligt för att uppnå tillfreds- 52 nordisk geriatrik 1 | 02 ställande glykemisk kontroll (bedömd med hjälp av FPG och HbA1c). Det är av avgörande betydelse att läkaren inte anser problemet löst då endast FPGnivåerna är under kontroll med diet och motion. Man måste också vara medveten om den dolda risken med postprandiell hyperglykemi och betrakta typ 2-diabetes som en progredierande sjukdom. När sjukdomen fortskrider kan den ihållande hyperglykemin, som uppkommer på grund av minskande insulinsekretion, motivera användning av farmakologiska medel. Tillgången på väl tolererade medel för att effektivt reducera postprandiell hyperglykemi har länge varit starkt begränsad. Nateglinid är ett kortverkande medel med snabbt insättande effekt som förstärker insulinsekretionen och verkar direkt på betacellerna i pankreas genom att stimulera insulinfrisättningen. Alfaglukosidashämmare (akarbos) och repaglinid (ett bensoesyrederivat) är tämligen effektiva i att sänka glukostoppar vid måltid men den förra är associerad med gastrointestinala biverkningar och hög frekvens av terapiavbrott medan re- paglinid kan ge viktökning och hypoglykemi genom sin relativt utdragna verkan på betacellerna. Det finns preliminära belägg för att rosiglitazon kan ha en effekt på glukostoppar vid måltid men dess långtidseffekt och tolererbarhet återstår att visa. Resultat från kliniska försök med nateglinid, som nu är godkänt i flera länder över hela världen (USA, Japan, Sverige), visar att det är effektivt i att kontrollera postprandiell hyperglykemi (27,28). Målsättningen med behandlingen av typ 2-diabetes bör vara att kontrollera den totala CVD-risken, till vilken hyperglykemi och hypertriglyceridemi i första hand bidrar. Förstahandsterapi för båda dessa metaboliska rubbningar är ofta resultatlös då den grundas på beteendeförändringar som ökad fysisk aktivitet och viktnedgång. Därför krävs vanligen farmakoterapi. Patienter med typ 2-diabetes med såväl hyperglykemi som höga HDL-värden får ofta kombinationsterapi med glukossänkande medel och en “statin” (29). Statiner är emellertid även vid höga doser endast måttligt effektiva i att reducera triglyc- eridnivåerna och därför kvarstår problemet med att sänka hypertriglyceridemin. Kombinationen statin och nikotinsyra är effektiv i att modifiera dyslipidemi vid diabetes men kan avsevärt förvärra hyperglykemin (30). Utmaningen är att finna en behandlingsregim som effektivt kontrollerar de modifierbara riskfaktorer som predisponerar typ 2-diabetiker till CVD, dvs postprandiell hyperglykemi och hypertriglyceridemi. Kombinationsterapi med användning av orala diabetesmedel med kompletterande verkningssätt, t ex nateglinid eller repaglinid (insulinsekretionsstimulerare, som kontrollerar postprandiell hyperglykemi) plus metformin eller glitazon (insulinsensibiliserare som sänker plasmatriglycerider) tycks utgöra en effektiv strategi för att prospektivt reducera CVD-risken hos patienter med typ 2diabetes. Slutsatser Den glädjande reduceringen under senare år av mikrovaskulära komplikationer till följd av typ 2-diabetes har tjänat till att framhäva betydelsen av de makrovaskulära komplikationerna av denna allt vanligare sjukdom. De goda nyheterna är att nyare data pekar på att de flesta, om inte alla, av de försvagande komplikationerna kan förhindras eller fördröjas genom prospektiv intensiv behandling av CVD-riskfaktorer, som t ex hyperglykemi och hypertriglyceridemi. Synen på omhändertagandet vid typ 2-diabetes håller på att ändras dramatiskt med insikten att kardiovaskulär sjukdom utvecklas i ett tidigare skede än de mikrovaskulära komplikationerna och att 80% av diabetes-relaterad dödlighet härrör från kardiovaskulära händelser. Diagnosen typ 2-diabetes bör nu fastställas tidigt och behandlas som en kardiovaskulär sjukdom. Referenser 1. Geiss LS, Herman WH, Smith PJ. Mortality in noninsulin-dependent diabetes. In: Harris M ed. Diabetes in America, Second Edition Bethesda: National Institutes of Health, 1995; 429-456. 2. UKPDS 33 (1998) Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes. UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837-853. 3. Stamler J, Vaccaro O, Neaton J, Wentworth D for the Multiple Risk Factor Intervention Trial Research Group. Diabetes, other risk factors and 12-yr cardiovascular mor- tality for men screening in the Multiple Risk factor Intervention Trial. Diabetes Care 1993; 16: 434-444. 4. Claudi T et al. Cardiovascular disease and risk factors in persons with type 2 diabetes diagnosed in a large population screening: the Nord-Trondelag Diabetes Study, Norway. J Intern Med 2000;248:492-500. 5. Amos AF, McCarty DJ, Zimmet P. The rising global burden of diabetes and its complications: estimates and projections to the year 2010. Diabet Med 1997; 14: S1-85. 6. Multiple Risk Factor Intervention Trial Research Group: Multiple Risk Factor Intervention trial risk factor changes and mortality results. JAMA 1982; 248: 1465-1476. 7. Eastman RC, Keen H, The impact of cardiovascular disease on people with diabetes: treatment and prevention. Lancet 1997; 350 (suppl 1); 29-32. 8. Ceriello A. The post-prandial state and cardiovascular disease: relevance to diabetes mellitus. Diabetes Metab Res Rev 2000; 16: 125-132. 9. The DCCT Research Group. The relationship of glycemic exposure (HbA1C) to the risk of development and progression of retinopathy in the Diabetes Control and Complications Trial. Diabetes 1995; 44: 968-983. 10. Hanefeld M, Fischer S, Julius U et al. The DIS Group. Risk factors for myocardial infarction and death in newly detected NIDDM: the Diabetes Intervention Study, 11year follow-up. Diabetologia 1996; 39: 1577-1583. 11. Shaw JE, Hodge AM, de Courten M et al. Isolated post-challenge hyperglycaemia confirmed as a risk factor for mortality. Diabetologia 1999; 42:1050-1054. 12. Barrett-Connor E, Ferrara A. Isolated post-challenge hyperglycemia and the risk of fatal cardiovascular disease in older women and men. The Rancho Bernardo Study. Diabetes Care 1998; 21: 1236-1239. 13. The DECODE study group on behalf of the European Diabetes Epidemiology Group Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. Lancet 1999; 354: 617-621. 14. Tominaga M, Eguchi H, Manaka H et al. Impaired glucose tolerance is a risk factor for cardiovascular disease, but not impaired fasting glucose. The Funagata Diabetes Study. Diabetes Care 1999; 22: 920-924. 15. Coutinho M, Gerstein H, Wang Y, Yusuf S. The relationship between glucose and incident cardiovascular events. A metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years. Diabetes Care 1999; 22: 233-240. 16. Khaw K-T, Wareham N, Luben R, et al. Glycated haemoglobin, diabetes and mortality in men in Norfolk cohort of European prospective investigation of cancer and nutrition (EPIC-Norfolk). BMJ 2001; 322: 1-6. 17. Barrett-Connor E. “Normal” blood glucose and coronary risk. BMJ 2001; 322: 5-6. 18. Meigs JB, Singer DE, Nathan DM et al. Metabolic abnormalities with glucose intolerance extend across the spectrum of prevalent glucose tolerance in 3297 Framingham Offspring Study patients. Diabetes 1995; 44 (suppl 1):5A. 19. Donahue RP, Abbott RD, Reed DM, Yano K. Postchallenge glucose concentration and coronary heart disease in men of Japanese ancestry. Diabetes 1987; 36: 689-692. 20. Laakso M. Lehto S, Penttila I, Pyorala K. Lipids and lipoproteins predicting coronary heart disease mortality and morbidity in patients with non-insulin-dependent diabetes. Circulation 1993; 88:1421-1430. 21. Patsch JR, Miesenbock G, Hopferweiser T et al. Relation of triglyceride metabolism and coronary artery disease. Arterosclerosis and Thrombosis 1992;12 (11): 1336-1345. 22. Howard BV. Lipoprotein metabolism in diabetes mellitus. J Lipid Res 1987;28:613-628 23. Hanefeld M, Fischer S, Schulze J et al. Therapeutic potentials of acarbose as first-line drug in NIDDM insufficiently treated with diet alone. Diabetes Care 1991;14: 732-737. 24. Giugliano D, Ceriello A, Paolisso G. Oxidative stress and diabetic vascular complications. Diabetes Care 1996;19: 257-267. 25. Nourooz-Zadeh J et al. Relationships between plasma measures of oxidative stress and metabolic control in NIDDM. Diabetologia 1997;40:647-653. 26. Haller H et al. The clinical importance of postpran- dial glucose. Diab Res Clin Pract 1998;40:S43-S49. 27. Hanefeld M, Bouter KP, Dickinson S et al. Rapid and short-acting mealtime insulin secretion with nateglinide controls both prandial and mean glycemia. Diabetes Care. 2000 Feb;23(2):202-207. 28. Horton E, Clinkingbeard C, Gatlin M et al. Nateglinide alone and in combination with metformin improves glycemic control by reducing mealtime glucose spikes in type 2 diabetes. Diabetes Care 2000;23:1660-1665. 29. Kreisberg RA. Diabetic dyslipidemia. Am J Cardiol 1998;82(12A):67U-73U. 30. Lithell H, Vessby B, Hellsing K et al. Changes in glucose tolerance and plasma insulin during lipid lowering treatment with diet, clofibrate and niceritrol. Atheroslcerosis 1982;43:177-184. Av Åke Sjöholm docent, överläkare, Medicinkliniken, Södersjukhuset, Stockholm, Sverige. nordisk geriatrik 1 | 02 53