Flödescytometri - Umeå universitet
advertisement

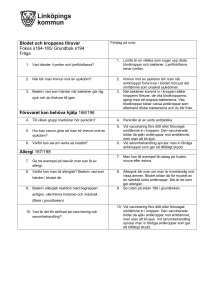
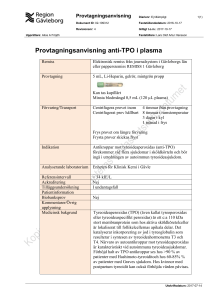
Umeå universitet Biomedicinska analytikerprogrammet Flödescytometri Årskull: BMA-09 Laborationsrapport i Hematologi och immunologi med laboratoriemetodik, termin 3 Laborationsdatum: Handledare: Inlämnad: Godkänd: Abstrakt Flödescytometri kan användas för att se till exempel cellers storlek, cellytans molekyler och cellkomplexiteten. En vätska med celler sugs upp av flödescytometern. Cellerna läses av en och en genom att en laserstråle passerar cellen. Ljuset som sprider sig läses av, av en detektor. Finns flera olika detektorer; forward scatter, side scatter samt detektorer som läser av fluorescensen. För att få ett fluorescerande ljus tillsätter man antikroppar märkta med olika flurokromer. FITC-märkning ger ifrån sig ett grönt ljus, medan PE-märkning ger ifrån sig ett orangefärgat ljus. Tc-celler har CD8 coreceptorer på sin yta. Th-cellerna har CD4 co-receptorer på ytan. Både Tc-celler och Th-celler har även CD3 co-receptorer på sin yta. B-lymfocyternas ytmolekyler är av CD19-typ. Monocyternas ytmolekyler är av CD14-typ. Alla dessa leukocyter har även CD45 som ytmolekyl. CD-typerna avgör vilka antikroppar som kan binda.Syften med den här laborationen är att bestämma andelen av de olika celltyperna(leukocyter, T-celler, B-celler och monocyter) i blodet. Vid laborationen krävdes venöst helblod som separerades så att endast lymfocyter och monocyter var kvar. Cellerna räknades sedan i Bürkers räknekammare därefter kördes 1 x 106 celler i en flödescytometer. Största delen av leukocyterna var Th-celler och minsta delen var B-celler. Th/Tc kvoten var 2,7. Det skiljde inte mycket mellan mängden monocyter och B-celler. Resultaten tyder på att patienten är frisk, då alla värden är normala. Introduktion Flödescytometri kan användas för att se till exempel cellers storlek, cellytans molekyler och cellkomplexitet(kärnans utseende, och andra komponenter). Vätskan med celler sugs upp av flödescytometern. Det finns en omkringliggande vätska med högre tryck som gör att cellerna trycks ihop och läses av en och en. En laserstråle passerar cellen och ljuset som sprider sig läses av, av en detektor. Det finns flera olika detektorer i en flödescytometer. Ljuset som sprider sig framåt (forward scatter) visar cellstorleken, ljus spritt åt sidan (side scatter) visar cellkomplexiteten. Det finns också detektorer som läser av fluorescensen, dvs vad cellen har för molekyler på sin yta. För att se detta tillsätter man fluorescensmärkta antikroppar till vätskan. Dessa antikroppar kommer då binda till molekyler på cellen och när laserstrålen träffar cellen avges ett fluorescerande ljus beroende på vilken fluorokrom antikropparna är märkt med. Desto fler molekyler cellen har på sin yta möjliggör för fler antikroppar att binda, vilket leder till starkare ljus. (1) Det finns två typer av lymfocyter; T-lymfocyter (vanligast) och B-lymfocyter. Båda produceras i benmärgen skillnaden är att T-lymfocyterna mognar i thymus. När T-lymfocyter kommer i kontakt med patogener omvandlas de till cytotoxiska T-lymfocyter (Tc-celler) som kan förgöra patogenet. Dessa Tc-celler har CD8 co-receptorer på sin yta. En annan typ av T-lymfocyter är T-hjälparceller (Thceller) som producerar cytokiner som till exempel aktiverar makrofager och B-lymfocyter. Th-cellerna har CD4 co-receptorer på ytan. Både Tc-celler och Th-celler har även CD3 co-receptorer på sin yta. När B-lymfocyterna kommer i kontakt med ett antigen omvandlas de till plasmaceller som bildar antikroppar. Antikropparna kan sedan förgöra antigenet. B-lymfocyternas ytmolekyler är av CD19-typ. Monocyter bildas i benmärgen, vandrar sedan ut i blodet och efter ett dygn förflyttar de sig vidare ut i vävnaden. Där de utvecklas till makrofager som via fagocytos kan bryta ner död vävnad, bakterier och andra patogener. De kan även bilda interleukiner som aktiverar T- och B-lymfocyter. Monocyternas ytmolekyler är av CD14-typ. (2) Alla dessa leukocyter har även CD45 som ytmolekyl. Syften med den här laborationen är att bestämma andelen av de olika celltyperna(leukocyter, T-celler, B-celler och monocyter) i blodet. Material och metod Celler Vid laborationen erhölls venöst helblod från en patient (ett EDTA-rör). Separering Blodet hälldes i ett falconrör som innehöll fem ml PBS + heparin. Röret vändes några gånger. Lösningen delades upp i två tio ml plaströr. En gradient skapades genom att tillsätta ficoll-lösning med en pasteurpipett. Rören centrifugerades på 1800 rpm i 20 minuter. Lymfocyterna och monocyterna dammsögs upp med hjälp av en pasterupipett och fördes över till ett 50 ml falconrör. PBS + azid tillsattes upp till 30 ml. Röret vändes. Röret centrifugerades på 2000 rpm i fem minuter. Supernatanten avlägsnades, fem ml PBS-azid tillsattes och röret vändes några gånger. Bürkers räknekammare Lösningen, 25µl, blandades med 100µL Türks reagens (spädning 1:5). De olika lösningarna blandades med hjälp av pipettering. Bürkers räknekammare användes och tre A-rutor på olika delar av rutnätet räknades. Därefter beräknades antalet celler/ml Flödescytometri Allt arbete utfördes på is. I fyra FACS rör sattes 1 x 106 celler. Rören centrifugerades på 1200 rpm i sju minuter. Supernatanten avlägsnades i alla rör. 25µl innehållandes olika fluorescerande antikroppar tillsattes i varje rör. Rör ett innehöll isotypkontroll. Rör två innehöll anti-CD4 (FITC märkt) och antiCD8 (PE märkt). Rör tre innehöll anti-CD3(FITC märkt) och anti-CD19 (PE märkt). I rör fyra fanns anti-CD45(PerCP märkt) och anti-CD14(FITCH märkt). Rören sattes på is med aluminiumfolie över i 30 minuter. Obundna antikroppar tvättades bort med 500µl PBS-azid. Rören centrifugerades på 1500 rpm i fem minuter och supernatanten avlägsnades. Tvättningen upprepades. 500µl PBS-azid tillsattes i varje rör, provrören fick ligga på is tills de kördes i flödescytometern (BDLSRII). Resultat Spridningen mellan de olika cellerna kan ses i figur 1. Största delen av leukocyterna var Thceller och minsta delen var B-celler. Det var ungefär 3 gånger så stor del Th-celler som Tcceller(kvoten). Det skiljde inte mycket mellan mängden monocyter och B-celler.(se tabell 1). Diskussion Resultaten tyder på att patienten är frisk, då alla värden är normala. En felkälla kan vara att vi fick med erytrocyter i lösningen. Det kan vara svårt att se var gränsen mellan erytrocyterna och leukocyterna går i dot-plottarna. Det kan leda till fel värden. Räkningen av leukocyter i bürkers räknekammare kan också ha blivit fel. För ett mer säkert resultat borde man ha räknat fler A-rutor. Referenser (1) Nationalencyklopedin http://www.ne.se/fl%C3%B6descytometri 2010-10-28 (2) Nationalencyklopedin http://www.ne.se/lang/blod# 2010-10-28 Tabeller Tabell 1: De olika celltyperna angett i procent, samt Th/Tc kvoten. Celltyper Antal celler (%) Kvot Leukocyter 84,2 - T-celler totalt 59,2 - Th-celler 38,9 - Tc-celler 14,5 - B-celler 4,5 - Monocyter 5,6 - - 2,7 Th/Tc Figurer Figur 1 A B C Figur 1: A) Spridningen mellan Th-celler med CD4-receptorer och Tc-celler med CD8receptorer. CD4-receptorerna har bundit till antikroppar med FITC-märkning. CD8receptorerna har bundit till antikroppar med PE-märkning. B) Spridningen mellan T-celler med CD3-receptorer och B-celler med CD19-receptorer. CD3-receptorerna har bundit till antikroppar med FITC-märkning. CD19-receptorerna har bundit till antikroppar med PEmärkning. C) Spridningen mellan leukocyter med CD45-receptorer och monocyter med CD14-receptorer. CD45-receptorerna har bundit till antikroppar med PerCP-märkning. CD19-receptorerna har bundit till antikroppar med FITC-märkning.