Atomers och Molekylers Struktur
advertisement

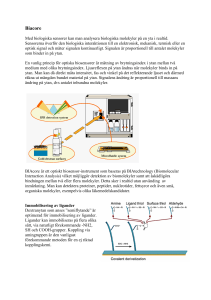
Atomers och Molekylers Struktur Föreläsningar 1.11.2010-26.1.2011 Tentamen 1.12.2010 och 28.1.2011 kl 14:15 Kursplan på hemsidan www.chem.helsinki.fi/~sundholm/aoms_2010 (Del 6) Dage Sundholm Räkneövningar och workshopövningar handhas av Stefan Taubert Diatomära molekylers vibrationer ● För en harmonisk potential ● Fås energinivåerna ● Där k är kraftkonstant ● meff = effektiv massa ● Potentialkurvan för en diatom är inte harmonisk Anharmoniska effekter ● Anharmonicitet kan modelleras genom att ersätta den paraboliska potentialen med en Morse potential Morsepotential ● ● Morsepotentialen Insatt I Schrödingers ekvation ger följande egenvärden (energinivåer) ● ● ● ● xe kallas anharmonicitetskonstant De är dissociationsenergin från potentialens botten Anharmonisk vibration ● ● Morsepotentialen ger en enkel teoretisk behandling av anharmoniska effekter En mera generell metod är att uttrycka energin som en serieutveckling och anpassa den till uppmätta energinivåer Birge-Sponer plot ● Dissociationsenergin kan uppskattas medelst en Birge-Sponer plot ifall man lyckas mäta energier för ett antal vibrationsnivåer Exempel på en Birge-Sponer graf ● ● De observerade vibrationsnivåerna för H 2+ har följande värden för övergångarna 1 ← 0, 2 ← 1, ... (i cm-1): 2191, 2064, 1941, 1821, 1705, 1591, 1479, 1368, 1257, 1145, 1033, 918, 800, 677, 548, 411. Bestäm molekylens dissociationsenergi. Rita energin för övergångarna som funktion av v + ½ . Extrapolera till den punkt där linjen skär den horisontella axeln och beräkna ytan under den räta linjen. Exempel på en Birge-Sponer graf ● Ytan är 214. Varje kvadrat motsvarar 100 cm -1, dissociationsenergin är alltså 21400 cm -1 Vibrationella urvalsregler ● För en harmonisk potential fås urvalsregler genom att betrakta integralen för dipolövergångar mellan Hermitepolynom ● Hv+1 – 2xHv +2vHv-1=0 ● xHv = 0,5(Hv+1 -2vHv-1) ● Ortogonaliteten ger ● För icke-harmoniska potentialer fås även andra (svaga) övergångar som kallas övertoner Rovibrationsspektra ● ● En första approximation är att anta att vibrationsrörelser och rotationsrörelser kan beskrivas som en harmonisk oscillator respektive som en styvrotor Anharmonicitet och centrifugaldistorsion är negligerade Rovibrationsspektra ● Urvalsregler för harmonisk vibrationsrörelse är ● ● ● För den styva rotorn gäller ΔJ = -1, 0, eller +1 ● Kombination av utvalsreglerna ger ● P-gren Δv = +1, ΔJ =-1 ● Q-gren Δv = +1, ΔJ = 0 ● R-gren Δv = +1, ΔJ =+1 Rovibrationsspektra ● P-gren Δv = +1, ΔJ =-1 ● Q-gren Δv = +1, ΔJ = 0 ● R-gren Δv = +1, ΔJ =+1 ● P-gren ● Q-gren ● R-gren Rovibrationsspektra ● ● ● ● P-grenen har linjer vid ñ-2B, ñ-4B, ñ-6B, …där ñ är vibrationsenergin I vågtal Q-grenen har mycket tättliggande linjer vid ñ Q-grenen har ett starkt band ifall övergången är tillåten R-grenen har linjer vid ñ+2B, ñ+4B, ñ+6B, ... Rovibrationella spektra ● ● Rotationskonstanten för v=0 och v=1 är något olika pga anharmonicitetseffekter Om man beaktar det så fås Rovibrationsspektra ● ● Genom att kombinera energinivåerna för P- och R-grenarna, kan B0 och B1 bestämmas Vibrationell Ramanspektra ● För diatomära molekyler (Ex. CO) är urvalsreglerna för Ramanspektra ΔJ=-2,0,+2 ● Dessa ger upphov till en ● O-gren (ΔJ=-2) ● Q-gren (ΔJ=0) ● S-gren (ΔJ=+2) Vibrationsspektra för polyatomära molekyler ● ● En tvåatomig molekyl har bara en inre vibrationsmod (= bindningstöjning) Varje icke-linjär molekyl har 3N-6 vibrationsmoder, en linjär har 3N-5 st ● Moderna är IR och/eller Raman aktiva ● IR inaktiva är ofta Raman aktiva ● Ju större molekyl desto mer komplicerat spektrum (kombinationsmoder, övertoner, centrifugaldistorsion, ...) Normalmod ● ● ● En normalmod (normalvibration) är en självständig vibration Den är en mod som kan exiteras utan att de övriga inre molekylvibrationerna berörs CO2 har 3N-5 = 4 vibrationsmoder Rovibrationsspektra ● ● ● Förutom normalmoderna detekteras övertoner (ex. 2v1) och kombinationsmoder (v1 + v2) Intensiteten för rovibrationsspektra är temperaturberoende för att besättningen av rotationsnivåerna är temperturberoende vid normala temperaturer (Boltzmannfördelning) Rovibrationsspektra spelar viktiga roller I klimatstudier och som vertyg inom kemi och biokemiforskningen Symmetri och normalmoder ● Beakta H2O (punktgrup C2v) ● Molekylen har 3 normalmoder ● Symmetrisk töjning ● Böjning ● Antisymmetrisk töjning ● ● De två först ändrar dipolmomentet I z-riktning Den tredje I y-riktning Symmetri och normalmoder ● ● ● Med hjälp av gruppteori kan man bestämma till vilka irreducibla representationer vibrationsmoderna hör Om symmetrirepresentationen är samma som representationen för x, y eller z är moden IR aktiv. Den enklaste metoden att bestämma moders irreducibla representationer är beskriven I Harris, Bertolucci, “Symmetry and Spectroscopy”, Dover, 1989, sid 141 Symmetri och vibrationsmoder Symmetri och vibrationsmoder Symmetri och vibrationsmoder Symmetri och vibrationsmoder Vibrationsspektra ● ● ● För större molekyler blir IR och Raman spektra invecklade och svårtolkade Varje spektra är dock unikt och gör dem användbara för identifieringsändamål Det karaktäristiska vågtalsområdet (frekvenser) där de s.k. gruppfrekvenserna uppträder är ganska lika I liknande molekyler (t.ex karbonylgruppen (C=O) I organiska molekyler. Elektroniska övergångar ● ● ● ● Elektroniska övergångar sker utan att kärnornas lägen förändras mycket Elektronrörelserna är mycket snabbare än kärnrörelser Elektroniska övergångar kopplar dock till vibrationsrörelserna De relativa intensiteterna för vibrationsfinstrukturen I elektronspektra bestäms av Franck-Condon principen Franck-Condon principen ● ● ● Kärnorna är tunga I förhållande till elektronerna Elektronövergångar sker snabbt I förhållande till kärnrörelser Elektroniska övergångar kan därför antas vara vertikala transitioner Franck-Condon principen ● Övergångsmomentet vars kvadrat är proportionellt mot övergångssannolikheten eller intensiteten Funktionella grupper ● ● ● En fotoabsorption kan ofta spåras till en specifik kromofor (Ex. Karbonylgrupp, C=O) I en fri metallatom är d-orbitalerna degenererade, men I ett metallkomplex (Ex. Ti(OH2)33+ uppspaltas de 5 d-orbitalerna på grund av ligandfälteffekter För ett oktaedriskt komplex fås en 2-faldig (e g) och en 3-faldig (t2g) energinivå d-d övergång I [Ti(OH2)6]3+ d-d övergångar ● ● ● ● ● Färgen hos övergångsmetallkomplex härrör från dessa d-d övergångar Splittringen ligger ofta I det synliga området Elektroniska dipolförbjudna (svag intensitet) om <initial|r|final>=0. Urvalsregler fås med hjälp av punktgruppers karaktärtabeller Produkten av de ingående irreducibla representationerna bör innehålla en totalsymmetrisk komponent Urvalsregler ● ● ● Enligt karaktärtabellen för C2v tillhör x,y,z de irreducible representationerna B1, B2, A1 Om det initiala tillståndet tillhör A1 (grundtillståndet är oftast total symmetriskt) Om sluttillståndet tillhör A2 är övergången förbjuden (ingen topp I UV/Vis spektret) ● A1 (A1 eller B1 eller B2) A2 = A2 eller B1 eller B2 ● Ingen A1 fås ● Dipolövergångar från A1 till A1 eller B1 eller B2 är tillåtna Laddningsöverföring ● Absorption som leder till elektonöverföring är av stor betydelse I många sammanhang ● Solceller är aktuella ● Fotosyntes är en klassiker ● ● Ljusabsorption av övergångsmetallkomplex kan leda till att elektroner flyttar från liganden till metallen eller tvärtom Ruteniumpolypyridylkomplex för ljusspjälkning av H2O till H2 Övergångar I metallkomplex Övergångar I ruteniumpolypyridyl π → π och n → π övergångar * ● ● * I organsika föreningar spelar π, π* och n orbitaler en viktig roll (n = ensamt elektronpar) Det gäller främst molekyler med C=C och C=O grupper ● π → π* är dipoltillåten (stark) ● n → π* är dipolförbjuden (svag) ● Även om molekylen är totalt osymmetrisk gäller dessa urvalsregler för det räcker om molekylen har lokalt en given symmetri Cirkulär dikroism ● ● Kirala molekyler absorberar polariserat ljus olika beroende på dess polarisationsriktning Skillnaden I absorption av cirkulärt höger- och vänsterpolariserat ljus kallas cirkulär dikroism Fotoisomerisering och retinal ● ● När 11-cis-retinal exciteras kommer cis C11=C12 att omvandlas till trans C11=C12 Strukturförändringen skickar en signal in I proteinet, signalen förstärks flerfaldigt och vi ser ljuset Ödet för elektronisk exciterade tillstånd ● ● ● Elektroniskt exciterade tillstånd kan förlora sin energi (återvända till grundtillstånd) via Radiativa processer (avger ljus) Icke-radiativa processer (omvandlas till termisk energi eller till nytta) Fluorescens och fosforoscens ● ● Fluorescensprocesser (spinntillåtna sker på nanosekund skala, medan de fosforescerar (triplett -> singlett) på millisekundskala (detta gäller organiska molekyler utan tunga atomer) Tunga atomer innebär att relativistiska effekter är viktiga och spinnförbjudet finns inte för spinn är inte ett gott kvanttal Fluorescensmikroskopi ● Genom att fästa fluorescerande molekyler på proteiner, nukleinsyror (DNA) och membranmolekyler kan man undersöka biosystem med hjälp av fluorescens ● http://www.youtube.com/watch?v=90wpvSp4l_0 ● http://www.moleclues.org/sv/node/960 ● Green fluorescent protein Stokesskift ● ● Molekylstrukturen för grundtillstånd och exciterade tillstånd är olika Absorptionsenergin och emissionsenergin är därför olika (Icke-)radiativa övergångar ● ● Kan avbildas schematiskt med hjälp av Jablonskidiagram Skiss av potentialkurvor ger även en bra bild Dissociation ● Elektronisk excitation kan även leda till dissociering av molekyler (den delas I två) Exciterade tillstånd och laser ● ● LASER = light amplification by stimulated emission of radiation LASER kräver en omvänd population dvs. Andelen molekyler I exciterat tillstånd är fler än I grundtillstånd Tre-nivå laser ● Man tillför energi för att pumpa från X → I ● Det exciterade tillståndet relaxerar till A ● Systemet relaxerar radiativt från A till X ● X → I → A är snabb ● A → X är långsammare ● Tekniskt svårt att förverkliga Fyra-nivå laser ● Exitation från X → I (snabb) ● Relaxation I → A (snabb) ● Radiativ övergång A → A' (långsam) ● Relaxation A' → X (snabb) ● Tekniskt lättare att få omvänd population för att A' är opopulerat ● Neodymlaser är en “solid-state” laser där ● A= 4F och A' = 4I tillstånd (Nd-YAg, Y3Al5O12) Lasereffekt ● ● ● ● ● ● Emissionen stimulerar emission Alla övergångar har samma energi Monokromt ljus skapas Systemet placeras I en kavitet med halvgenomsläppliga speglar Ljuset bildar en stående våg och blir monokromatiskt Filtrering och förstärkning Kontinuerlig och pulser ● Lasrar kan vara kontinuerliga (CW) ● Även pulslasrar (P) finns ● Högeffektiva lasrar är P ty effekt=energi/tid ● Korta energirika pulser ger hög effekt ● Terawatt TW (1012 W) lasrar finns Lasertyper ● He/Ne laser ● Ar laser ● CO2 laser ● Excimer laser ● Färgämneslaser Användning av laser I kemi Fotoelektronspektroskopi ● ● ● ● ● hν = ½ me v2 + Ii ; Ii = jonisationspotential för elektron i Finstrukturen härrör från många exciterade tillstånd hos det joniserade systemet Den första toppen motsvarar den energi som krävs för att få loss en elektron från HOMO HOMO = högsta ockuperade molekylorbital Vid undersökning av ytor kallas det “Electron spectroscopy for chemical analysis (ESCA) Magnetisk resonansspektroskopi ● Magnetisk resonans är den viktigaste spektroskopiska tekniken vid strukturbestämning ● NMR : kärnmagnetisk resonans ● ESR : elektronspinresonans (även kallat EPR) ● EPR : elektronspin paramagnetik resonans ● Man mäter energier för övergångar mellan magnetiskt uppspaltade tillstånd Kärnmagnetisk resonans ● ● ● ● ● En molekyls elektronmoln kan ha ett permanent magnetiskt moment eller ett inducerat magnetiskt moment. Kärnor kan har egna magnetiska moment, μ Kärnor med spinnimpulsmoment (I), som är större än noll har magnetiska moment Kärnor har en laddningsfördelning som inte behöver vara sfärisk Kärnor kan ha kvadrupolmoment, eQ Kärnspinn ● Kärnors spinnimpulsmoment är ett heltal eller en multipel av ½, liksom elektronen ● Dess magnitud är (I(I+1))1/2 hbar ● Dess komponenter mI är I-1, .... ,-I+1, -I ● Antalet mI nivåer för dessa kärntillstånd är 2I+1 ● För 1H är I = ½ ; 14N I=1 ; 12C I=0; 16O I=0 ● 1 H har 2 nivåer, 14N har 3, 12C och 16O är inte magnetiskt aktiva kärnor Elektronisk energi I magnetiska fält ● Den klassiska växelverkningsenergin mellan ett magnetiskt moment och ett externt magnetfält ● ● ● Kvantmekaniskt blir Hamiltonoperatorn Det magnetiska moment är proportionell mot banimpulsmoment ● Där γe är magnetogyriska kvoten för elektronen ● För ett magnetfält längs z-axlen fås Elektronisk energi I magnetiska fält ● ● Bohrmagnetonen är det fundamentala kvantumet av magnetisk moment För elektronens spin fås analogt ● ● ● ● ge = 2.002219 är elektronens g-värde ● νL är Larmorfrekvensen Elektronisk energi I magnetfält ● ● ● I vektormodellen är Larmorfrekvensen är den frekvens med vilken elektronens spinn sveper runt sin kon. Ju starkare externt magnetfält desto högre är frekvensen. För 1 Tesla är Larmorfrekvensen 30 GHz Energin för kärnor I magnetfält ● Kärnmagnetiska moment I växelverkar med externa magnetfält på samma sätt som elektronens magnetiska moment. ● γe ersätts med γ ● Kärnmagnetonen μN defineras som Magnetisk resonansspektroskopi ● ● ● I ett externt magnetfält splittras energinivåerna för spinn-upp och spinn-ner elektronerna för molekyler med öppna skal Vid EPR (ESR) spektroskopi är magnetfältet vanligen 0,3 T vilket ger energier som motsvarar 10 GHz och en våglängd på 3 cm EPR använder mikrovågor Magnetisk resonansspektroskopi ● Energisplittringen mella spinn-upp och spin-ner för en kärna med spinnet ½ är ● ● ● Ett typiskt magnetfält på 12 T ger frekvenser kring 500 MHz för en proton (radiovågor) Kärnmagnetisk resonans (NMR) ● Intensiteten är proportionell mot B 02 ● Populationsdifferensen är proportionell mot B 0 ● Man kan skanna genom att variera radiofrekvensen och hålla B0 konstant eller tvärtom NMR skärmningskonstant ● ● ● ● ● En kärna som omges av elektroner ser inte hela det påsatta externa magnetfältet Elektronerna skärmar magnetfältet Skärmningen är inte den samma för alla kärnor I alla molekyler. Den magnetiska skärmningen kan användas för att identifiera okända molekyler. Skärminingskonstanten sigma anger hur magnetfältet dämpas vid kärnan NMR kemiska skift ● ● ● NMR kemiska skift (sigma I ppm) är en relativ måttenhet Ofta relaterar man den uppmätta frekvensen till en frekvensen för en referenssubstans Tetrametylsilan (TMS) för C och H. NMR kemiska skift Skärmningskonstanten ● ● ● Kärnmagnetiska moment växelverkar med magnetfältet vid kärnan. Magnetfältet påverkas för att det passerar elektrontäthet Skärmningen av magnetfältet uppstår pga molekylens elektroner och eventuellt omgivande molekylers elektroner Skärmningskonstanten ● ● ● Den kan indelas I en diamagnetisk (klassisk) och en paramagnetisk (icke-klassisk) del För atomer är den paramagnetiska delen = 0 För atomer kan den diamagnetiska delen beräknas med Lambs formel ● ● ● För molekyler kan skärmningskonstanter beräknas med speciella datorprogram Magnetiskt inducerade strömmar ● När molekyler utsätts för magnetfält rör sig elektronerna, det bildas strömmar I elektronmolnet ● Strömmarna är starka kring atomkärnorna ● Strömmar flyter runt kemiska bindningar ● Strömmar kan cirkulera runt molekylringar, de kallas ringströmmar ● Ringströmmar undersöks I min forskargrupp ● Vi har utvecklat vårt eget datorprogram GIMIC Magnetiskt inducerade strömmar ● ● ● ● Ringströmmar skapar inducerade magnetfält som oftast dämpar det yttre magnetfältet Det finns dock molekyler vars ringströmmar förstärker magnetfältet (paratropa strömmar) Ringströmmar påverkar skärmningskonstanter för angränsande molekyer och grupper. Uttnyttjas vid strukturbestämning av proteiner med NMR Ringströmmar NMR spektrets finstruktur ● ● ● ● ● Spaltningen av resonanser I ett flertal individuella linjer kallas spektrets finstruktur Finstrukturen uppstår för att varje närliggande magnetisk kärna bidrar till det lokala fältet Resonansfrekvenserna påverkas, detta kallas spinn-spinn koppling Avståndet mellan finstrukturlinjerna är ett mått på växelverkan samt betecknas J J kallas spinn-spinn kopplingskonstant Spinn-Spinn koppling ● ● ● Spinnkopplade system brukar betecknas med AB, AX, ABX osv AB system har kärnor med likadan kemisk förskjutning (lika skärmning) AX system har kärnor med olika kemisk förskjutning Spinn-Spinn koppling ● ● ● Antag att X har spinnet (½) då kommer A:s Larmorfrekvens att påverkas av det yttre fältet. Skärmningen av fältet samt spinnspinn växelverkan mellan A och X Resonanslinherna för A skiftas med +½ J och -½J För AXn : ekvivalenta kärnor beter sig som en enda kärna Spinn-Spinn koppling ● För AXn : n=1 ger 2 linjer ● För AXn : n=2 ger 3 linjer ● För AXn : n=n ger n+1 linjer ● Intensiteter följer Pascals triangel Energi för spinnkopplade AX system ● Energin utan spinnkoppling ● ● ● Energi med spinnkoppling ● ● ● Spinn-spinn kopplings energier Hur förstå spinn-spinn koppling ● ● Spinn-spinn koppling kan förklaras som ett resultat av en polarisationsmekanism Växelverkan överförs via elektronerna I bindningarna Hur förstå spinn-spinn koppling ● ● ● ● Kärnans spinn introducerar ett litet elektronspinn I dess närhet Det är energetiskt fördelaktigt att de inducerade elektronspinnen är antiparallella Situationen med parallella ligger högre I energi Pulstekniker I NMR ● ● ● ● Ett prov bestående av spinn ½ kärnor har ett banimpulsmoment på (I(I+1))1/2 = (3)1/2/2 Dess projektion I z-riktningen är m I = ½ Pga. Heisenbergs obestämbarhetsrelation vet vi inte dess projektion I x- och y-riktningen Vektorn bildar en vinkel på 55 grader mot zaxels Pulstekniker I NMR ● ● ● I frånvaro av externa magnetfält är antalet molekyler med spinn-upp lika med antalet spinnner molekyler Magnetiseringen är = 0 Sätter man på ett magnetfält har spinn-upp lägre energi än spinn-ner ● Fler molekyler är I spinn-upp än I spinn-ner ● Provet är magnetiserat ● Man har en nettomagnetiseringsvektor I zriktningen, som precesserar runt z-axeln Pulstekniker I NMR ● ● ● En kort puls av en I xy-planet cirkulärt polariserad radiosignal Dess frekvens är lika med Larmorfrekvensen för det externa magnetfältet Man väljer man pulsens längd (mikrosekunder) så att magnetiseringsvektorn flippar t.ex. 90 grader Pulstekniker I NMR ● Det finns många olika typer av pulstekniker ● De ger information om relaxationstider ● ● ● Dvs. Hastigheter för olika händelser I molekyler och kemiska system De utnyttja även I fler-dimensionell NMR Fler-dimensionell NMR används för att separera många signaler från varandra Elektron paramagnetic resonans ● ● ● ● Med EPR eller ESR undersöker man hur elektronens spin påverkas av externa magnetfält Energinivåerna för elektronspinn I ett yttre magnetfält är Elektronens g-värde ● ● Som I NMR har olika molekyler olika kemisk miljö, de har därför olika lokala magnetfält I stället för att introducera EPR kemiska skift introduceras generella g-värden ● g=(1-σ)ge = radikalens g-värde ● C6H6- EPR spektra Hyperfinstruktur I EPR ● Enskilda resonanslinjer I EPR spektret spaltas I finstruktur pga närliggande magnetiska moment Spinnpolarisation ● ● En oparad elektron polariserar spinnet sin näromgivning T.ex spinnet på Fe I häm leder till spinn även på C och N atomer I porfyrinet