Vårt DNA mestadels skräp
advertisement

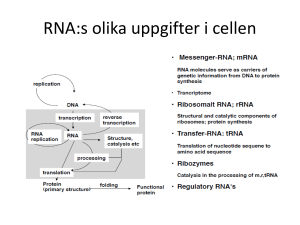
Daniel Sehic Vårt DNA mestadels skräp Vårt DNA består till stor del av skräp-DNA som kallas introner. Dessa introner tycks inte ha någon som helst funktion och redigeras bort av cellen innan DNA används av kroppen. Resterande del består av DNA som kodar för gener, så kallade exoner. För att framställa sådant ”rent” kodande DNA måste man först omvandla DNA till RNA. I denna process tas alla introner bort. RNA består därför bara av kodande gener som cellerna har användning för. När man vill ta ut generna utan att få med skräpet används RNA som en mall för DNA-tillverkning. DNA som har tillverkats från RNA är därför fritt från skräp och kallas komplementärt DNA (cDNA). När man sedan tar ut flera olika geners cDNA får man ett bibliotek av cDNA. Mitt examensarbete har gått ut på att undersöka och förbättra framställningen av cDNAbibliotek. När cDNA:t väl framställts är nästa steg att klippa det med restriktionsenzym. Detta gör att det blir lättare att hantera fragmenten och sedan läsa av cDNA-koden genom olika sekvenseringsmetoder. Bitarna av cDNA klistras sedan in i en vektor som sedan sätts in i en bakteriecell. Vektorn är en DNA-bit som binder till cDNA:t i båda ändarna och på så sätt bildar en cirkel. Anledningen till detta är att bakterien bara kan kopiera DNA:t om det är cirkulärt. Bakterierna odlas och eftersom de förökar sig genom delning blir alla bakterieceller som tagit upp cDNA-plasmiden identiska med varandra. För att kunna ta ut cDNA-generna man är intresserad av märks de med radioaktivitet. När man sedan framkallar cDNA:t på film kan man tydligt se vilka områden som har högst radioaktivitet och som består av de intressanta generna. Sedan är det bara att ta ut de bakterieceller som innehåller generna och fastställa cDNAkoden via sekvensering. Stegen som undersöktes mera utförligt var steget när vektor och cDNA klistrades ihop (ligationen) och när dessa togs upp av bakteriecellen (transformering). Dessutom gjordes ett cDNA-bibliotek av en dunnart (Sminthopsis crassicaudata) som är ett litet pungdjur (bild till höger). Hopklistringen av vektor och cDNA visade sig vara mest effektiv vid temperaturer på 16°C. Bakteriecellens upptagning av den hopklistrade vektorn och cDNA:t visade sig fungera bäst när det transformerades via elektroporering. Elektroporering är precis vad det låter som, med hjälp av en elektrisk urladdning poreras cellen och hål bildad i cellens yttermembran. Genom hålen kan sedan cDNA:t ta sig in i cellen. E. coli bakteriestammen som gav bäst resultat var JM109. Den effektivaste cellkoncentrationen visade sig vara något lägre än vad som sades i protokollet och elektroporeringsstyrkan var mest optimal mellan 1,8 och 2,2kV. Elektroporerade celler kunde förvaras på is i ett par dagar. De största förbättringarna som gjordes var transformeringssteget som förbättrades så att det blev 10 gånger så effektivt. Handledare: Axel Janke Examensarbete 20 p i Molekylärgenetik. Vt 2004. Institutionen för cell- and organismbiologi, Lunds universitet. Improving cDNA library techniques and establishing a cDNA library from the dunnart (Sminthopsis crassicaudata) Abstract The aim of this study was to investigate the parameters for the successful construction of cDNA libraries and to improve the efficiency in cDNA library constructions. Steps in the construction process were investigated, such as the transformation by electroporation, the ligation and the digest of both the vector and the insert. Different cells were also tested. To produce cDNA, the CreatorTM SMARTTM cDNA Library Construction Kit was used. It was concluded that using mRNA instead of total RNA gives a better result. The downside of mRNA is the high amount of RNA that is needed in the process. The first crucial step that was investigated was the ligation of vector and cDNA insert. The ligation temperature of the protocol was 16°C and my experiments showed this temperature was actually best of those that were tested. The ligase concentration and the time factor of the ligation are still unclear and will have to be examined more closely at some other stage. The second step that was investigated was the efficiency of the transformation by electroporation. The electroporation method proved to be a good method for transformation of plasmids into cells. The best E. coli cell strain tested for transformation by electroporation was JM109. It had the highest efficiency at cell concentrations between 175-225 U/ml (OD600). The optimum voltage setting on the electroporator was between 1.8 and 2.2kV. The transformed cells could also be stored for 2 days on ice without any significant reduction of the surviving transformants. After 3 days however the number of transformed cells were reduced to 50%. The results also show that one does not get more transformed cells when electroporating multiple times and that the effect on time delay when adding SOB-medium to the transformed cells are crucial and should not take longer than 15 sec before the number of transformations decrease. The last step was making a cDNA library of Sminthopsis crassicaudata, the dunnart (a marsupial) with the SMARTTM kit. However no useful sequences could be obtained during the final stage of the project. Probably because of the selected sequencing method. Many different factors was investigated and improved. For example the transformation step was improved 10 fold!