I atomens inre
advertisement

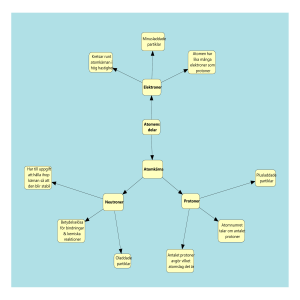
146 Atomer, joner och kemiska reaktioner 5~---------------------------- --Ifl nehå 11 1 sid. 148 I atomens inre sid. 152 Periodiska systemet Metaller Joner -- sid. 156 sid. 162 Syror och baser 2 sid. 166 Salter sid. 170 FUNDERA PÅ • Alla ämnen är uppbyggda av atomer. Men hur "vet" en atom om den ska vara en kolatom eller en silveratom? FOKUS PÅ ./ Atommodell ./ Elementarpartiklar ./ Atomnummer - proton, neutron och elektron och atommassa ./ Elektronskal och valenselektroner ./ Isotop ./ Periodiska systemet - period och grupp ./ Metaller, icke-metaller ./ Alkalimetaller, och halvmetaller halogener och ädelgaser ./ Metallers egenskaper - metallbindning ./ Järnframställning - masugn, färskning och stål ./ Jon och jonbindning ./ Ädelgasstruktur ./ Syra och bas ./ Vätejoner och hydroxidjoner ./ Neutralisation ./ Salt och jonförening Atomer, joner och kemiska reaktioner 147 I atomens inre NÄR DU HAR ARBETAT MED AVSNITTET I ATOMENS INRE KAN DU • beskriva hur en atom är uppbyggd • redogöra för skillnaden mellan atomerna från olika grundämnen • redogöra för begreppen atomnummer och atommassa John Dalton, 1803 en odelbar partikel • förklara begreppen elektronskal och valenselektron • förklara begreppet isotop Atomer är inte odelbara som man en gång trodde. När atomer delasfrigörs enorma mängder energi. Men hur ser atomerna egentligen ut inuti? Och vad är en atommodell? • Ernest Rutherford, 1909 en kärna omgiven av elektroner Atomrnodeller Som du säkert kommer ihåg är all materia uppbyggd av atomer och tillsammans bildar atomerna större molekyler. Vid kemiska reaktioner bildas nya ämnen genom att atomerna kombineras om till nya molekyler, till exempel när glukos reagerar med syre och det bildas koldioxid och vatten. Vad som exakt händer med atomerna vid en kemisk reaktion går inte att se, atomerna är helt enkelt för små. Därför har kemister och fysiker genom åren konstruerat olika modeller över atomers Niels Bohr, 1913 elektronerna omger kärnan likt ett planetsystem byggnad. Med hjälp av modellerna har man sedan försökt förstå och förutse vad som sker vid olika kemiska reaktioner. Så arbetar man ofta inom naturvetenskapen. Forskare konstruerar en modell för att förklara resultaten från sina experiment. Sedan testas modellen genom nya experiment. Stämmer modellen med resultaten testar man den med fler experiment för att vara säker. Om det visar sig att modellen inte stämmer måste man ändra den och testa igen. På så sätt utvecklas och förfinas modeller samtidigt som vi får allt bättre förståelse för det vi undersöker. Erwin Schrödinger, 1926 kärnan omges av ett elektronmoln 148 Atomer, joner och kemiska reaktioner ~II------------------ Atomens delar Intresset för vad materia är uppbyggt av och hur de bildas har alltid varit stort. Hypoteserna har varit många, men den första egentliga atommodellen utvecklas redan på 400-talet f.Kr. Av olika anledningar glömdes den bort. pet var inte förrän kring år 1800 som atomläran åter började diskuteras. I den första modellen såg man atomen som en odelbar partikel. Numera vet vi att atomen är uppbyggd av olika partiklar som gemensamt kallas elementarpartiklar. I mitten finns atomkärnan som består av protoner och neutroner. En atom består av mindre elementarpartiklar. Protonerna är positivt laddade. Neutronerna är oladdade, eller neutrala. Runt kärnan rör sig elektroner som är negativt laddade. I en atom finns det lika många elektroner som det finns protoner. Eftersom elektronerna och protonerna har motsatta laddningar, blir den totala laddningen hos atomen noll. Proton Neutron Elektron Antalet protoner ger grundämnet Ett grundämne är ett ämne som är uppbyggt av ett stort antal likadana atomer. Kol och syre är två exempel på grundämnen. Kol är uppbyggt av kolatomer och syre av syreatomer. Skillnaden mellan kolatomer och syreatomer är att de inte har lika många protoner i atomkärnan. Kolatomen har 6 protoner i atomkärnan och syre har 8 protoner i atomkärnan. Eftersom det kan finnas något mer än hundra protoner i en atomkärna, finns det också något mer än hundra olika grundämnen. -------------------------.1 5 I atomens inre 149 e l Elektronskal K Den danske fysikern Niels Bohrs atommodell från år 1913 är fort- * farande en bra modell för att beskriva hur en atom är uppbyggd. + Enligt Bohrs modell rör sig elektronerna runt atomkärnan på bestämda avstånd från kärnan. De finns i olika elektronskal. Elektronskalen har fått bokstavsnamn och kallas K-, L-,M-, N-skalet osv. :,j- e e Ju längre från kärnan desto fler elektroner får plats i skalen. I det innersta K-skalet får det plats högst 2 elektroner. I nästa skal, L-skalet, får det plats högst 8 elektroner. M-skalet kan innehålla 18 En vanlig kolatom har 6 protoner, 6 neutroner och 6 elektroner. Två elektroner i K-skalet ochfyra elektroner och N-skalet 32 elektroner osv. i L-skalet. Valenselektroner e Elektronerna lägger sig i skalen så nära atomkärnan som möjligt. När skalet är fullt hamnar de i skalet utanför. Elektronerna i det yttersta skalet kallas valenselektroner. Det är valenselektronerna som ger ett 3+ ämne dess kemiska egenskaper. Atomer som har alla elektronskal fyllda är stabila. Atomer strävar El efter att vara stabila. Därför kan atomer med få valenselektroner lämna över elektroner till andra atomer, för att bli stabila. litium. li Atomer med många valenselektroner tar i stället upp elektroner från andra atomer, för att få fyllda elektronskal. Till exempellitiumatomen e har en ensam valenselektron som den lätt lämnar över, för att få en '" e e stabil struktur. Kloratomen däremot saknar en elektron för att bli stabil och tar därför lätt upp en elektron. Atomnummer e 9+ och atommassa 6> Grundämnets atomnummer talar om hur många protoner det finns i atomkärnan. Kol har alltså atomnummer 6 och syre har atomnummer 8. Väte som också är ett grundämne, har bara en proton i atomkärnan. Väte har då atomnummer 1, medan grundämnet nobelium med sina 102 protoner har atomnummer 102. Trots att atomerna är så små har man med olika metoder lyckats bestämma vad en atom väger. Väteatomen med bara en proton är den lättaste avalla atomer och väger 1,7 . 10-27 kg (0,0000000000000000000000000017 150 kg). Atomer, joner och kemiska reaktioner fs 1----------------- fluor. F Grundämne Väte, H Helium, He Atomnummer Atommassa lu litium, 2 3 4u 7u li Det är inte praktiskt att ange atomers massa i kilogram. Därför har man infört en speciell atommassenhet, u. Enheten u kommer från det engelska ordet unit, som betyder enhet. Elektronernas massa är så liten att den är försumbar. 99,9 % av atomens massa ligger i kärnan där protonerna och neutronerna finns. + Protoner och neutroner har samma massa, l u. En väteatom som består aven proton och en elektron väger l u. En heliumatom med två protoner och två neutroner väger 4 u och en litiumatom med 3 protoner och 4 neutroner väger 7 u. Vanligt väte Isotoper Det är alltså antalet protoner som bestämmer vilket grundämne atomen är. I ett grundämne har atomerna alltid samma antal protoner, men antalet neutroner kan variera. De olika varianterna av ett grundämne Deuterium kallas isotoper. Det är samma grundämne, men de har olika massa. Grundämnet väte finns naturligt i tre olika isotoper. Vanligt väte är den vanligaste isotopen och saknar neutroner i kärnan. Den kallas ibland också för protium. Deuterium, som också kallas tungt väte, har en proton och en neutron i atomkärnan. Deuterium väger dubbelt så mycket som vanligt väte, 2 u. Tritium, som ofta kallas extra tungt väte, har en proton och två neutroner i kärnan. Tritium väger tre gånger så mycket som vanligt väte, alltså 3 u. + Tritium / Kan du? Rätt eller fel? 1. Vilka laddningar har protoner, neutroner och elektroner? a) Valenselektroner är elektronerna i atomens yttersta skal. 2. Vilka partiklar finns i atomens kärna? 3. Vad anger ett grundämnes atomnummer? 4. Vad är skillnaden mellan två isotoper av samma grundämne? -------------------------~'i.rr5J b) Kolatomer har 12 protoner. c) Isotoper är två olika grundämnen. I atomens inre ••••••• tfII----- 151 JJ----