Arv + miljö = diabetes?
advertisement

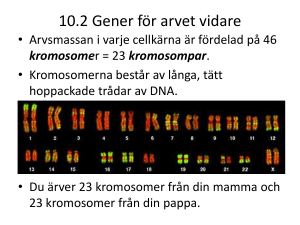
Arv + miljö = diabetes? Kristina Lejon universitetslektor, immunologi, Institutionen för klinisk mikrobiologi Vad är det som gör att vi får diabetes? Anna Möllsten var nyss inne på den frågan och visade att ärftligheten, genetiken, ligger i botten av ett komplicerat orsaksmönster. Men hur kan man ens veta att något är ärftligt? Ett sätt är att titta på familjer. Ni som sitter här har kanske barn, syskon eller föräldrar med diabetes. Faktum är att i tvåbarnsfamiljer där ett syskon har typ 1-diabetes löper det andra syskonet 15 gånger högre risk än normalt för samma sjukdom. Det kan kännas som en hisklig siffra, men eftersom den allmänna risken – i hela befolkningen – är mindre än en halv procent (0,4 %) betyder en femtonfaldigad risk inte mer än 6 % totalt sett. Med andra ord: Bland 100 familjer där man har ett barn med typ 1-diabetes kommer sex (6) att ha ytterligare ett barn med sjukdomen. När det gäller typ 2-diabetes är risken för ett syskon dubbelt så hög som den normala, men i och med att den sjukdomen är så mycket vanligare i befolkningen (4–5 %) blir det faktiskt fler familjer som kommer att ha ytterligare ett syskon med typ 2-diabetes. Ett annat sätt att mäta ärftlighet är att studera tvillingar. Enäggstvillingar är särskilt intressanta, eftersom båda individerna har precis samma gener och genvarianter. Om en av dem får en sjukdom kan man följa den andra under lång tid och därigenom se hur stor andel av enäggstvillingarna som drabbas. För typ 1-diabetes har man kommit fram till att lite mer än 70 % av enäggstvillingarna förr eller senare får sjukdomen om den andra tvillingen har den; för typ 2-diabetes är det 100 %, dvs. alla. Vad säger det här egentligen? Ja, att det finns en ärftlig komponent men att det inte är hela sanningen utan det finns också en stark miljöfaktor. Man 23 Figur 1. Värt att veta om arvsmassan (DNA-molekylerna) i våra celler. kan se generna i arvsmassan (DNA) som ett arkiv med ritningen över kroppen, se Figur 1. DNA består av fyra byggstenar (förkortade A, C, G och T) som används parvis för att bygga en tunn tråd, så tunn att det ryms två meter i varje cell i kroppen. DNA-molekylerna packas som kromosomer, och faktum är att vi har samma uppsättning kromosomer (två gånger 23 olika) i alla celler i hela kroppen. Det betyder att det är möjligt att titta på arvsmassan oavsett om DNA hämtas från huden, genom ett blodprov eller på andra sätt. Det är alltså lätt att komma åt att studera arvsmassan. En gen är ingenting annat än ett stycke DNA, alltså ett avsnitt med byggstenarna i en given ordning, och gener används som mallar för att bygga proteiner. Med andra ord är arvsmassan ritningen för alla proteiner i kroppen. Vi människor har ungefär 30 000 gener. När man kartlade den mänskliga arvsmassan var förväntningarna höga: ”Vi måste väl ha åtminstone 100 000 gener. Bananflugor har ju bara 12 000, och vi är mycket förmer än de…”. Men i slutänden visade det sig att vi bara har ungefär dubbelt så många gener som bananflugan. Kanske är vi inte så komplicerade som vi tror… 24 Figur 2. Sektioner av byggstenarna i DNA (gener) används som mall när cellerna producerar de proteiner (äggviteämnen) som står för alla funktioner i kroppen. Små variationer i DNA gör skillnad Proteinerna som byggs med våra gener som mall, se Figur 2, står för alla funktioner i våra kroppar. Insulin till exempel är ett protein – liksom de enzymer som reglerar matsmältningen, de som transporterar syre i blodet och de som ger oss vår ögonfärg. Men vad är det egentligen som skiljer oss åt? Ja, det handlar om ordningen på byggstenarna. En person kan ha en viss följd i en gen medan en annan kan ha nästan exakt samma följd med undantag för ett enda ställe. I Figur 3 är det bara en byggsten av 1 000 som skiljer sig åt, G istället för A, i den gen som kodar för ögonfärgen. En så pass liten ändring i ritningarna får ändå konsekvenser för det protein som tillverkas. Den kan bli orsaken till en annan ögonfärg eller till att något matsmältningsenzym fungerar på ett lite annat sätt. Den kan också bidra till typ I-diabetes. 25 Figur 3. Skillnaden mellan blå och brun ögonfärg bottnar i att 1 av 1 000 byggstenar i genen skiljer sig åt. Inringat på de översta bilderna ser man ett G i den ena sekvensen och ett A i den andra. Det är viktigt att förstå att de här skillnaderna i DNA är väldigt små och inget annat än naturliga varianter. Det finns inga typiska ”diabetesgener” som rakt av leder till att den person som bär dem ovillkorligen får typ 1- eller typ 2-diabetes. Det finns bara normala varianter som i olyckliga kombinationer kan göra någon benägen för sjukdomen. Det är inte fråga om att jag har ”gett mitt barn diabetes”, utan det handlar om normala varianter i en kombination som just hos mig som individ gav en sårbarhet eller en benägenhet att få sjukdomen. Sedan ska vi inte heller glömma att det genetiska arvet måste finns i en viss miljö för att slå igenom. Faktum är att klimatet har visat sig spela en roll, liksom var vi befinner oss geografiskt. Infektioner har definitivt också betydelse, även om det ännu inte är helt klarlagt vilka infektioner som kan utlösa diabetes. Kosten är också viktig, liksom flera andra omgivningsfaktorer. Som helhet står vi inför en komplex bild. Man kan se det så att man av en olycklig slump utsätts för allt fler av de riskabla faktorerna. Till slut kommer bägaren att rinna över och man får diabetes. 26 Den här komplicerade bakgrunden gör diabetessjukdomen svår att studera eftersom så många små delar bidrar, men det ger också ett bra hopp: Om det handlar om så många faktorer som får bägaren att rinna över kanske det räcker om vi kan ta bort någon enstaka? Kanske går det i framtiden att kontrollera så pass mycket att bägaren inte behöver rinna över. Figur 4. De mörka, markerade områdena på våra kromosomer har förknippats med ökad risk för typ 1-diabetes. Figur 4 är en ritning på människans kromosomer. Varje cell har två uppsättningar av 22 kromosomer plus könskromosomen, totalt är antalet kromosomer alltså 46. De små strecken bredvid nästan alla kromosomer på bilden markerar områden som har förknippats med risk för typ 1-diabetes. Poängen med bilden är bara att visa hur otroligt många platser i DNA som man har kunnat förknippa med sjukdomen. Det handlar inte om ett, inte om fem, inte om tio utan om upp till 50 anlag. I många fall har man bara kunna identifiera misstänkta regioner: Man vet ungefär var på kromosomen det finns ett arvsanlag som påverkar, men i det området kan det finnas både 50 eller 100 möjliga gener. Frågan är hur vi ska göra för att få veta vilken av dem alla som faktiskt gör skillnad. Där återstår mycket arbete. Figur 5 är en bild som nyligen publicerades av en grupp forskare som har räknat ut hur mycket risken ökar med att ha ett visst anlag i relation 27 Figur 5. Sammanställning av hur mycket enskilda arvsanlag påverkar och ökar risken för typ 1-diabetes hos den som har ett syskon med sjukdomen. till att inte ha det hos personer som har syskon med diabetes. Kurvan är kumulativ, vilket betyder att riskerna läggs på varandra. Den börjar med 3,5 gånger ökad risk med ett visst anlag och som nummer två från vänster kommer faktiskt insulingenen (INS). Den finns i olika varianter och vissa har förknippats med ökad diabetesrisk. Sedan ser ni att varje enskild, ny genvariant bara bidrar väldigt lite till att öka risken. Att ha alla gener på bilden eller bara de 2-3 första gör faktiskt inte så stor skillnad i risknivå. Vad händer i immunsystemet? Allt det här gör det ganska komplicerat att försöka ta reda på vad de olika, enskilda anlagen egentligen gör. Vi har sagt att typ 1-diabetes är en autoimmun sjukdom, vilket innebär att immunsystemet attackerar de insulinproducerande cellerna i kroppen och förstör dem som om de vore virus eller bakterier. Varje arvsanlag styr ju någon funktion i kroppen och man skulle då kunna tänka sig att generna påverkar t.ex. T-lymfocyter, som är en typ av vita blodkroppar i immunsystemet, eller B-lymfocyter, som är en annan typ. Vissa gener skulle påverka lymfocyterna, en annan skulle ge dem någon egenskap och en tredje påverka bukspottskörtelns funktion. Till det kommer sedan de miljöfaktorer som medverkar till att man får typ 1-diabetes. Vår egen forskning går ut på att försöka bena ut vad arvsanlagen egentligen gör och vad som händer i immunsystemet. Vi har gjort en djurmodell 28 för arbetet och använder den så kallade NOD-musen (eng. Non Obese Diabetic – ”diabetes utan fetma”). Att namnet blev lite konstigt beror på att det redan fanns en ”fet” diabetesmus tillgänglig för forskarna när den kom. Det var faktiskt en uppmärksam djurskötare i Japan som såg att det var blött i en bur. Just den musen hade diabetes och man kunde då ta fram den här musstammen. I praktiken är NOD-mössen inavlade vilket betyder att alla individer är genetiskt identiska – de är enäggstvillingar allihop! Möss är förstås inte människor, men jag sade tidigare att bananflugor inte är så skilda från oss genetiskt sett och jämfört med möss är vi väldigt lika. Det viktiga med NOD-mössen är att sjukdomen uppkommer spontant. Man gör ingenting särskilt med dem utan låter dem bara bo i burar och äta normalt. Ändå får de typ 1-diabetes med ett förlopp som är väldigt likt det hos människan: De börjar kissa och dricka mycket, och tittar man med mikroskop i deras bukspottkörtel kan man se att immunsystemets celler har börjat invadera de så kallade Langerhanska öarna, där de insulinproducerande cellerna finns. Det pågår en autoimmun process i musen som är väldigt lik den som sker i en människa med typ 1-diabetes. Vi har fokuserat vår forskning på B-lymfocyter. De tillverkar antikroppar i vårt immunsystem och ett av de mest tydliga tecknen på att en person håller på att utveckla typ 1-diabetes är att det finns antikroppar mot kroppens egna proteiner, så kallade autoantikroppar. Istället för att bli antikroppar mot till exempel influensavirus är de antikroppar mot det som finns i bukspottkörteln. Det finns flera olika delar av de insulinproducerande cellerna som kroppen kan bilda antikroppar mot. Slår man ut B-lymfocyterna hos personer som precis har utvecklat typ 1-diabetes, och det kan man göra på olika sätt, får man faktiskt tillbaka en del av förmågan att göra insulin hos de insulinproducerande cellerna. Figur 6 visar resultat från en studie som vi har publicerat och som nu upprepas i större skala. Hos NOD-mössen finns autoantikroppar och slår man ut deras B-lymfocyter får de inte diabetes. Men vid ett immunsvar, till exempel på grund av en vaccination, kommer NOD-mössens immunsystem att agera väldigt starkt: Mycket hårdare och under mycket längre tid än hos friska möss. Det är detta fenomen som vi närgranskar i vår forskning. Man kan testa immunförsvaret genom att vaccinera mössen på lite olika sätt och mäta hur mycket de svarar på vaccinationen genom att titta efter 29 Figur 6. Jämförelser mellan immunsvarens nivå och varaktighet hos diabetiska (NOD) och andra möss efter vaccinationer. I nästan alla sammanhang är immunsvaret längre och kraftigare hos NOD-mössen. (Sundström, Lejon: J. Autoimm. 2010) antikroppar mot det man har vaccinerat emot. Diagrammen i figuren visar att diabetesmusen bildar mycket antikroppar under väldigt lång tid: Ännu 100 dagar efter vaccineringen har NOD-mössen fortfarande ett väldigt starkt immunsvar. Man kan säga att de svarar för bra och för starkt om man jämför med friska kontrollmöss. Vi har undersökt vilka gener som styr det här och om det är samma gener som man redan har förknippat med diabetes. Vi vill försöka hitta de här generna för att se om och hur de påverkar funktionen hos en insulinproducerande cell så att det ger upphov till diabetes. Sedan är det naturligtvis intressant om det vi hittar hos mössen visar sig vara samma gener som har visats i människa eller åtminstone samma områden på kromosomerna – men så långt har vi inte kommit än. 30 Figur 7. Resultatet av en genetisk analys på avkomman av NOD-möss parade med friska möss. De inringade fyra områdena på kromosomerna visar sig ha samband med typ 1-diabetes. Vid den genetiska analys vi har gjort, se Figur 7, är det förstås en stor fördel att mössen får en ny generation ungefär var tredje månad. Det går med andra ord väsentligt snabbare än hos människan när man ska försöka hitta de gener som styr. Det man gör är att para möss från olika stammar, diabetesmöss (NOD) med friska. När man parar deras avkommor fördelar sig de olika arvsanlagen från ursprungsföräldrarna i olika mängd bland ”barnbarnen”. Det här fenomenet kan man se i naturen, till exempel genom att lila och vita lupiner ger rosa blommor. Vi har analyserat 300–400 möss i tredje generationen genom att vaccinera dem för att se vilka barnbarn som svarar på samma sätt som den diabetiska musen och vilka som svarar som den friska mor- eller farföräldern. Vi har sedan tittat på vilka arvsanlag som styr detta, och det kan man göra med modern DNA-teknik. Figuren visar resultatet av analysen: Fyra inringade områden på musens kromosomer verkar ha någonting att göra med typ 1-diabetes. Ni ser att bilden är ganska lik den ni såg tidigare, Figur 4, med undantag för att mössen har något färre kromosomer än människor. I Figur 7 markeras också de områden på musens kromosomer som andra forskargrupper har kunnat förknippa med typ 1-diabetes, det är de mörka områdena med bokstavsbeteckningar bredvid. Då 31 framgår det faktiskt att tre av de fyra områden som vi har påvisat redan tidigare har knutits till diabetes. Kan man då säga att vi har lyckats bevisa att det här starka immunsvaret vid vaccination faktiskt har att göra med diabetes? Nej, där är vi inte ännu utan nu måste vi titta mer i detalj. Ett sätt att göra det är att utnyttja fördelen med att använda möss, närmare bestämt det faktum att man kan ta fram olika genvarianter. Figur 8 visar hur vi har testat olika genvarianter i kromosom 17 genom att byta arvsanlag. Vi har tagit fram ett antal varianter av möss där vi har bytt ut diabetesmusens varianter i det här området mot den friska musens varianter. Figuren visar analyser på de olika mös�sen och man kan uttrycka det som att vi har testat olika pusselbitar: Om vi lägger in den här biten, kommer de här mössen att svara på vaccination på samma sätt som diabetesmöss? Så där testar man olika varianter och arbetar väldigt detaljerat. Staplarna till höger i figuren visar hur starkt de olika musvarianterna svarar på vaccinationen – ju högre stapel desto starkare vaccinationssvar. NOD-musen längst till vänster har ett starkt svar och den vanliga musen närmast den ett svagare svar. De båda varianter som svarar starkast har en gemensam pusselbit från NOD-musens arvsmassa (inringad i mittbilden). Vad kan man dra för slutsats av det? Jo, att vi har att göra med Figur 8. Arbete med genetiska pusselbitar. Genom att ta fram genvarianter hos mössen blir det möjligt att i detalj testa vilken del av kromosomen som är inblandad i det kraftiga immunsvaret vid vaccination. 32 ett område på kromosomen som verkar styra svaret på vaccinationen. På det här sättet har vi förfinat vår sökning och zoomat in från ett jättestort område till en mycket mindre del av kromosomen. Där någonstans finns de gener som styr hur mycket musen svara på vaccination. Den hemska tabellen i Figur 9 illustrerar varför vi inte har kommit längre. Även om vi har lyckats göra det misstänkta området mycket mindre finns det ändå väldigt många gener kvar i området. Nästa steg för oss är att gå in och titta på dem alla för att försöka fastställa om någon av dem skulle kunna vara den gen som styr vaccinationssvaret och varför just den är förändrad i diabetesmusen jämfört med den friska musen. Nästa fråga är då om det är precis den här genen som gör att mössen får diabetes. Först då har vi lyckats koppla ihop det starka immunsvaret mot vaccinationen med diabetes. Det som händer vid autoimmuna sjukdomar är ju att man får ett felaktigt immunsvar mot det som finns och ska finnas i kroppen. Immunsystemet ska ju känna igen och låta det kroppsegna vara, men vid typ 1-diabetes svarar det för starkt på den egna kroppen. Vad kan man då göra med informationen om vi får fram den? Ja, om man känner till mekanismen skulle man till exempel kunna förutsäga sjukdomen. Redan idag mäter vi autoantikroppar i blodet för att se hur sjukdo- Figur 9. Trots pusslandet kvarstår ännu en lång lista med gener i det misstänkta området som måste studeras ytterligare. 33 men kan tänkas utveckla sig. Kanske går det att utveckla metoder för att förutspå och påverka utvecklingen av typ 1-diabetes? Sedan är det ju också så att om vi förstår de bakomliggande orsakerna ökar möjligheterna att ta fram effektivare behandlingar. Sverker Olofsson: Du antyder att om man kunde förutspå sjukdomen skulle man kunna hindra den med ganska enkla åtgärder. Hur då? Kristina Lejon: Ja, jag påstår nog inte att det är enkelt, men jag tänker att i och med att det är så många små faktorer som bidrar kanske man kan påverka immunsystemet på något sätt, antingen genom att under en kort period slå ut vissa celler – det gör man redan idag för att behandla vissa sjukdomar – eller något annat, kanske en liten tablett som gör att man inte får diabetes. Sverker Olofsson: Något sådant är väl ett drömscenario? Kristina Lejon: Ja, om man skulle kunna förutspå en sjukdom uppstår ju frågan om vad man ska försöka påverka. Immunsystemet är väldigt dynamiskt, en massa celler kommer och går hela tiden. Det man vill åstadkomma är ju en god balans istället för den dåliga hos en person som utvecklar typ 1-diabetes. Man kanske kan ge någon typ av vaccination mot ett virus så att immunsvaret börjar rikta sig mot det istället för kroppens egna celler. Men sedan är det ju också viktigt att om man överhuvudtaget ska tänka så måste man vara säker på att den typen av behandling är ofarlig. Sverker Olofsson: Till sist bara, det är otroligt spännande att se, även om jag inte begriper så mycket av de här kromosomerna, men om man kan visa var genen sitter i kromosomen – kan man gå in och reparera den? Kristina Lejon: Nja, du talar om genterapi men då handlar det om verkligt skadade arvsanlag, till exempel vid cystisk fibros eller andra sjukdomar, som i vissa fall kan bytas ut. Man ska komma ihåg att generna vid typ 1-diabetes är helt naturliga varianter. De kan mycket väl vara bra för något annat men dåligt i just det här sammanhanget. Att byta ut dem är därför ingen riktigt bra idé. Man ska komma ihåg det att de arvsanlag som finns i befolkningen idag åtminstone någon gång har haft ett syfte. Den genetiska mångfalden hos oss människor har gett oss en fördel under evolutionen, men nu befinner vi oss kanske i en miljö där vissa genkombinationer inte är bra även om de i andra miljöer skulle vara fördelaktiga. 34