LUNDS UNIVERSITET
KEMICENTRUM
Övningstentamen KEMA00 Allmän och analytisk kemi, 7,5 hp VT-2012
Tillåtna hjälpmedel: Skrivdon, formelblad för KEMA00 med periodiskt system,
atomvikter, omräkningsfaktorer och konstanter samt miniräknare.
Alla uppgifter ger, rätt besvarade, lika poäng. Skriv högst en uppgift per blad.
I förekommande fall kan gaser och lösningar antas vara ideala samt ∆H° och ∆S°
oberoende av temperaturen. I förekommande fall skall beräkningarna redovisas.
1. a)
Ange tre atomer som har sju valenselektroner.
b) Ge de fullständiga elektronkonfigurationerna för dessa tre atomer i
grundtillstånden.
c)
Vid kemiska rektioner bildar atomerna motsvarande joner. Ange dessa tre joner.
d) Vilken av de tre jonerna har störst polariserbarhet? Motivera svaret.
Ange lewisstruktur, elektronarrangemang och geometrisk form för H3O+, NO2+
och BCl3.
b) Ordna följande ämnen efter ökande kokpunkt HF, HCl och HBr. Motivera
ordningen!
2. a)
3.
Vid fotosyntesen bildas glukos från koldioxid och vatten enligt formeln
6 CO2(g) + 6 H2O(g) → C6H12O6(s) + 6 O2(g)
Beräkna volymen CO2(g) med partialtrycket 34,2 Pa och temperaturen 20,0°C
som krävs för att framställa 10,0 g glukos.
4.
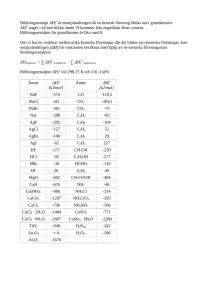
Beräkna ∆H° för reaktionen
H2(g) + Cl2(g) → 2 HCl(g).
Använd följande data:
NH3(g) + HCl(g) → NH4Cl(s)
N2(g) + 3 H2(g) → 2 NH3(g)
N2(g) + 4 H2(g) + Cl2(g) → 2 NH4Cl(s)
5.
∆H° = -176,0 kJ/mol
∆H° = -92,2 kJ/mol
∆H° = -628,9 kJ/mol
För vatten gäller följande termodynamiska data vid 25°C:
ΔHf°(H2O(l)) = -285,83 kJ/mol, ΔHf°(H2O(g)) = -241,82 kJ/mol,
Sm°(H2O(l)) = 69,91 J/(K·mol), Sm°(H2O(g)) = 188,83 J/(K·mol).
a)
Beräkna ΔG° vid 21°C för processen H2O(l) ⇌ H2O(g).
b) Beräkna partialtrycket H2O(g) i jämvikt med H2O(l) vid 21°C.
LUNDS UNIVERSITET
KEMICENTRUM
6.
Ett vanligt badkar rymmer 410 liter vatten. Beräkna massan grafit som behöver
förbrännas i syrgas för att värma 410 liter vatten från 12°C till 39°C. Vattnet har
densiteten 1,0 g/ml och värmekapaciteten 4,18 J/(K·g). För reaktionen
C(grafit) + O2(g) → CO2(g)
är ∆H = -394 kJ/mol.
7.
Halten av s.k. marknära ozon i stadsluft bestäms genom att luften får bubbla
igenom en jodidlösning, varvid reaktionen
O3(g) + 2 I−(aq) + H2O(l) → O2(g) + I2(aq) + 2 OH−(aq)
antas ske fullständigt. Mängden bildad jod bestäms genom titrering med S2O32−,
varvid S4O62− och I− bildas.
144 m3 lundaluft bubblades igenom en lösning med överskott av upplöst KI. Vid
bestämning av mängden bildad jod förbrukades 14,14 ml 0,0508 M Na2 S2O3lösning. Skriv upp en balanserad reaktionsformel för titreringsreaktionen och
beräkna luftens ozonhalt uttryckt i mikrogram per m3 luft.
8.
NH4HS(s) sönderfaller till NH3(g) och H2S(g) enligt formeln
NH4HS(s) ⇌ NH3(g) + H2S(g)
5,1 g NH4HS(s) och 0,400 mol NH3(g) fördes in i en rektionsbehållare med
volymen 2,0 liter. Jämvikt uppnåddes vid 24ºC där jämviktskonstanten är
1,6·10-4. Beräkna partialtrycken av de två gaserna vid jämvikt.
Lycka till!