Växters kvävefixering och kvävemetabolism
advertisement

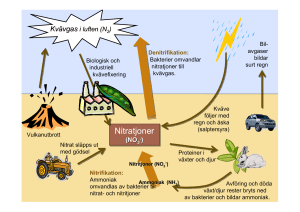
Ragnar Österlund Karolina Vogel Magnus Fjällström Växters kvävefixering och kvävemetabolism En sammanfattning Lärare Margareta Ingelmann Skapad den 2 juni 2004 1 Inledning ............................................................................................................................3 Kvävecykeln ......................................................................................................................3 Fixering..........................................................................................................................4 Nedbrytning och nitrifikation..........................................................................................5 Denitrifikation ................................................................................................................5 Symbiotisk fixering av kväve .............................................................................................6 Fysiologiska skeenden vid bakteriens inträde i växten ....................................................6 Molekylära signaler för bakteriens inträde i växten .........................................................7 Kvävefixeringsprocessen ................................................................................................8 Växters aminosyrasyntes ..................................................................................................10 Bindning av ammoniak till aminosyror .........................................................................10 Transaminationer..........................................................................................................11 Exempel på syntes ........................................................................................................12 Referenser ........................................................................................................................14 2 Inledning Kvävecykeln utgör en av de viktigaste näringscyklar som existerar i ett biologiskt kretslopp. Kväve används av levande organismer till att producera ett antal komplexa molekyler såsom aminosyror, proteiner och nukleinsyror. Den största lagringskällan svarar atmosfären för, där existerar kväve som gas, huvudsakligen som N2. Det atmosfäriska förrådet är ungefär en miljon gånger större än det totala kväveinnehållet i levande organismer. Kväve är ett av de viktigaste grundämnena för växterna. Kvävgasmolekylens trippelbindning är mycket stabil och kväve deltar därför sällan i reaktioner. Det finns dock processer i naturen och även industrellt där kvävgas spjälkas. I naturen sker detta med hjälp av enzymer, I laboratoriet sker det under högt tryck och hög temperatur. Trots den stora rikedomen av kväve atmosfären (ca 80 % av luften volym) råder det (i icke manipulerade ekosystem) stor brist på de kväveföreningar som kan upptas av växterna (Malmer, A. 2002, Raven, P. H. 2003, Stryer, L. 2002). De flesta växter och mikroorganismer kan endast ta upp kvävet i två föreningar, som ammoniumjon och som nitrat. De flesta organismer täcker sitt kvävebehov genom att ta upp olika lösta kvävesalter eller konsumera kvävehaltiga föreningar som t ex proteiner i väldigt små mängder. Ammoniak upptas av växter men metaboliseras snabbt, då ammoniak i höga koncentrationer är giftigt. Andra större förråd av kväve är organisk material i jord och oceaner. Djur upptar kväve till metabolism genom konsumtion av levande och dött material. Kvävet används av djur till tillväxt och reproduktion, system vilka innehåller molekyler med kväveföreningar. Kvävecykeln Figur 1 - Bilden visar främst de mikrobiella transformationerna. 3 Fyra viktiga processer som deltar i cykeln av kväve genom biosfären är kväve fixering, nedbrytning, nitrifikation, denitrifikation. I Figur 2 visas en översikt av detta förlopp och kvävets former samt enzymerna involverade i transformationerna. Figur 2 – Kvävets olika tillstånd i och utanför växten Fixering *Atmosfärisk fixering, utförs av blixtar där energin i blixtarna bryter kvävemolekylerna som i sin tur reagerar med syre i luften och bildar kväveoxider, vilka löser sig i regn under bildningen av nitrater som faller ner till marken. Atmosfäriskt kväve fixering svarar för 5-8% av den totala kväve fixeringen. *Biologiskt fixering, En del alger samt vissa bakterier har förmågan att fixera kvävgas ur det förråd som finns löst i luft eller vatten, och för på så vis in kväve i ett biologiskt kretslopp. Denna egenskap innehas bl a av bakterier som lever symbiotiskt i ärtväxters eller alträds rötter samt av vissa blågröna alger. Biologiskt kväve fixering sker under en komplex samverkan mellan enzymer och under stor konsumtion av ATP. *Industriell fixering, sker under högt tryck och hög temperatur samt med verkan av katalys. Kväve och väte kombineras till ammoniak . Ammoniak kan användas direkt som gödningsmedel, men det mesta görs om till urea och ammonium nitrat (NH4NO3). I Tabell 1 och Tabell 2 visas antalet ton fixerat kväve via industriell och biologisk väg. Data från olika källor, utarbetad av DF Bezdicek & AC Kennedy, i Microorganisms in Action (eds. JM Lynch & JE Hobbie). Blackwell Scientific Publications 1998. Tabell 1 – icke biologisk fixering Icke biologisk fixering N2 fixerad (106 ton) Industriell 50 Förbränning 20 Blixtar 10 Totalt 80 4 Tabell 2 – biologisk fixering Biologiskt fixering N2 fixerad (106 ton) Jordbruk land 90 Skog och icke-jordbruks land 50 Vatten 35 Totalt 175 Tabell 3 - Exempel av kväve - fixerande bakterier (* betecknar en fotosyntetisk bakterie) Frilevande Symbiotisk med växter Aeroba Anaeroba Legumes Andra växter Azotobakterier Beijerinckia Klebsiella (en del) Cyanobakterier (en del)* Clostridium (some) Desulfovibrio Purple sulphur bacteria* Purple non-sulphur bacteria* Green sulphur bacteria* Rhizobium Frankia Azospirillum Nedbrytning och nitrifikation Nedbrytningen sköts av mikroorganismer som lever på att bryta ner avföring och dött material från djur och växtmaterial. Molekylerna i avföringen och det döda materialet bryts ner till ammoniak. Genom mineralisation av ammoniak frigörs ammoniumjoner (NH4+). Det mesta av denna ammoniak från nedbrytningen av organiskt material i marken görs om till nitrater. Detta sker i två steg: *Bakterier av genus Nitrosomonas oxiderar ammoniak (NH3) till nitriter (NO2-). *Bakerier av genus Nitrobakter oxiderar nitriter till nitrater (NO3-). Dessa två grupper av autotrofa bakterier kallas för nitrifierande bakterier. Genom deras aktiviteter (vilka förser dem med den energin de behöver) blir kväve i form av nitrater och nitriter tillgänglig för växterna att ta upp. Nitrifikationen har en del negativa effekter, bl a är den försurande och nitratet som bildats är lättrörligt i marken. Det bildade nitratet kan därför lätt förloras genom kväveläkage med kväveförluster och övergödning av vattendrag som följd. Om det är ont om syre i marken, tex om marken är blöt så nitrifieras inget eller bara lite ammonium. Samtidigt avtar nedbrytningshastigheten av det organiska materialet. Denitrifikation De tre processerna ovan tar kväve från atmosfären och för in det i ekosystemet. Denitrifikation innebär istället att nitrat reduceras och avgår i form av kvävgas och lustgas. Bakterierna som utför denna process lever djupt nere i jorden och i havs sediment där förhållandena är anaeroba. Dessa bakterier använder nitrater som ett alternativ till syre för den slutgiltiga elektron acceptorn i deras cell andning. De bildade gaserna lämnar marken och 5 haven, på så sätt blir haven av med sitt kväve överskott. Denitrifikationen utförs bl a av bakterierna pseudomonas och thiobacillus. Symbiotisk fixering av kväve Vissa bakterier, blågröna alger och svampar har förmågan att reducera kvävgas till ammoniak som därmed blir tillgängligt för överföring till organiska föreningar hos växten. De kvävefixerande bakterierna kan dels vara frilevande och dels förekomma i symbios med högre växter. Ett flertal medlemmar ur familjen Fabaceae (ärtväxter) har utbildat symbios med arter ur de olika kvävefixerande bakteriefamiljerna, som med ett gemensamt namn kallas rhizobia (Azorhizobium, Bradyrhizobium, Mesorhizobium och Rhizobium,)(Malmer, A. 2002, Raven, P. H. 2003, Stryer Xavier, P. 2000). Ett fält med Fabaceae kan binda 350 kg kväve per hektar och år, genom rhizobias verksamhet. Frilevande kvävfixerande såsom Clostridium- och Azobacterarter endast binder 2-3 kg kväve per hektar och år(Malmer, A. 2002,). De vanligaste kvävefixerande bakterierna är Rhizobium och Bradyrhizobium, vilka invaderar rötter hos klöver, alfalfa, ärter sojabönor och bönor. Bakterierna försörjer både sig själva och växten med kväve. Växten försörjer bakterien med energi, salter och kolinnehållande molekyler för produktion av kväveföreningar (Malmer, A. 2002, Raven, P. H. 2003, Stryer, L. 2002). Fysiologiska skeenden vid bakteriens inträde i växten Rhizobia kan gå in i Fabaceae via ett flertal mekanismer. Den mest kända är via rothår bakom rotspetsen. Detta sker då växten fortfarande är en fröplanta. Rhizobia fäster till rothår som utvecklar tätt krullade strukturer, vilka kommer att omge bakterien. Bakteriens invasion av rothår och underliggande cortexceller sker via infektionstrådar. Dessa utgörs av tubformade strukturer som bildas genom inväxt av rothårens cellväggar från ytan där penetreringen skedde. Bakterien framkallar celldelning i begränsade regioner av cortex som den når via tillväxt och grening av infektionstrådar. Det bildas därmed ett hölje som har sitt ursprung i värdcellens plasmamembran dit rhizobia går in från infektionstråden. (D´Haeze, W. 2003, Raven, P. H. 2003) Den intracellulära formen av bakterien benämns bakteroid (Vasse, J. 1990). Förökning genom celldelning hos de membraninneslutna bakteroiderna och cortexceller hos roten resulterar i formandet av noduler (tumörliknande utväxter). Se Figur 3. Rotnodulerna hos Fabaceae består av ett smalt cortex som omger en stor central zon innehållande både bakteroidinfekterade och icke infekterade celler (D´Haeze, W. 2003, Raven, P. H. 2003) Figur 3 - Klöver rot noduler vid en högre förstoring, observera de två delvis krossade noduler (pilarna) med rosa-färgat innehåll. Den här färgen beror på närvaron av ett pigment, leghaemoglobin - en unik 6 metabolit i den här typen av symbios. Leghaemoglobin återfinns endast i nodulerna och produceras varken av bakterien eller plantan när de växer allena. Leghaemoglobin tar upp syre och transporterar det bort ifrån nodulerna. Kvävefixering sker i en syrefattigt miljö, eftersom det kvävefixerande enzymet nitrogenas inte fungerar aerobt. Nitrogenas reducerar förutom syrgas andra trippelbundna molekyler exv. Koldioxid och syrgas. Koldioxid fungerar som en kompetitiv inhibitor och syrgas som irreversibel inhibitor som inaktiverar enzymet. Syrgaskoncentrationen i den bakterieinfekterade cellen måste därför vara hårt reglerad. Den kvävefixerande processen är dock högst energikrävande (stort ATP behov) och därmed beroende av aerob respiration. Syre behövs också för andra metaboliska aktiviteter hos både bakterier och växtceller. Fabaceae har en mycket låg koncentration av fri syrgas i rotknölarna p.g.a. att molekylerna binds till leghemoglobin. Leghemoglobin produceras delvis av bakteroiden (hemdelen) och delvis av växten (globindelen). I cytoplasman hos infekterade celler förekommer leghemoglobin i relativt höga koncentrationer. Proteinet underlättar flödet av syrgas till rhizobia. Samtidigt hålls koncentrationen av fri syrgas mycket låg genom den höga hastigheten av respiratorisk syrgaskonsumption samt flera diffusionsbarriärer som kontrollerar intåg av syrgas till den centrala infekterade regionen. (Dalton, D. A., Raven, P. H. 2003, Stryer, L. 2002). Molekylära signaler för bakteriens inträde i växten Interaktionen mellan de symbiotiska parterna involverar ett komplicerat utbyte av molekylära signaler som reglerar genuttryck. Bakteriens intåg i växten sker endast då signalerna mellan växt och bakterie stämmer överens (Perret, X. 2000). Den initiala mekanismen för bakteriens fästande till rothåren är inte utredd. Troligen rör det sig om sockerbindande proteiner s. k. lectiner som utsöndras av växtrötterna. Dessa interagerar med bakteriens cellyta där olika rhizobia familjer skiljer sig åt genom sammansättningen av sackarider. Lectinet antas underlätta rhizobias bindning till cellväggen hos rothåren (Hirsch, A. 2001, Raven, P. H. 2003). Två grupper av bakteriegener är nödvändiga för formandet av kvävefixerande noduler. Nodgengruppen är involverad i värdspecifika responsen och formandet av nodul, medan nifgengruppen är involverad i kvävefixering. (Raven, P. H. 2003). Växtens perception av nod faktorer sker troligen via receptorkomplex på plasmamembranet (Perret, X. 2000). För att nodulering skall ske måste rhizobia producera en nod faktorn som accepteras av Fabaceaevärden. (Hirsch, A. 2001) Initiering av det symbiotiska förhållandet börjar med att flavonoider utsöndras av Fabaceae. Mer än fyratusen flavonoider har identifierats i vaskulära växter. Alla flavonoider består av två benzenringar länkade genom hetrocyklisk pyran eller pyronring. Specifika substitutioner på ringen ger upphov till bl.a. isoflavonoider som endast uppträder hos Fabaceae och som gör det möjligt för rhizobia att urskilja sina specifika värdar. Dessa binder till och aktiverar den bakteriella nodgenen (nodD). Uttryck av dessa gener leder till syntes av nod faktor molekyler – lipochitooligosackarider. Nod faktorer kan bli kemiskt modifierade med bl.a. acetat, sulfat, carbamatgrp. eller olika sockrar. Graden av mättnad på acylsvansen kan också variera. Substitutionerna resulterar i en specifik nod faktor som kan kännas igen av en specifik Fabaceae. Produkten av denna nodgengruppen inducerar uttrycket av andra bakteriella nod 7 gener vars produkter krävs för processer som: rothårskrullning, cellväggsdegradering och formandet av infektionstrådar (Hirsch, A. 2001, Raven, P. H. 2003). Dessutom aktiverar andra bakteriella nodgensprodukter växtens Nod gener. Dessa kodar för växtcellproteiner s.k. noduliner som är nödvändiga för cortexcelldelning och tillväxt och funktion av nodulen (Raven, P. H. 2003, Perret, X. 2000) Kvävefixeringsprocessen Den biologiska kvävefixeringsprocessen, där kvävgas reduceras till ammoniak utförs av nitrogenas som är ett komplext enzym med flera redoxcenter. Den principiella reaktionen beskrivs nedan: N2 + 6e- +6H+ ¤2NH3 Eftersom den biologiska reaktionen genererar 1 mol H2 för varje mol NH3, går det åt åtta elektroner istället för sex. Nedan visas den fullständiga reaktionen: N2 + 8 e- + 8H+ + 16 ATP + 16H2O ¤ 2NH3 + H2 + 16 ADP + 16 Pi Nitrogenas består av två proteinkomponenter: NifKD (dinitrogenas eller MoFe protein) och NifH (dinitrogenasreduktas, reduktas eller Fe protein). Både reduktas och nitrogenas är järnsvavel proteiner, i vilka järn är bundet till svavelatomer i cysteinkedjor och till oorganiskt svavel (Stryer, L. 2002). Figur 4 - Elektroner (generade från fotosyntes eller annan oxidativ process) överförs från pyruvat till reduktas, där ATP hydrolys sker, och därifrån vidare till centret för reduktion av kvävgas till ammoniak i dinitrogenaskomponenten. 8 Figur 5 – Strukturbild av nitrogenas från Clostridium Pasteurianum Reduktas är en a2 dimer av identiska 30 kd subenheter (kodade av nifH). Varje dimer innehåller en 4Fe-4S förening. Enzymet innehåller två bindningsytor för MgATP, en på varje subenhet. Strukturen i ATP-bindningsregionen tyder på att reduktas är en medlem i P-loop NTPase familjen. Reduktas deltar i syntes av FeMo cofaktorn, samt elektronöverföring (en elektron åt gången) till dinitrogenaskomponenten för reduktion av kvävgas till ammoniak. Elektronerna generas genom fotosyntes eller annan oxidativ process. Nitrogenas försörjs med elektroner från associerade protein exempelvis flavodoxinflavodoxin och pyruvat flavodoxin reduktas. Elektronerna överförs från NAD(P)H eller pyruvat till ferredoxin (ett an FeS protein) och därifrån till reduktas. Elektronöverföringen från reduktas till dinitrogenas kopplas med bindning och hydrolys av ATP i reduktaskomponenten. Detta utlöser en konformationsförändring som flyttar reduktaskomponenten närmare dinitrogenaskomponenten. Två molekyler ATP hydrolyseras för varje elektron som överförs. Det innebär att minst 16 molekyler ATP hydrolyseras för varje N2 som reduceras, vilket gör det till en metaboliskt kostsam process. ATP hydrolys behövs inte för att göra reaktionen termodynamiskt gynnsam, men däremot för att sänka den höga aktiveringsenergin. Dinitrogenas är en a2b2 tetramer 240 kd (kodad av nifD och nifK gener). Subenheterna a och b är homologer och strukturellt lika. Varje tetramer innehåller två kopior av järn-molybden cofaktorn (FeMo cofaktor) och flera FeS grupper (P-förening). Elektroner går in i P föreningen som är belägen på gränsen mellan a och b subenheterna. Varje P förening innehåller åtta järnatmer och sju sulfidjoner. I reducerat tillstånd har varje förening formen av två 4Fe-3S kuber länkade genom en central sulfidjon. Elektronerna flödar från P-föreningen till FeMo-cofaktorn. Denna består av två M-3Fe-3S föreningar, i vilka molybden ockuperar M-ytan i en förening och järn ockuperar den i den andra. De två föreningarna kopplas genom tre sulfidjoner och är länkad till homocitrat samt proteinets alfaenhet genom en cysteinkedja och en histidinkedja. FeMo cofaktorn utgör ytan för kvävefixering. De sex centrala järnatomerna är endast länkade till tre atomer vilket lämnar en bindningsmöjlighet för N2. Formationen av flera Fe-N interaktioner försvagar bindningen hos N2 och sänker därmed aktiveringsenergin för reduktion. Sammanfattningsvis sker elektronflödet från ferredoxin till reduktas (Fe protein) till dinitrogenas (MoFe-protein) för att reducera kväve till ammoniak. ATP hydrolys inom reduktaskomponenten driver konformationsförändringen, som är nödvändig för effektiv transport av elektroner (Rangaraj, P. 1997, Raven, P. H. 2003, Stryer, L. 2002). 9 Växters aminosyrasyntes Om ammoniak och ammonium båda finns tillgängliga för växten sammtidigt, så tar växten vanligtvis upp mer ammoniak än nitrat från marken. Det kumulativa upptaget av ammoniak under mätning i tre veckor är för sojabönor ungefär två gånger större än upptaget av nitrat under samma period vid lika koncentrationer av båda ämnena. Växten kan dock ta upp mest kväve i allmänhet om det finns tillgängligt i form av både nitrat och ammonaik (JeanFransois, Morot Gaudry. 2001. kap 4). Eftersom 99% av den ammoniak som finns i marken vid fysiologiskt pH runt sju befinner sig i protonerat tillstånd som ammoniumjon NH4+, så antas det att växten tar upp denna form och inte oprotonerad NH3. Upptag av ammoniak kan surgöra marken där växten växer medans upptag av nitrat- och nitritjoner gör marken mer basisk. Upptaget av ammoniak från marken försämras ju surare jorden blir. Nitrat och nitrit kan till viss del transporteras i växten och lagras i vakuoler och andra delar av växtkroppen. Växter kan inte använda nitrat- och nitritjoner direkt till aminosyrasyntes utan måste först konvertera dessa till ammoniak med hjälp av enzymer innan det kan användas för aminosyrasyntes. Eftersom ammoniak är den form av kväve som kan användas direkt av växten till att bilda aminosyror så måste ammoniak befinna sig fritt i växten en kort tid, men det kan inte befinna sig i någon större koncentration i saven utan att växten tar skada (JeanFransois, Morot Gaudry. 2001. kap 4). Därför inkorporeras ammoniak snabbt i aminosyror när det tas upp av växten, eller skapas från nitrit. Ammoniak som bildas av cyanobakterier i växtens rötter kan användas på samma sätt, precis som ammoniak bildat av växten själv från nitrit. Bindning av ammoniak till aminosyror Man har funnit ett antal enzymer som kan binda ammoniak till _-ketosyror för att bilda aminosyror. Enzymerna sätter på aminogrupper på kolskelleten som innehåller ett dubbelbundet syre på andra position i kolkedjan, efter karboxylgruppen. Detta dubbelbundna syre oxideras till vatten när aminogruppen sätts på dess plats för att bilda en aminosyra. Kolskeletten inkluderar _-ketoglutarat och oxaloacetat vilka ingår i krebscykeln och hämtas därifrån för syntes. Vid låga koncentrationer av _-ketosyror fylls reserver på av enzymer som tillverkar dessa intermediat. Enzymerna som kan aminera _-ketosyror med ammoniak är listade i Tabell 4. Tabell 4 – Enzymer som syntetiserar aminosyror från ammoniak Enzym Reaktion Asparginsyntas (AS) Glutamatdehydrogenas (GDH) Glutaminsyntas (GS) Aspartat + NH4+ + ATP ‡ Aspargin + H2O + AMP + PPi _-ketoglutarat + NH4+ + NAD(P)H ‡ Glutamat + H2O + NAD(P) + Glutamat + NH4+ + ATP ‡ Glutamin + ADP + Pi 10 Figur 6 – bildning av glutamat via glutamatdehydrogenas Asparginsyntas kan syntetisera aspargin ifrån ammoniak, men det verkar som att aminogruppen ofta kommer ifrån en glutaminmolekyl snarare än direkt ifrån ammoniak vid bildandet av aspargin. Asparginkoncentrationen är hög i nodulerna hos baljväxter. Asparginkoncentrationen förhöjs också allmänt i de flesta växter efter torka eller annan stress. Uppskattningsvis assimileras upp till 95% av all ammoniak i växten av dessa enzymer. Syntes av glutamat och glutamin sker främst i rötterna eftersom växten inte släpper in mycket ammoniak i saven. Glutamat och glutamin transporteras sedan från rötterna upp i växten och fungerar som kvävedonatorer vid syntes av andra aminosyror samt puriner och andra kvävebärande molekyler. Alla andra aminosyror bildas från dessa två aminosyror. Även om glutamatdehydrogenas kan skapa glutamat direkt ifrån ammoniak och _-ketoglutarat, så antas att den reaktionsvägen inte är lika vanlig som vägen via glutaminsyntas och glutamatsyntas. Glutamatsyntas är inte med i tabell 1 för det kan inte skapa glutamat direkt ifrån ammoniak, utan syntetiserar istället två stycken glutamatmolekyler från en molekyl glutamin och en molekyl _-ketoglutarat, där glutamin fungerar som aminogruppsdonator. En av de nyformade molekylerna glutamat vid denna reaktion återformas därefter till glutamin av enzymet glutaminsyntas, direkt med ammoniak. Cykeln mellan ammoniak, glutamat och glutamin sker främst på detta sätt och alltså inte till lika stor del via glutamatdehydrogenas. Förklaringen är bland annat att Km för glutaminsyntas bindning till ammoniak är mindre än glutamatdehydrogenas Km (Jean-Fransois, Morot Gaudry. 2001. kap 5). Cykeln, som kallas GS/GOGAT-cykeln visas schematiskt i Figur 7. Figur 7 – GS/GOGAT-cykeln Transaminationer När det har bildats glutamat och glutamin kan dessa aminosyror användas för att syntetisera andra aminosyror. Transaminasreaktioner kallas de reaktioner varvid en aminosyra ger ifrån sig en aminogrupp till en _-ketosyra. Många aminosyror syntetiseras med hjälp av transamineringar. I de flesta fall fungerar alltså glutamat och glutamin som kvävedonatorer i vid dessa reaktioner, men även aspargin och många andra aminosyror kan ingå i transamineringar. Vissa enzym, transaminaser, tar som substrat en aminosyra och en _11 ketosyra och flyttar en aminogrupp från aminosyran till _-ketosyran. Detta sker via en enzymbunden co-faktor, pyridoxalfosfat, som liknar vitamin B6. Pyridoxalfosfatet tar upp aminogruppen ifrån aminosyran och bildar ett stabilt intermediat. Sedan lämnar Pyridoxalfosfatet över aminogruppen till _-ketosyran och övergår samtidigt till sitt ursprungliga tillstånd. (Horton, 2002). Den allmänna transamineringsreaktionen visas i Figur 8. Figur 8 – Den allmänna transaminationsreaktionen Exempel på syntes De flesta andra aminosyror syntetiseras ifrån kväve bundet till glutamat och glutamin. Vissa av dessa produktionsvägar är enkla med endast en transamination som produktionssteg. Andra är mer komplicerade som i fallen med de aromatiska aminosyrorna. Några exempel på aminosyrasyntes följer nedan. Alanin och Aspartat bildas ifrån pyruvat respektive oxaloacetat, direkt via transaminationer där glutamat avger sin aminogrupp och bildar a-ketoglutarat. Kvävet från alanin kan även flyttas direkt till oxaloacetat för att bilda aspartat vise versa. En bild som beskriver alaninsyntes visas i Figur 9. Figur 9 – syntes av alanin från pyruvat Aspargin kan, som tidigare nämnts, syntetiseras direkt ifrån ammoniak men också via en transamination varvid en glutaminmolekyl avger en aminogrupp och bildar glutamat samtidigt som det bildas aspargin. Glycin produceras från glyoxylat genom en transamination. Serin kan syntetiseras både genom sammanslagning av två glycin molekyler eller genom aminering av 3fosfoglycerat. Den senare vägen är kopplad till glykolysen där 3-fosfoglycerat är ett av 12 intermediaten. Sammanslagningen av två glycinmolekyler sker med hjälp av enzymerna glycindekarboxylas och serin hydroxymetyltransferas i växtmitokondrier. Glycin och serin är interkonvertibla, med vilket menas att produktionsreaktionen för dessa är en jämnviktsreaktion (Jean-Fransois, Morot Gaudry. 2001. kap 13). Tryptofan som är den mest komplicerade aminosyran tillverkas av chorismat som har en ringformad struktur. Reaktionsvägen går i flera steg där ringen så småningom sluts för att bilda en indol vilken sätts på aminosyran serin för att bilda tryptofan. Enzymet som tar hand om det sista steget, indolbildningen har hos vissa organismer två aktiva ytor. En av dessa aktiva ytor sköter om indolbildningen, den andra aktiva ytan sätter på indolen på serinmolekylen. Man tror att enzymet förhindrar att indolen diffunderar iväg genom att transportera den genom en tunnel i enzymet från det ställe där indolen bildas till det ställe där den sätts på serinmolekylen (Horton, 2002, kap 17). Sammanfattning Kväve ingår till stor del I många biologiska molekyler. Förutom kol, kväve och syre utgör det en stor del av biologiskt material. Det är en stabil molekyl I gasform och är I nitrat-, nitritoch ammoniumjonsform ett ämne som växter åtrår starkt. Kvävet kan fixeras av speciella bakterier som kan bilda symbios med växter som försörjer bakterierna med närning, samtidigt som bakterierna försörjer växterna med överbliven ammoniak. Kvävet används sedan av växten för syntes av många biomolekyler. Djur som äter växterna tar del av det bunda kvävet I sin tur. Cykeln sluts med nedbrytning av organsikt material I jorden av bakterier. 13 Referenser Dalton, D.A. m. fl. Antioxidant Defenses in the Peripheral Cell Layers of Legume Root Nodules. Plant Physiol. (1998) 116: 37-43 D´Haeze, W. M. fl. 2003. Reactive oxygen species and ethylene play a positive role in lateral root base nodulation of a semiaquatic legume. pp. National Academy of Sciences of the USA. 11789-11790 Hirsch, A. M. 2001. Plant Physiol. Vol. 127, pp. 1484-1492 Malmer, A. & Magnusson, T. 2002. Markprocessernas betydelse för växtproduktionen. Institutionen för skogsekologi, SLU Umeå. Perret, X. M. fl. 2000. Molecular Basis of Symbiotic Promiscuity. American Society for Microbiology. p. 180-201. Vol 64, No 1. Rangaraj, P. m. fl. 1997. ApoNifH functions in iron-molybdenum cofactor synthesis and apodintrogenase maturation. Vol. 94, pp. 11250-11255. Proc. Natl. Acad. Sci. USA Raven, P. H., Evert, E. R., Eichhorn, S. E. 2003. Biology of Plants. Sixth edition. W. H. Freeman and Company. New York. sid 26, 738-740. Stryer, L., Berg, J.M., Tymoczko, J.L. 2002. Biochemistry, fifth edition. NewYork sid. 666-668 Vasse, J. M.fl. 1990. Correlation between Ultrastructural Diffrentiation of Bacteroids and Nitrogen Fixation in Alfalfa Nodules. Journal of Bacteriology, Aug. 1990. p 4295-4306. Jean-Fransios, Morot-Gaudry, Nitrogen Assimilation by plants. 2001. Science publishers. Kap 4-5 och kap 13. Horton, Moran, m.fl. Principles of biochemistry, Third Edition. 2002. Pearson Education. Kap 17. http://www.science.siu.edu/microbiology/micr425/425Notes/12-NitrFix.html 14