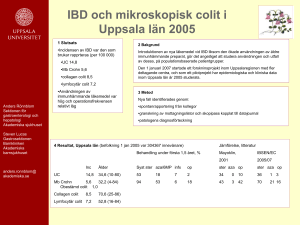
Vårdprogram för inflammatorisk tarmsjukdom hos barn och ungdomar
advertisement

1 Vårdprogram för inflammatorisk tarmsjukdom hos barn och ungdomar Detta vårdprogram med versionsbeteckning 5.0 är daterat 2015-04-10 och ersätter det tidigare vårdprogrammet med versionsbeteckning 4.1 daterat 2013-05-06. Vårdprogrammet är utarbetat på uppdrag av Svenska föreningen för pediatrisk gastroenterologi, hepatologi och nutrition – SPGHN. I gruppen som arbetat med vårdprogrammet har ingått: Robert Saalman (koordinator) Ulrika Fagerberg Petter Malmborg Tomas Wester Torbjörn Lind Gun Persson Vårdprogrammet publiceras på BLF´s hemsida med adress http://www.gastro.blf.net (under länken: VÅRDPROGRAM). Synpunkter och idéer kring vårdprogrammets innehåll kan skickas till medarbetarna i vårdprogramsgruppen (se sidan 59 för mail-adresser). Synpunkter och idéer när det gäller weblayout skickar du till webmaster Mats Eriksson, [email protected] Svenska föreningen för pediatrisk gastroenterologi, hepatologi och nutrition (2015-04-10) 2 Innehållsförteckning Inledning Definition av inflammatorisk tarmsjukdom (IBD) ............................................ 3 Epidemiologi .......................................................................................................... 4 Etiologi och patogenes ........................................................................................... 4 Diagnostik och klinisk bild .................................................................................... 5 Differentialdiagnoser ............................................................................................ 9 Kriterier för diagnos ............................................................................................. 10 Klassificering .......................................................................................................... 10 Behandlingsmål .................................................................................................... 11 Bedömning av sjukdomsaktivitet ......................................................................... 12 IBD-behandling - Översikt ................................................................................... 14 Farmakologisk behandling .................................................................................. 16 Nutritionsbehandling ............................................................................................ 29 Kirurgiska aspekter .............................................................................................. 31 Handläggning av svårt skov/fulminant kolit ...................................................... 35 Psykosocialt stöd .................................................................................................... 40 Uppföljning av barn/ungdomar med IBD ........................................................... 41 Opportunistiska infektioner och vaccinationer vid IBD ................................... 43 Malignitetsrisk vid immunmodulerande läkemedelsbehandling……………………….. 42 Extraintestinala manifestationer ........................................................................ 44 Tillväxt och IBD .................................................................................................... 46 Profylax och råd vid utlandsresa ......................................................................... 46 Organisation av IBD-vården ................................................................................ 47 IBD-register ........................................................................................................... 48 Referenser ................................................................................................................ 49 Adresslista till författarna och web-master…………………………………………………………59 Bilagor: Bilaga 1. Gastrointestinal patologi; rekommendationer från KVAST-studiegruppen Bilaga 2. Koloskopisk övervakning av patienter med långvarig ulcerös kolit Bilaga 3. Opportunistiska infektioner och vaccinationer vid IBD Bilaga 4. Nutritionsbehandling – praktiska råd Bilaga 5. Kvalitetssäkring av endoskopisk undersökning av mag-tarmkanalen hos barn och ungdomar 3 Inledning Detta vårdprogram för inflammatorisk tarmsjukdom (IBD) hos barn är en uppdatering av tidigare version och ersätter denna (versionsbeteckning 4.1, daterat 2013-05-06). Vårdprogrammet för pediatrisk IBD har utarbetats på uppdrag av Svenska föreningen för pediatrisk gastroenterologi, hepatologi och nutrition – SPGHN. Det sammanfattar vad vi i gruppen har funnit vara evidensbaserad och vedertagen handläggning av IBD. Gruppen har gemensamt diskuterat innehåll och bidragit med idéer och utformning. Vårdprogrammet skall vara ett stöd för läkare och andra medlemmar i team som diagnostiserar och behandlar barn/ungdomar med IBD, men även kunna fungera som en handledning för den som i en akut situation först tar emot en ung IBD-patient. Syftet med detta nationella vårdprogram är dessutom att stimulera utvecklingen i hela landet mot en mer enhetlig vård av hög standard. Förhoppningen är att vårdprogrammet kommer att användas i kvalitetssäkringsarbete. Programmet skall även kunna vara till hjälp för dem som organiserar och avsätter resurser till vården. Farmakologisk behandling redovisas översiktligt i tabell och text. Intentionen är att ange de olika läkemedlens plats vid behandlingen av barn och ungdomar utifrån diagnos, utbredning och inflammationsgrad. Traditioner, erfarenheter samt beslut i läkemedelskommittéer bestämmer ofta de lokala preparatvalen. Många användare kommer säkert att ha synpunkter på innehållet. Vi ser fram emot en fortlöpande dialog som successivt kan förbättra/utveckla vårdprogrammet. Dessa kan framföras via e-post, brev eller muntligen till gruppens samordnare Robert Saalman eller någon annan av gruppens medlemmar. Adresslista återfinns sist i vårdprogrammet. Definition av inflammatorisk tarmsjukdom Inflammatorisk tarmsjukdom (IBD) indelas i: Crohns sjukdom är en kronisk inflammation som kan uppträda i hela magtarmkanalen. Inflammationen är ofta segmentell och omfattar alla tarmens vägglager. Inflammationen kan ge upphov till komplicerande fistlar och stenoser. Ulcerös kolit är en kronisk inflammation som uppträder i ändtarmen och kan utbreda sig i oral riktning till att omfatta delar av eller hela tjocktarmen. Inflammationen är kontinuerlig och omfattar oftast endast slemhinnan. IBD oklassificerad (IBDU)* är en kolit där man trots utredning inte kan särskilja mellan Crohns sjukdom och ulcerös kolit. *Diagnosen obestämd kolit (indeterminant colitis) skall reserveras för de koliter där man trots histopatologisk bedömning av kolonresektat efter kolektomi inte kan särskilja mellan Crohns sjukdom och ulcerös kolit. Till innehållsförteckning! 4 Epidemiologi En global ökning i incidensen av pediatrisk IBD och då framförallt Crohns sjukdom har noterats under de senaste två decennierna. Den högsta förekomsten av IBD bland barn och ungdomar har noterats i de nordiska länderna och Kanada. I en rikstäckande svensk studie som omfattade barn under 16 år, för åren 1984-95, påvisades en lätt ökning av antalet nya fall av ulcerös kolit och en lätt övervikt för ulcerös kolit i förhållande till Crohns sjukdom. Incidensen av pediatrisk IBD (<16 år) har följts i norra Stockholm mellan 1990-2007. Under åren kring millenieskiftet noterades en kraftig ökning av antalet barn och ungdomar som insjuknade i IBD. Flertalet av dessa barn insjuknade i Crohns sjukdom med inflammation begränsad till tjocktarmsslemhinnan. Mot slutet av studietiden konstaterades att incidensökningen av pediatrisk IBD verkade vara på väg att avstanna även om incidensen av Crohns sjukdom i norra Stockholm kvarstod på en i internationell jämförelse hög nivå. I två studier från Uppsala-regionen studerades incidensen av pediatrisk IBD (<17 år) mellan 2005-2009. Man kunde i dessa studier påvisa en mycket hög incidens av både Crohns sjukdom och ulcerös kolit bland barn och ungdomar som överträffade den samtida incidensen av pediatrisk IBD i norra Stockholm (de olika åldersgränserna gör dock att de rapporterade incidenserna inte är direkt jämförbara). Notabelt är att Uppsala-studierna rapporterar en något högre incidens av ulcerös kolit än av Crohns sjukdom. Om man utgår från att dessa studier är någorlunda representativa för hela Sverige insjuknar uppskattningsvis 300 barn under 17 år i IBD i Sverige varje år (beräknat på en incidens om 12 nyinsjuknade per 100 000 barn-ungdomar och år). I en prevalens-studie som utgick från data insamlade i nationella patientregister uppskattades att ungefär 1500 barn och ungdomar var drabbade av IBD i Sverige år 2010. Etiologi och patogenes Orsaken till IBD är ofullständigt känd. Mycket talar dock för att tarminflammationen orsakas av en komplex interaktion mellan immunsystemet och tarmmikrober hos en genetiskt predisponerad individ. Tvillingstudier talar för att genetiska faktorer är betydelsefulla särskilt vid Crohns sjukdom. Ett stort antal mutationer har påvisats som ökar risken för att drabbas av Crohns sjukdom men varje enskild mutation ger bara upphov till en blygsam riskökning. Ett levnadssätt med goda hygieniska förhållanden verkar medföra en ökad risk för att insjukna i IBD. Till innehållsförteckning! 5 Diagnostik och klinisk bild Diagnostiken av IBD baseras på den samlade bilden från sjukhistoria, kliniska tecken, endoskopiska, histologiska och radiologiska fynd samt att man uteslutit ett antal differentialdiagnostiska tillstånd, huvudsakligen infektioner och födoämnesinducerad kolit/enteropati. Jämfört med IBD hos vuxna har pediatrisk IBD tydliga särdrag. Hit hör att barn med ulcerös kolit oftast har en en mer utbredd kolon-inflammation och att vid Crohns sjukdom är engagemang av tjocktarmen vanligare. Vissa studier talar även för att pediatrisk IBD representerar en aggressivare fenotyp med ökande utbredning över tid och ökad risk för kolektomi och behandlingskrävande komplikationer. Nyare studier har dock inte kunnat bekräfta denna bild utan har snarast visat att de som insjuknat under barn- och ungdomsåren har ett mindre behov av bukkirurgi under det första decenniet efter diagnos än de som insjuknat i IBD i vuxen ålder. Insjuknande i IBD i barndomen drabbar dock individen under ett viktigt skede i livet och kan därmed begränsa den fysiska, psykiska och sociala utvecklingen samt påverka både livskvalitet och livsval på så väl kort som lång sikt. Klinisk bild vid IBD De kliniska symptomen vid ulcerös kolit och Crohns sjukdom kan i mångt och mycket likna varandra. Diarré och buksmärtor är två dominerade symptom vid båda formerna av inflammatorisk tarmsjukdom. Blod i avföringen är vanligt; vid ulcerös kolit har nästan alla symptomet. Ett över månader mer smygande insjuknande i IBD är vanligast, men sjukdomen kan ibland debutera akut. Symptombilden beror på lokalisation, grad och typ av inflammation. Låggradig feber kan förekomma, ffa vid Crohns sjukdom. Viktnedgång, avplanad längdtillväxt, försenad pubertet och perianal sjukdom är alla vanligare vid Crohns sjukdom än vid ulcerös kolit. Vid Crohns sjukdom kan tillväxtpåverkan och försenad pubertet vara enda manifestation på sjukdom. Symtom och fynd som inger misstanke om IBD Vanliga symtom Crohns sjukdom Ulcerös kolit Buksmärtor Diarré Blödning Viktnedgång Trötthet Matleda Feber +++ ++ + ++ + + + subfebrilitet vanligt ++ +++ +++ + (+) (+) (+) tecken på svårt skov Fynd Anala fistlar, abscesser/sår + Tillväxtavplaning + Försenad pubertet + Leversjukdom (+) Hud* (+) Artralgi/artrit (+) Uveit (+) Munslemhinneförändringar (+) +++ = typiskt fynd ++ = vanligt + = förekommer * Erythema nodosum, pyoderma gangrenosum Till innehållsförteckning! (+) (+) + (+) (+) (+) (+) = ovanligt. 6 Anamnes När och hur debuterade symptomen? Besvär > 6 veckor stärker misstanken om IBD. Finns det IBD, annan tarmsjukdom eller autoimmun sjukdom i släkten? Utlandsresor? Kontakt med tarminfektioner? Födoämnesutlösta symptom? Läkemedel (inkl. NSAID och antibiotika)? Rökvanor? Avföringsmönster: antal per dag? Konsistens? Blod/slemtillblandning? Nattliga avföringar? Inkontinens? Plötsliga trängningar till avföring? Buksmärtor: Lokalisation? Smärttyp? Koppling till tarmtömning? Koppling till måltid? Perianala besvär: Smärta? Flytningar? Trötthet, illamående, dålig aptit/matleda samt extraintestinala manifestationer, t. ex. leverpåverkan, hudengagemang, ögonsymptom och ledbesvär kan förekomma vid debut. Hur har barnet vuxit; viktnedgång/stagnation? Längddeviation? Har puberteten kommit igång? Status Allmäntillstånd – feber? Avmagring? Pubertetstecken i förhållande till kronologisk ålder? Längd, vikt och BMI i förhållande till tillväxtkurvan och tidigare tillväxt. Pubertetsbedömning enligt Tanner. Munhåla –Svullna läppar och slemhinneförändringar i munhålan, munvinkelragader (orofacial granulomatos)? Hjärta – frekvens, blodtryck. Tachykardi kan indikera hög sjukdomsaktivitet och/eller tarmblödning. Buk – resistenser, ömhet, leverförstoring, mjältförstoring. Perianalt – hudflikar, fissurer, fistlar, abscesser, ulcerationer. Hud – blekhet, ödem, erythema nodosum, pyoderma gangrenosum, Leder – artralgier, artriter Prover vid basalutredning av IBD Blodanalyser Tolkning Fullständigt blodstatus med differentialräkning Anemi ses vid inflammation och som resultat av blödning eller järnbrist. Trombocytos kan indikera inflammation Inflammationsmarkörer. CRP är ett känsligare mått på sjukdomsaktivitet vid CD. Albumin sjunker vid inflammation Tecken till lever- eller gallvägspåverkan. CRP, SR, albumin ASAT, ALAT, ALP, GT, bilirubin, PK/INR, albumin Järnstatus Lipas eller pankreasspecifikt amylas Kreatinin Transglutaminas-antikroppar För att upptäcka pankreasretning Inför kontraströntgenundersökningar och eventuell behandling För att utesluta celiaki Avföringsprover Kalprotektin* Prover för Salmonella, Shigella, Campylobakter, Yersinia, EHEC Clostridium difficile-toxin Cystor och maskägg Känslig men ospecifik markör för tarminflammation. För att utesluta infektiösa orsaker. * Kalprotektin – Kan användas diagnostiskt för att påvisa tarminflammation. Normala nivåer gör att diagnosen IBD med stor sannolikhet kan uteslutas. < 50 mg/kg är normalvärde för barn från 4 års ålder med en gråzon mellan 50-100 mg/kg. Provet används även för monitorering av sjukdomsaktivitet vid etablerad IBD. Till innehållsförteckning! 7 Provtagning i utvalda fall ASCA/p-ANCA ingår inte i den basala utredningen, men p-ANCA kan stödja diagnosen ulcerös kolit och ASCA kan peka mot Crohns sjukdom. Antikroppsanalyserna kan därför övervägas att tas på patienter när differentialdiagnosen mellan ulcerös kolit och Crohns sjukdom är oklar. Proteinfraktioner – bör kontrolleras om leverpåverkan förekommer för att utesluta alfa1antitrysinbrist som orsak och för att se om IgG är förhöjt talande för autoimmun hepatit Antikroppar mot Yersinia – kan övervägas vid terminal ileit. Tuberkulos/HIV utreds vid särskild misstanke. CMV, rota-, herpes- och adenovirus – Indicerat vid svåra eller refraktära skov, framför allt hos immunsupprimerade patienter. Speciella differentialdiagnostiska överväganden bör göras för yngre barn med IBD-liknande symptom. Tarminflammation kan vara det första eller enda tecknet på en immunbristsjukdom. IBD-behandling kan för dessa patienter vara skadlig. Yngre barn som insjuknar i IBDliknande bild bör därför genomgå immunologisk utredning. Hos småbarn bör man också ha i åtanke att födoämnesallergi kan ge upphov till IBD-liknade enterokolit (se även avsnittet ”Differentialdiagnoser”). Endoskopi I en fullständig IBD-utredning ingår esofago-gastro-duodenoskopi och ileo-koloskopi. Minst 2 biopsier från varje tarmavsnitt tages enligt standardiserat schema, oavsett om makroskopiska förändringar föreligger eller ej. Sammantaget tas biopsier från 6-11 lokaler vid nedre skopi; minimum från ileum, caekum, ascendens, transversum, descendens, sigmoideum och rektum, men med tillägg av prov från flexurer (höger och vänster), övre och nedre colon descendens samt sigmoideum om 11 tagställen önskas. Vid svårt skov och risk för perforation begränsas undersökningen till rektosigmoideoskopi. I dessa fall bör en fullständig nedre endoskopi genomföras i ett senare skede. Undersökning med övre endoskopi motiveras av möjligheten att dels finna Crohn-förändringar, dels för differentialdiagnostik (esofagit, ulcus, celiaki). Endoskopiska undersökningar av magtarmkanalen på barn och ungdomar bör följa SPGHNs riktlinjer, se bilaga 5: ”Kvalitetssäkring av endoskopisk undersökning av mag-tarmkanalen hos barn och ungdomar” Till innehållsförteckning! 8 IBD-diagnostik av tunntarmen. Vid misstanke om Crohns sjukdom och vid oklassificerbar kolit bör en visualisering av hela tunntarmen ingå i rutinutredningen. Följande tekniker kan användas: MR-tunntarm (MRT). Hög sensitivitet för intestinala och extraintestinala Crohn-förändringar. Förberedelse med peroral vätsketillförsel, dessutom ges i.v. kontrast. Barnet bör kunna medverka då undersökning i narkos är komplicerad. Undersökningen medger möjlighet att påvisa stenoser/strikturer och fistlar men medger också en bedömning av inflammationsutbredningen genom visualisering av tarmväggens tjocklek och blodgenomflöde och motorik. Då MRT inte kräver invasiva förberedelser och då den inte medför någon strålning får den anses vara förstahandsalternativ vid tunntarmsdiagnostik hos barn. Tunntarmspassage. Jämfört med MRT ger kontraströntgen av tunntarmen mindre information. Vid användande av dubbelkontrastteknik (Sellinkpassage) medges dock oftast god visualisering av inflammationsutbredning och komplikationer. Undersökningsmetoden kräver dock nasoduodenal intubation för kontrasttillförsel och upplevs därför inte sällan som besvärlig av barn och ungdomar. Kapselendoskopi. Hög sensitivitet för slemhinneförändringar i tunntarm. Metoden kan övervägas vid misstanke om tunntarmsinflammation trots avsaknad av diagnostiska fynd vid endoskopisk och radiologisk tunntarmsdiagnostik. En komplikation är kapselretention och striktur utgör en relativ kontraindikation. Undersökning med upplösbar testkapsel eller tunntarmspassage (röntgen eller MRT) rekommenderas därför före kapselendoskopin. Vid svårighet att svälja kapseln kan denna föras ner med hjälp av gastroskop. Andra radiologiska och endoskopiska metoder som används vid IBD-diagnostik; Kolonröntgen. Används numera sällan i primärutredningen, dock indicerad om endoskopi visat sig svår att utföra, t.ex. vid strikturer/stenoser. Ultraljud. Kan ge information om tarmväggens tjocklek i både tunntarmen och kolon, vägghyperemi (via doppler) samt påvisa abscess och/eller förekomst av fri vätska i buken. Ultraljud kan även utföras transanalt för diagnostik av fistlar. Tarmgas och obesitas kan vara störande för undersökningen. Fördel, medför ingen strålbelastning. Nackdelar, beroende av undersökarens erfarenhet och svårigheter att eftergranska. Buköversikt. Indicerat vid akut skov av IBD med frågeställning kolondilatation, perforation och/eller förekomst av intramural gas. CT-buk. Bör i första hand användas för kompletterande kartläggning vid akut skov och misstanke om operationskrävande intra-abdominella komplikationer. Om kontrast ges i tarm och blod ger metoden likartad information som vid MRT, men de höga stråldoserna gör att denna metod ej kan rekommenderas till barn eller ungdomar. MR-buk/MR--bäcken. Kan användas för kartläggning av anatomiska förhållanden i lilla bäckenet vid fistel/abscess-bildningar. Dubbelballong-enteroskopi. Undersökning som möjliggör utvidgad skopi av övre magtarmkanalen (2 meter långt instrument). Tekniken är för närvarande tillgänglig på ett fåtal sjukhus i landet. Kan användas på barn från cirka 10 år. Till innehållsförteckning! 9 Differentialdiagnoser Infektiösa koliter/enterokoliter Bakterier - Clostridium difficile, Shigella, Salmonella, E.coli / EHEC, Yersinia, Campylobacter, mycobacterium tuberculosis Virus - Rota-, adeno-, herpes- , cytomegalovirus (CMV) och HIV. CMV-kolit förekommer företrädesvis vid immundefekt eller immunsuprimerande behandling Parasiter - Giardia lamblia-infestation, amöba-koliter, cryptosporidium, Icke-infektiösa koliter/enterokoliter Mikroskopiska koliter (kollagen kolit och lymfocytär kolit). Vid skopi ser slemhinnan makroskopiskt normal eller nästan normal ut. Diagnosen ställs på mikroskopin. Ovanligt hos barn Allergiska koliter/ enterokoliter Immunbristtillstånd – ska särskilt övervägas på små barn < 2 års ålder Kronisk granulomatös sjukdom Vaskulitsjukdomar - Behcets sjukdom, Henoch-Schönleins purpura med tarmengagemang Funktionella mag-tarmproblem Återkommande buksmärtor hos barn Irritable bowel syndrome (IBS). Kan förekomma parallellt med IBD. Exempel på andra sjukdomar, symtom eller fynd som kan bereda differentialdiagnostiska svårigheter och ibland förekomma parallellt med IBD Celiaki Refluxesofagit, eosinofil esofagit, Helicobacter pylori-gastrit/magsår/duodenalsår Polyper i mag-tarmkanalen (juvenila polyper, juvenilt polypos syndrom, familjär adenomatös polypos) Rektal invagination, solitary ulcer syndrome Biverkan av läkemedel, t.ex. NSAID som kan utlösa inflammation i magsäck, tunntarm och kolon. Till innehållsförteckning! 10 Kriterier för diagnos Det finns inte någon internationellt accepterad ”guldstandard” som exakt definierar vilka kriterier som ska vara uppfyllda för att ställa diagnoserna Crohns sjukdom eller ulcerös kolit. En patient får därför anses ha Crohns sjukdom eller ulcerös kolit om hon har en klinisk bild förenlig med sjukdomen och att utredning, enligt Porto-kriterierna 2013, omfattande endoskopi, histologi, radiologi och biokemi påvisar för sjukdomen typiska avvikelser, med förbehållet att möjliga differentialdiagnoser skall ha uteslutits. Klassificering Paris-klassifikationen, som presenterades 2010, är den första pediatriska klassificeringen av IBD. Paris-klassifikationen är en något modifierad variant av Montreal-klassifikationen från 2006, vilken används inom vuxengastroenterologin. Enligt Paris-klassifikationen föreslås att pediatrisk IBD indelas i undergrupper baserat på ålder vid insjuknande och förekomst av tillväxthämning. Patienter som drabbats av ulcerös kolit kan även delas in i olika fenotyper beroende på slemhinneinflammationens utbredning och förekomst av allvarlig sjukdomsaktivitet. Patienter som drabbats av Crohns sjukdom delas in i fenotyper beroende på inflammationensbelägenhet och utbredning samt om tarminflammationen ger upphov till komplikationer. Inflammationens utbredning respektive belägenhet bestäms enligt Paris-klassifikationen av den endoskopiska bilden med inflammation i form av ulcerationer i slemhinnan (icke-erosiva förändringar som rodnad eller knottrig slemhinna räknas inte), eller radiologiskt påvisad väggförtjockning. Klassifikationen baseras således inte på mikroskopiska fynd. Till innehållsförteckning! Svenska föreningen för pediatrisk gastroenterologi, hepatologi och nutrition (2015-04-10) 11 Paris-klassifikationen Debutålder (Age) A1a <10 år A1b 10- <17 år A2 17-40 år A3 >40 år Tillväxthämning (Growth retardation) G0- Ingen tillväxthämning G1- Tillväxthämning, definierad som längd <-2SD (vissa förtydligande tillägg finns avseende tillväxthastighet och relation till Target Height). Utbredning och sjukdomsbeteende Ulcerös kolit (UC) Utbredning av slemhinneinflammation (Extension) E1 Ulcerös proktit (distalt om sigmoideum) E2 Vänstersidig UC (distalt om vänster kolonflexur) E3 Extensiv UC (höger kolonflexur och distalt därom) E4 Pankolit (proximalt om höger kolonflexur) Förekomst av allvarlig sjukdomsaktivitet S0 Ingen episod med allvarlig sjukdomsaktivitet S1 Minst en episod med allvarlig sjukdomsaktivitet (PUCAI ≥65) Crohns sjukdom Belägenhet av tarminflammation (Location) L1 Distala 1/3 av tunntarmen ±begränsad inflammation i caekum L2 Kolon L3 Ileum och kolon Som tillägg (+/-) L4a Ovan Treitz ligament L4b Ovan distala 1/3 av tunntarmen men nedom Treitz ligament Sjukdomsbeteende (Behaviour) B1 Icke-strikturerande, icke-penetrerande sjukdom B2 Strikturerande sjukdom B3 Penetrerande sjukdom B2B3 Både strikturerande och penetrerande, antingen vid samma eller olika tillfällen Som tillägg (+/-): P Perianal sjukdom Behandlingsmål Målsättningen med behandlingen är att sträva efter: Att uppnå och bibehålla klinisk, endoskopisk och histologisk remission Normal tillväxt och pubertet God livskvalitet Till innehållsförteckning! 12 Bedömning av sjukdomsaktivitet Sjukdomsaktiviteten styr terapival och övrig handläggning av patienten. Som hjälp för bedömning av sjukdomsaktivitet har olika index tagits fram. En gemensam svaghet med dessa index är att de försöker sammanväga olika parametrar varav flera dock är subjektiva och andra inte behöver vara orsakade av aktiv tarminflammation. Sjukdomsaktiviteten vid ulcerös kolit låter sig tämligen väl beskrivas med symptombaserade index. Vid akuta kolitskov har sjukdomsaktivitetsmätning enligt PUCAI (se nedan) visats vara bättre på att förutsäga behovet av akut kolektomi än endoskopisk gradering av inflammationen i slemhinnan. Vid ulcerös kolit föreligger även ett starkt samband mellan skattningen av sjukdomsaktiviteten med PUCAI och fekala aktivitetsmarkörer som kalprotectin. Associationen mellan PUCAI-skattad låg sjukdomsaktivitet (klinisk remission) och påvisad endoskopisk remission är också stark. Vid Crohns sjukdom (som till skillnad från ulcerös kolit inte i lika hög grad ger upphov till blodiga avföringar) är sambandet mellan symptombaserad mätning av sjukdomsaktiviteten och endoskopiskt påvisad inflammationsaktivitet och utbredning betydligt lägre. Aktivitetsindex för Crohns sjukdom omfattar oftast även ett par biokemiska markörer (t.ex. CRP, SR, ) och kroppsundersökningsfynd (t.ex. bukresistens och perianala fynd) vilket gör dem mer omständliga att använda som vägledning i det kliniska vardagsarbetet. Vid Crohns sjukdom har aktivitetsindex därför främst kommit att användas som utfallsmått i behandlingsstudier. Följande sjukdomsaktivitetsindex rekommenderas för närvarande inom pediatriken: Physicians global assessment (PGA) PGA används som guldstandard vid framtagande av olika sjukdomsaktivitetsmått vid både ulcerös kolit och Crohns sjukdom. Indexet baseras på läkarens bedömning av patientens sjukdomsaktivitet (normal, mild, måttlig, svår) genom anamnes, kroppsundersökning och i förekommande fall även biokemi och skopiresultat. PGA används som mått på sjukdomsaktivitet i de stora pediatriska IBD-registren i Nordamerika. Till innehållsförteckning! 13 Pediatric ulcerative colitis index (PUCAI) PUCAI är ett framtaget pediatriskt aktivitetsindex som rekommenderas, enligt senaste konsensus från ECCO/ESPGHAN, som stöd vid handläggning av svårt kolitskov. Skattningen av PUCAI beräknas på de två senaste dygnens sjukdomsaktivitet förutom vid snabba förändringar, som vid akut svår kolit, då daglig beräkning kan behövas. Begreppsdefinition med ledning av PUCAI Remission Milt skov av UC Måttligt skov av UC Svårt skov av UC < 10 10-34 35-64 ≥ 65-85 Respons på terapi: Minskning med 20 poäng Beräkning av PUCAI-index Buksmärta (0-10 poäng) 0 Ingen 5 Smärta som kan ignoreras 10 Smärta som inte kan ignoreras Blodiga avföringar (0-30 poäng) 0 Inget blod 10 Lite blod i mindre än hälften av avföringarna 20 Lite blod i mer än hälften av avföringarna 30 Mycket blod (> 50% av avföring) Avföringskonsistens (0-10 poäng) 0 Formad avföring 5 Delvis formad avföring 10 Lös avföring Antal avföringar per dygn (0-15 poäng) 0 0-2 avföringar 5 3-5 avföringar 10 6-8 avföringar 15 >8 avföringar Nattliga tarmtömningar (0-10 poäng) 0 Nej 10 Ja Aktivitetsnivå (0-10 poäng) 0 Ingen begränsning av aktivitet 5 Någon gång begränsad aktivitet 10 Allvarligt begränsad aktivitet Svenska föreningen för pediatrisk gastroenterologi, hepatologi och nutrition (2015-04-10) 14 Pediatric Crohn's Disease Activity Index (PCDAI) PCDAI är det vanligaste aktivitetsindexet som används vid pediatrisk Crohn-sjukdom. Detta index innebär en viktad poängsättning av patientens subjektiva besvär under sista veckan (buksmärtor, antalet avföringar/dygn, aktivitetsnivå), lab-värden (hematokrit, SR, albumin), vikt- och längdavvikelse, status (buk, analregion) samt extraintestinala manifestationer. Kommentarer kring några ytterligare sjukdomsaktivitetsindex som primärt utarbetats för IBD hos vuxna: Truelove-Witts-index För bedömning av svårighetsgrad av ulcerös kolit. Används ofta inom vuxengastroenterologin (se SGFs riktlinjer–www.svenskgastroenterologi.se) för handläggning av svårt akut kolitskov. Harvey-Bradshaws aktivitetsindex Förkortad variant av Crohn's Disease Activity Index (CDAI) som utarbetats för vuxna med Crohns sjukdom. Rekommenderas av Svensk Gastroenterologisk Förening (SGF) för gradering av sjukdomsaktivitet i det kliniska vardagsarbetet och används i det nya nationella kvalitetsregistret för patienter med IBD (SWIBREG – IBD-care, se även avsnitt ”IBDregister”). Indexet omfattar uppgifter från föregående dygn om antal avföringar, välbefinnande, förekomst av buksmärtor, extraintestinala manifestationer och bukresistens. Som exempel på frågeformulär som skattar hälsorelaterad livskvalitet vid IBD kan nämnas: Short Short Health Scale (SHS) Ett svenskt frågeformulär som evaluerats på vuxna IBD-patienter. Detta används i SWIBREG. IMPACT-II QOL Ett index som skattar livskvalitet vid pediatrisk IBD. Indexet är framtaget i Nordamerika och planeras inom en snar framtid vara översatt till svenska. Det har hittills främst använts för att utvärdera självupplevd hälsa vid forskning kring ungdomar med IBD. IBD-behandling – översikt Behandlingen av barn och ungdomar med IBD behöver individualiseras beroende på ett antal sjukdomsfaktorer såsom lokalisation/utbredning, inflammationsgrad, symtombild, nutritionstillstånd, medicinbiverkningar samt åldersberoende faktorer, t.ex. förmåga att ta tabletter. IBD-behandling kan indelas enligt följande: Farmakologisk behandling Nutritionell behandling Kirurgisk behandling Psykosocialt stöd Till innehållsförteckning! 15 Behandlingstrappa enligt ”step-up-modell” Steg 1: - 5-ASA-preparat - Steroider - Total enteral nutrition - vid Crohns sjukdom - Nutritionsstöd - Antibiotika (metronidazol/ciprofloxacin) vid perianal Crohns sjukdom Steg 2: - Tiopuriner (azatioprin och 6-merkaptopurin) - Metotrexat Steg 3: - TNF-blockerare Kirurgisk behandling kan övervägas vid samtliga behandlingssteg på särskild indikation. Till innehållsförteckning! 16 Farmakologisk behandling Farmakologisk behandling skall samordnas med nutritionell, psykosocial samt ev. kirurgisk behandling. Följande läkemedel rekommenderas för behandling av aktiv sjukdom och/eller underhållsbehandling, d.v.s. terapi som syftar till att bibehålla patienten i remission. Ofta kombineras olika läkemedel. Farmakologisk behandling vid ulcerös kolit Substans Systemisk behandling av kolit Behandling av aktiv sjukdom Underhållsbehandling Salazopyrin Asacol Dipentum Salofalk Pentasa Colazid 50-70 mg/kg/d, max 3-4 g/d* prednisolon Prednisolon 0,5-2 mg/kg/d, max 40 mg/d (ev. 60 mg i svåra fall) azatioprin Azatioprin Imurel Remicade Humira 2,0 – 2,5 mg/kg/d 2,0 – 2,5 mg/kg/d Se FASS** Se FASS** sulfasalazin 5-ASA TNFblockerare Lokal behandling av distal kolit Läkemedels namn 5-ASA rektalt steroider rektalt*** Asacol Mesasal Pentasa Salofalk Budenofalk Entocort Colifoam Prednisolon 60-80 mg/kg/d, max 4,8 g/d* 40-50 mg/kg/d, max 3 g/d* 50-70 mg/kg/d, max 3 g* Dosen bör ej vara under 40 mg/kg eller 2,4 g/d 20-50 mg/kg/d upp till 1 g/d 20-50 mg/kg/d, max 1g/d Den kombinerade orala och rektala dosen bör ej bli >50% över den orala standarddosen. Max-dos sammanlagt 6,4 g/d för vuxna. Doser finns i FASS bara angivna för vuxna, d.v.s. dosen kan ev. behöva justeras beroende på kroppsvikt. * Högre dos än som rekommenderas i FASS (Turner et al.) ** Remicade har rekommendation i FASS från 6 år för Crohns sjukdom och ulcerös kolit. Humira har rekommendation i FASS från 6 år för Crohns sjukdom. . Till innehållsförteckning! 17 Farmakologisk behandling av Crohns sjukdom i tunntarm och tjocktarm Utbredning Substans Läkemedelsnamn Aktiv sjukdom Underhållsbehandling Jejunum/ Proximala ileum 5-ASA Pentasa 50-70 mg/kg/d max 3g/d prednisolon Prednisolon 60-80 mg/kg/d* max 4,8g/d 1-2 mg/kg/d, max 60 mg/d azatioprin Azatioprin Imurel 2,0 – 2,5 mg/kg/d 2,0 – 2,5 mg/kg/d metotrexat Metoject Methotrexate 15-17 mg/m2/vecka sc, max 25 mg/vecka 10 mg/m2 /vecka sc el po, max 15 mg/vecka Se FASS** Se FASS** TNF-blockerare Remicade Humira Distala ileum/ kolon 5-ASA sulfasalazin Pentasa Asacol Salofalk Dipentum Colazid Salazopyrin 60-80 mg/kg/d max 4,8 g/d* 50-70 mg/kg/d, max 3 g/d* 50-70 mg/kg/d, max 3-4 g/d* 50 mg/kg/d, max 3 g/d* Prednisolon 1-2 mg/kg/d, max 40 mg/d (ev. 60 mg i svåra fall) Budenofalk Entocort 3-9 mg/d*** azatioprin Azatioprin Imurel 2,0 – 2,5 mg/kg/d 2,0 – 2,5 mg/kg/d metotrexat Metoject Methotrexate 15-17 mg/m2/vecka sc, max 25 mg/vecka 10 mg/m2 /vecka sc. el po, max 15 mg/vecka Se FASS** Se FASS** prednisolon budesonid TNF-blockerare Remicade Humira 0-lägsta möjliga dos * Högre dos än som rekommenderas i FASS. ** Remicade har rekommendation i FASS från 6 år för Crohns sjukdom och ulcerös kolit. Humira har rekommendation i FASS från 6 år för Crohns sjukdom. *** Doser finns bara angivna för vuxna i FASS och kan behöva justeras beroende på kroppsvikt. Till innehållsförteckning! 18 Farmakologisk behandling av Crohns sjukdom med perianal utbredning (fistel/abscess) Substans Fistel/abscess * Läkemedelsnamn Elyzol Flagyl Behandling vid aktiv Underhållssjukdom behandling 15-20 mg/kg/d 10 mg/kg/d (max. 800 mg/d) ciprofloxacin Ciproxin 20 mg/kg/d 10-20 mg/kg/d azatioprin Azatioprin Imurel 2,0 – 2,5 mg/kg/d 2,0 – 2,5 mg/kg/d metotrexat Metoject Methotrexate 15-17 mg/m2/vecka sc 10 mg/m2 /vecka sc. eller Max 25 mg/vecka po, max 15 mg/vecka TNF-blockerare Remicade Humira Se FASS** metronidazol Se FASS** * Vid isolerad perianal Crohn-sjukdom har såväl steroidterapi som total enteral nutritionsbehandling begränsad effekt. ** Remicade har rekommendation i FASS från 6 år för Crohns sjukdom och svår ulcerös kolit. Humira har rekommendation i FASS från 6 år för Crohns sjukdom. 5-ASA-preparat - De flesta patienter med ulcerös kolit behandlas med något 5-ASA-preparat. Vilket av preparaten som väljs är beroende på i första hand inflammationens lokalisation. Vid proktit/distal kolit kan rektala 5-ASA-beredningar ges i stället för eller adderas till perorala preparat. - 5-ASA har en skyddande effekt mot dysplasi. Detta kan vara särskilt viktigt för vissa riskgrupper som patienter med aktivt sjukdomsförlopp, skleroserande kolangit och/eller hereditet för cancer i mag-tarmkanalen. Patienter med total ulcerös kolit får i regel livslång 5-ASA-behandling om diagnosen är säkerställd. Remissionsbevarande effekt av 5-ASA är visad vid ulcerös kolit, men inte vid Crohns sjukdom. - För att minimera risken för biverkningar (t.ex. huvudvärk, buksmärtor, uppkördhet diarré) vid introduktion med perorala 5-ASA-preparat bör dessa sättas in stegvis; förslagsvis med en höjning av dosen 10-15 mg/kg/dygn var 4:e-7:e dygn. Perorala 5-ASA-preparat Sulfasalazin (Sulfasalazin = sulfapyridin + 5-ASA) Salazopyrin tablett, enterotablett. - Sulfalazin konkurrerar i tarmen vid absorption med folsyra, varför supplement ges med T. Folacin. - Undvik att ge preparatet till pojkar i övre tonåren för att undvika oligospermi (reversibelt). - Av alla 5-ASA-preparat har Salazopyrin flest dokumenterade biverkningar, fr.a. hudallergi och neutropeni. Medicinen bör sättas in stegvis liksom andra 5ASA. Dessa biverkningar är till övervägande del kopplade till sulfadelen, varför något annat 5-ASA-preparat kan prövas vid biverkningar. - Används särskilt vid IBD-associerad artropati. Till innehållsförteckning! 19 Mesalazin (mesalazin = 5-ASA) Asacol enterotabletter (röd-bruna ”skal” kommer ofta ut med avföringen) Pentasa depåtablett, depågranulat (d.v.s. sachet att använda vid sväljningsproblem) Salofalk enterodepågranulat. Olzalazin Dipentum kapsel, tablett (Intas med måltid för att minska risken för diarré) Balsalazid (balsalazid = mesalazin (5-ASA) + 4-aminobenoyl-beta-alanin) Colazid kapsel (Rekommenderas ej till barn <12 år) Rektala 5-ASA-beredningar Mesalazin Asacol suppositorier, rektalsuspension. Mesasal suppositorier, rektalskum. Pentasa rektalsuspension, suppositorium. Salofalk rektalskum. Sulfasalazin Salazopyrin suppositorier. Steroid-preparat - Perorala steroider kombineras ofta med 5-ASA-preparat eller immunsuppressiv terapi vid behandling av aktiv sjukdom för att inducera remission. Dosering får individualiseras beroende på inflammationsgrad, utbredning och biverkningsprofil hos den enskilde patienten. - Steroider skall inte användas som underhållsbehandling. Om steroidbehandling ändå är nödvändig för att bibehålla remission ges så låg dos som möjligt övergående, helst varannan dag och i kombination med steroidsparande immunmodulerande medicinering (i första hand azatioprin). Målet skall vara att få patienten steroidfri. - Lokala steroider (klysma/skum) kan ges vid distal kolit, som alternativ eller komplement till perorala steroider och vid total kolit som ett komplement till systemisk steroidbehandling. - Lokala steroider resorberas till viss del och kan därmed ha systemeffekt. Om lokala steroider ges under lång tid bör man därför även med dessa eftersträva varannandagsbehandling och överväga andra terapialternativ, t.ex. rektala 5-ASA-preparat. - Långvarig behandling eller upprepade behandlingskurer medför risk för rubbning av längdtillväxten och låg bentäthet. Till innehållsförteckning! 20 Perorala och intravenösa steroid-preparat Prednisolon Prednisolon , tablett 2,5 mg, 5 mg och 10 mg Precortalon aquosum, injektionslösning Dosering: 0,5-2 mg/kg/dygn (max. 40-60 mg/dygn), administreras i engångsdos på morgonen, vid högdos ev. 2 gånger/dygn. Vid måttligt skov räcker det ofta med 0,5-1 mg/kg/dygn. Initialdos bibehålls till klar förbättring, dock högst 6 veckor. Nedtrappning sker beroende på svar under 2-3 månaders total behandlingstid. Följande schema kan användas: vid högdos sänks dosen initialt med 10 mg/dag och vecka.Vid en dygnsdos på ≤ 20 mg/dygn kan minskning ske med 5 mg/dag och vecka. Vid dygnsdos prednisolon på ≤ 10 mg/dygn kan man sänka med 2,5 mg/dag och vecka. Vid behov av utsträckt behandling rekommenderas varannandagsdoser för att minimera biverkningarna. Kontroller: Under behandlingen rekommenderas fortlöpande kontakt för utvärdering av behandlingseffekt, justering av nedtrappningsschema samt kontroll av biverkningar. Hydrocortison Solucortef , injektionsvätska Budesonid Budenofalk , depotkapslar Entocort, depotkapslar Frisättningsprofil: Depotkapslar som löser ut den aktiva substansen i ileum och kolon ascendens. Biverkningar: Se ovan under prednisolon. Data från en europeisk multicenterstudie på barn/ungdomar har visat en effekt motsvarande den i vuxenstudier d.v.s. effekt jämförbar med prednisolon, men med färre biverkningar och mindre påverkan på hypofys-binjure-axeln. Rektala steroidberedningar Resorption: hydrokortison och prednisolon resorberas av kolonslemhinnan vilket ger systemeffekt och ökar risken för systembiverkningar. Budesonid resorberas betydligt mindre och ger mindre systempåverkan. Budesonid Budenofalk, rektalskum Entocort, rektalsuspension. Hydrocortison Colifoam, rektalskum. Prednisolon Prednisolon, klysma Till innehållsförteckning! 21 Antibiotika Metronidazol Flagyl, tabletter, oral suspension, infusionslösning. Metronidazol, tabletter, infusionslösning. Dosering: vid aktiv sjukdom 15-20 mg/kg/dygn, underhållsbehandling 10 mg/kg/dygn Indikation: Perianal Crohn-sjukdom. Används även vid Crohn-kolit som adjuvansbehandling. Biverkningar: Illamående (vanligaste biverkan – pröva lägre dos), leukopeni och stegring av leverenzymer. Vid långtidsbehandling bör risken för perifer neuropati beaktas. Långtidsbehandling med reducerad dos minskar denna risk. Rekommenderad maximal behandlingstid anges i FASS till 4-6 månader vid aktiv Crohns sjukdom, men enskilda patienter har behandlats under längre tid. Om perifer neuropati misstänks skall preparatet utsättas. Ev. kan undersökning av perifer nervledningshastighet utföras. Vuxna patienter som står på långtidsbehandling ges i regel en dygnsdos som inte överstiger 800 mg. Ciprofloxacin Ciproxin, granulat, oral suspension Ciprofloxacin, tablett, oral suspension, injektionsvätska. Dosering: 10-20 mg/kg/dygn. Indikation: Perianal Crohn-sjukdom. I Sverige har ciprofloxacin främst använts vid perianala abscesser vid Crohns sjukdom men även vid aktiv Crohn-kolit och ulcerös kolit i kombination med steroider och 5-ASA. Behandling har givits till vuxna i upp till sex månader. Rekommenderas även till patienter med IBD för behandling av och profylax mot allvarlig turistdiarré då bakteriell orsak kan misstänkas. På indikationen IBD finns inga studier på barn. Biverkningar: I FASS varnas för att ge ciprofloxacin till växande barn annat än på indikationen exacerbation av cystisk fibros; risken för muskuloskeletala biverkningar är ännu ej fullständigt klarlagd. Till innehållsförteckning! 22 Tiopuriner (TP) Azatioprin och merkaptopurin Indikation: Tiopuriner (TP) utövar genom hämning av purinsyntesen, som påverkar Tlymfocyternas funktion, en mild till måttlig immunosupressiv effekt. Den kliniska effekten av TP uppträder inte förrän efter 2- 3 månaders behandling och full effekt uppnås ibland först efter 4-6 månaders medicinering. Av tradition används i Sverige främst azatioprin (AZA) medan det i andra länder finns större erfarenhet av behandling med merkaptopurin (6-MP) vid behandling av IBD. TP kan övervägas redan vid ett svårt initialt skov, men används ofta först vid tidiga (inom 3 mån) eller upprepade skov (>2 skov per år), samt om sjukdomen inte går i remission eller visar sig vara steroidberoende (> 3 månaders kontinuerligt behov av steroider). Biverkningar (se även FASS): För information om risken för infektioner vid behandling med TP hänvisas till avsnittet i vårdprogrammet: ”Opportunistiska infektioner och vaccinationer vid IBD”. För information om sambandet mellan TP och risk för utveckling av tumörsjukdomar hänvisas till avsnittet i vårdprogrammet ”Malignitetsrisk vid immunmodulerande läkemedelsbehandling”. Behandling med tiopuriner kan utlösa en bukspottkörtelinflammation. Pankreatiten uppträder oftast redan efter några veckors behandling men kan även tillstöta efter mångårig behandling. Denna biverkan är inte dosberoende varför tiopurinbehandlingen då måste sättas ut omgående. Vid symptomgivande pankreatit utlöst av tiopurin är det sällan försvarbart att pröva med annat preparat inom läkemedelsgruppen. Studier indikerar dock att hälften av de patienter som reagerat med AZA-utlöst amylas-stegring utan symptom tolererar behandling med 6-MP. Benmärgspåverkan är vanlig och avspeglar i viss mån den eftersträvansvärda effekten av läkemedlet. Vanligen ses sjunkande antal leukocyter (både lymfocyter och neutrofila) och ibland även låga trombocyttal. Patienter som uppvisar en låg aktivitet av tiopurinmetyltransferas (TPMT) löper en ökad för att drabbas av benmärgsdepression (se nedan). Benmärgsdepressionen är reversibel och dosberoende. Om LPK sjunker under 3,0 eller antalet neutrofila granulocyter understiger 1,0 bör tiopuriner utsättas men läkemedlet kan oftast återinsättas i lägre dos då blodbilden normaliserats. Leverpåverkan kan förekomma vid tiopurin-medicinering och är oftast dosberoende. Bestämning av TPMT inför start av behandling: Tiopurinmetyltransferas (TPMT) är ett viktigt enzym i metabolismen av tiopuriner. Låg aktivitet av TPMT ökar risken för att medicinering med tiopuriner skall orsaka benmärgshämning. Bestämning av TPMTaktiviteten skall därför göras innan behandling med tiopuriner inleds. Enzymaktiviteten (fenotypen) i blod förklaras huvudsakligen av uppsättningen inom TPMT-genen (genotypen). Ungefär 90 % av befolkningen har homozygot uppsättning av den normala TPMT-genen medan cirka 10 % är heterozygoter och en på 300 helt saknar den normala TPMT-genen. Patienter med heterozygot genuppsättning bildar TPMT med lägre enzymatisk aktivitet och bör därför ges ungefär hälften så stor dos av tiopuriner som de med normal genotyp. De som saknar den normala TPMT-genen har oftast mycket låg TPMT-aktivitet och skall därför som regel ej behandlas med tiopuriner. Värdering av TPMT-aktiviteten, görs tillförlitligast med analys av både genotyp och fenotyp. 23 Koncentrationsbestämning av tiopurinmetaboliter: Koncentrationen av tioguanidnukleotid (6TGN) anses avspegla läkemedelsgruppens antiinflammatoriska effekt. Om patienten inte är i remission och låg* koncentration uppmäts av 6-TGN bör tiopurin-dosen ökas (betänk dock först att låg koncentration av 6-TGN kan bero på bristande följsamhet till läkemedelsordinationen). Vid hög* koncentration av 6-TGN bör tiopurin-dosen sänkas även om biverkningar ej uppträtt. Höga* nivåer av metaboliten 6-metylmerkaptopurin (6-MMP) har associerats med ökad risk för biverkningar. Ett fåtal patienter uppvisar så kallad ”skev metabolism” varmed menas att tiopurin-behandling, i normala doser hos patienter med normal TPMT-aktivitet, ger upphov till höga nivåer av 6-MMP samtidigt som 6-TGN koncentrationen inte når upp till det terapeutiska intervallet. I denna patientgrupp har kombinationbehandling med allopurinol (100 mg - vars insättande föregåtts av minskning med 2/3 av tiopurindosen minst två veckor innan allopurinol-behandlingen inleds) prövats med viss framgång. Kombinationsbehandlingen har främst prövats inom vuxengastroenterologin, och den pediatriska erfarenheten av denna behandling är hittills begränsad. * Normalvärden för terapeutiskt intervall och toxiska nivåer av tiopurinmetaboliterna varierar något mellan olika laboratorier varför några riktvärden inte anges i vårdprogrammet. Azatioprin (AZA) Azathioprin , tablett 25 mg och 50 mg Imurel, tablett 25 mg och 50 mg Dosering: Vid normal TPMT-aktivitet kan behandlingen inledas i dos om 2 mg/kg/dygn. Vid låg-måttlig TPMT-aktivitet eller heterozygot genuppsättning bör behandlingen inledas i dos om 1 mg/kg/dygn. AZA-dosen kan fördelas på ett eller två dostillfällen per dygn. Undvik att dela tabletterna. Hos vissa patienter uppnås effekt av läkemedlet först då dosen ökats till 2,5 mg/kg/dygn. Dosen kan i enstaka fall ökas till 3 mg/kg med vägledning av metabolitkoncentrationsbestämning. Mercaptopurin (6-MP) Puri-Nethol, tablett 50 mg. Indikation: 6-MP kan prövas vid biverkan av AZA (se ovan). Dosering: 1-1,5 mg/kg/dag vid normal TPMT-aktivitet. Lab-kontroller: Vid tiopurin-medicinering bör blod-, lever- och bukspottkörtelstatus i blod kontrolleras 1 gång/vecka under de första 1-2 månaderna. Därefter bör blodprov tas med 1-3 månaders intervall. Till innehållsförteckning! 24 Metotrexat Indikation för metotrexat (MTX): - vid Crohns sjukdom när tiopuriner (AZA eller 6-MP) ej tolereras eller vid terapisvikt med tiopuriner vid Crohns sjukdom med extraintestinala manifestationer; speciellt artriter Rekommendationerna bygger på vuxenstudier samt ett fåtal publicerade barnstudier. Man har i dessa genomgående gett parenteral behandling (s.c. eller i.m.). Vid aktiv sjukdom rekommenderas parenteral tillförsel. Effekten insätter inom 6-8 veckor. Peroralt MTX i högre dos än 10 mg/m2 kroppsyta har sämre och variabel biotillgänglighet än parenteralt givet. Vid perorala doser över 10 mg/m2 finns viss ökad risk för gastrointestinala biverkningar. Lågdosbehandling (< 5 mg/m2) har ingen dokumenterad effekt. Vid ulcerös kolit har MTX ingen bevisad behandlingseffekt. Metotrexat Metoject, injektionsvätska, förfylld spruta 50 mg/ml Methotrexate, tablett 2,5 mg, injektions-/infusionsvätska. Dosering: Akut skov: 15-17 mg/m2 kroppsyta ges s.c. en gång/vecka; maxdos 25 mg/vecka. Underhåll: Oförändrat eller 10 mg/m2/vecka subkutant eller per os, max 15 mg/vecka. Biverkningar (se även FASS) Teratogena effekter - viktiga att kontrollera vid insättning att patienten inte är gravid samt under behandling ha fortlöpande översyn vad gäller behov av preventivmedel. Illamående dygnet efter injektion är vanligt. Andra biverkningar är blod- och mag-tarmbesvär, steatohepatit, leverfibros, atypisk interstitiell pneumoni . Lab-kontroller: Hb, TPK, LPK, diff, leverstatus, albumin och kreatinin. Första 1-2 månaderna tas blod- och leverprover 1 gång/vecka. Sedan med 1-3 månaders intervall. Folsyra-tillskott: Tillskott av folsyra rekommenderas1 till 6 dagar/vecka för att motverka biverkningar från tarm och benmärg. Tillförsel av folsyra motverkar ej den terapeutiska effekten. Till innehållsförteckning! 25 Biologiska läkemedel Anti-TNF Tumor Necrosis Factor (TNF) är ett inflammationsframkallande cytokin. Med rekombinantteknik har antikroppar riktade mot TNF framställts. TNF-blockerarna (anti-TNF) tillhör första generationens biologiska läkemedel. Patienter som behandlas med anti-TNF löper inte någon ökad risk för att drabbas av flertalet vanliga infektioner. Behandling med anti-TNF ökar dock risken för potentiellt allvarliga opportunistiska infektioner som listerios och pneumocystis jiroveci pneumoni. Behandling med anti-TNF kan även aktivera vilande infektioner, som hepatit B-, varicellae zoster- och CMV-infektion samt tuberkulos. Det föreligger även en viss ökad risk för tumörsjukdomar vid behandling med anti-TNF. För ytterligare information om sambandet mellan anti-TNF och infektioner respektive risken att utveckla av tumörsjukdomar hänvisas till följande delar i vårdprogrammet: Avsnittet; ”Opportunistiska infektioner och vaccinationer vid IBD” Avsnittet; ”Malignitetsrisk vid immunmodulerande läkemedelsbehandling”. I Sverige finns nu två anti-TNF preparat som är godkända för behandling av barn med IBD. Infliximab godkändes 2007 under indikationen pediatrisk Crohns sjukdom och 2012 erhöll läkemedlet även godkännande för indikationen pediatrisk ulcerös kolit. Adalimumab godkändes för behandling av pediatrisk Crohns sjukdom 2012. Även om det saknas jämförande studier torde de båda godkända anti-TNF-preparaten vara att betrakta som likvärdiga i sin behandlingseffekt. Indikationer Crohns sjukdom - Svår aktiv tarminflammation som inte svarat på annan behandling (se nedan) eller givit upphov till steroidberoende. - Vid svår perianal sjukdom bör tidig behandling övervägas. Fistlar och djupa fissurer svarar oftast sämre på steroid- och 5-ASA terapi och nutritionsbehandling. Vidare kan behandlingseffekt av tiopuriner så som azatioprin inte förväntas förrän efter 3-6 månader. Vid god läkning på kombinationsbehandling med immunmodulerare (azatioprin eller metotrexate) kan man efter några månader överväga att avsluta behandlingen med anti-TNF (så kallad ”bridging therapy”). Ulcerös kolit - Svår aktiv tarminflammation som inte svarat på annan behandling eller givit upphov till steroidberoende. - Rescuebehandling vid akut svårt skov av ulcerös kolit. Kontraindikationer - Aktiv tuberkulos (TB) - Andra allvarliga infektioner såsom sepsis och opportunistiska infektioner - Abscess Till innehållsförteckning! 26 Samråd inför behandling med anti-TNF: Beslut om insättande av TNF-blockad bör föregås av diskussion med barngastroenterologkollega (två-läkarbedömning). Behandlingar som bör ha övervägts innan behandling med anti-TNF påbörjas: - Total enteral nutrition (flytande kostbehandlingskur med fortsatt supplementering) - 5-ASA - Steroider - Antibiotika - Tiopuriner med optimala metaboliter under minst 4 månader. - Metotrexat under minst 3 mån. - Kirurgiskt dränage eller klyvning av fistlar. - Kirurgisk resektion av begränsat inflammerat tarmsegment eller plastik av ickeinflammatorisk tarmstriktur. - Kolektomi - vilket är en botande terapi hos patienter med ulcerös kolit! Undersökningar och kontroller inför behandlingsstart - Lungröntgen - TB-test (PPD eller IGRA-test) - Hepatit-B serologi (HBsAg, anti-HBs, anti-HBc, HBeAg, anti-HBe ) - Överväg MR-undersökning vid fistulerande sjukdom för att utesluta abscess. - Överväg endoskopi för att för att utesluta förekomst av intestinal komplikation (striktur eller fistel) och för att få information om tarminflammationen intensitet och utbredning som utgångsläge för att senare kunna bedöma behandlingseffekt. Monitorering av anti-TNF-behandling Mätning av dalnivån (trough level) av anti-TNF kan numera utföras inom rutinsjukvården. Dalnivåbestämning bör utföras vid terapisvikt för att klargöra om svikten beror på otillräcklig dosering av läkemedlet eller terapiresistens. Om patienten vid utvärdering efter 3 månader inte svarat på behandling med anti-TNF trots tillfredsställande nivåer av läkemedlet (3-7 μg/mL) bör detta klassificeras som en primär terapisvikt. Om låga nivåer av läkemedlet uppmäts kan terapisvikten förklaras av otillräcklig medicinering (kräver ökad dos eller minskat intervall) eller uppkomst av neutraliserande antikroppar. Data talar för att uppkomst av neutraliserande antikroppar kan förklara en stor del av den sekundära terapisvikt (upp mot 50% efter några års behandling) som setts vid uppföljningar av patienter som behandlas med infliximab. Kombinationsbehandling (anti-TNF och TP eller metotrexate) har visats minska risken för uppkomst av neutraliserande antikroppar mot anti-TNF. Inledande kombinationsbehandling med anti-TNF och TP i ett halvår har visats minska risken för senare terapisvikt på monobehandling med infliximab. I enstaka mindre studie har man sett att återgång till kombinationsbehandling ledde till minskade nivåer av neutraliserande antikroppar och återkomst av behandlingssvar för patienter med sekundär terapisvikt på infliximab-behandling. Det är fortfarande oklart om rent humana anti-TNF preparat (som adalimumab och golimumab) i mindre grad ger upphov till neutraliserande antikroppar och sekundär terapisvikt. Till innehållsförteckning! 27 Infliximab Remicade® Antikropp som till viss del är av humant- och till viss del av musursprung. Indikationer: Godkänd för behandling av Crohns sjukdom och ulcerös kolit från 6 års ålder. Dosering: Induktionsbehandling: 5 mg/kg i.v. (vecka 0, 2, 6). Underhållsbehandling: 5 mg/kg i.v. var 8:e vecka. Rescuebehandling: 5 mg/kg i.v. som singeldos. Genomförande av behandling med infliximab Lokala skriftliga rutiner för hur infliximab ska ges måste finnas. Läkare ska inför varje infusion ta ställning till om preparatet ska ges, i vilken dos och intervall till nästa infusion. Dos- och behandlingsintervall bör monitoreras så att sjukdomsgenombrott förhindras. Läkare ska finnas tillgänglig för att bedöma eventuella infusionsreaktioner. Utvärdering av behandlingssvar: Om indikationen är symptomgivande sjukdom bör behandlingssvaret utvärderas efter andra dosen. Föreligger då ingen tydlig effekt är det inte troligt att behandlingen har någon verkan men dubblerad dos (om 10 mg/kg) kan övervägas att ges vid ytterligare 1-2 tillfällen. Om indikationen är fistulerande sjukdom bör behandlingssvaret tidigast utvärderas efter tredje dosen. Om indikationen är tillväxthämning bör behandlingssvaret utvärderas efter 6 till 12 månaders behandling. Om initialt god effekt men denna minskar efter upprepade infusioner kan infusionsintervallet behöva minskas (dock ej kortare än 4 veckor) eller dosen ökas. Då stabil remission uppnåtts bör man försöka att glesa ut infusionerna genom att förlänga dosintervallet med en vecka i taget. Viss erfarenhet talar för att utsättningsförsök av infliximab bör övervägas om infusionerna kan ges så glest som var tredje månad. Infusionsreaktioner: Allergiska och andra infusionsrelaterade reaktioner förekommer vid infliximab-behandling varför förbehandling bör övervägas om tidigare infusionsreaktion eller om mer än 3 månader förflutit sedan föregående infliximab-behandling: En timme före behandling ges: - Hydrokortison (Solu-cortef ) 100 mg intravenöst - Antihistamin oralt - Paracetamol 10 mg/kg oralt Till innehållsförteckning! 28 Adalimumab Humira® Rent human antikropp. Indikationer: Godkänd för behandling av Crohns sjukdom från 6 års ålder. Om indikationen är terapisvikt på infliximab bör det gå ca 6 veckor innan behandlingsförsök med adalimumab påbörjas. Adalimumab är inte godkänt för behandling av pediatrisk ulcerös kolit men behandlingsförsök kan dock övervägas på barn vilka drabbats av överkänslighetsreaktioner av eller förlorat sitt svar på infliximab. Dosering: Ges subcutant. För barn under 40 kg rekommenderas startdos om 40 mg och därefter underhållsdos efter 2 veckor om 20 mg. För barn över 40 kg rekommenderas startdos om 80 mg följt av 40 mg efter två veckor och därefter underhållsdos efter ytterligare 2 veckor om 40 mg. Vid behov av snabbare behandlingssvar eller vid otillräckligt behandlingssvar kan doserna behöva ändras enligt anvisningar i FASS. Utvärdering av behandlingseffekt: Utvärdering av behandlingseffekt görs vanligen efter 12 veckor. Föreligger då ingen tydlig effekt bör behandlingen avslutas. Vid tveksamhet om effekt av behandlingen kan ytterligare fyra injektioner prövas vilka då ges med en veckas mellanrum. Då stabil remission uppnåtts bör man försöka att glesa ut infusionerna. Då infusionerna kan ges så glest som en gång i månaden talar viss erfarenhet för att utsättningsförsök av adalimumab bör övervägas. Infusionsreaktioner: Allergiska eller andra reaktioner förekommer mycket sällan vid injektion av adalimumab. Behandling med adalimumab kan därför ges i hemmet efter att patienten och familjen erhållit inledande stickutbildning på sjukhus. Golimumab Symphony® Rent human antikropp. Indikationer: Golimumab godkändes 2013 för behandling av vuxna patienter med ulcerös kolit. Det saknas ännu så länge både studier och erfarenheter av behandling med golimumab av barn med IBD. Integrinblockerare - leukocyt-migrationshämmare Våren 2014 godkände europeiska (EMA) och amerikanska (FDA) läkemedelsmyndigheterna vedolizumab (Entyvio®) för behandling av vuxna patienter med Crohns sjukdom och ulcerös kolit som inte svarat eller förlorat svaret på behandling med anti-TNF. Vedolizumab är en antikropp riktad mot en molekyl (α4β7 integrin) som uttrycks i blodkärlen i tarmslemhinnan. Genom blockad av integrinmolekylen förhindras infästning och utvandring av lymfocyter från cirkulationen till tarmens submucosa. Det finns än så länge inga studier av vedolizumabs effekt på barn och ungdomar med IBD. Till innehållsförteckning! Nutritionsbehandling 29 Aktiv tarminflammation kan leda till malnutrition beroende på många faktorer såsom ökad energiåtgång p.g.a. inflammation, ökade förluster genom blödningar och diarréer och/eller otillräckligt födointag p.g.a. minskad aptit, kräkningar och buksmärtor. Tunntarmssjukdom kan även ge upphov till malabsorption på grund av skadad tarmslemhinna, minskad enzymaktivitet, bakteriell överväxt eller p.g.a. ”kort tarm syndrom” efter upprepad kirurgi. Det gäller att bryta den onda cirkeln av inflammation, aptitlöshet och malnutrition. Tecken på malnutrition kan vara viktnedgång, tillväxthämning eller sen pubertetsutveckling. Markörer för nutritionsstatus är t.ex. längd, vikt, BMI, antropometriska mått, Hb, S-urea, Selektrolyter, S-protein/albumin, prealbumin och U-protein. Det kan vara indicerat att analysera vitaminer (främst B12, folsyra, fettlösliga vitaminer) samt spårmetaller. Dietistkontakt är angeläget för att tillförsäkra patienten adekvat intag av alla näringsämnen. Total enteral nutrition (se även bilaga med praktiska råd) Med total enteral nutrition (TEN) avses tillförsel av en komplett nutritionslösning samtidigt som allt annat intag av föda avbryts. Patienten får på detta sätt hela sitt behov av energi och näringsämnen säkrat. TEN har vid Crohns sjukdom en direkt antiinflammatorisk effekt jämförbar med steroidbehandling och saknar medicinska biverkningar. Den kan användas för att inducera remission och fortsatt partiell enteral nutrition verkar kunna förlänga remission. Indikation: Crohns sjukdom - kan övervägas som förstahandsbehandling vid aktiv tunntarmsoch/eller kolonsjukdom (ensamt eller i kombination med farmakologisk behandling) och då särskilt för patienter i prepubertet/pubertet med avstannad vikt- och längdutveckling eller markant viktnedgång. Kan användas både vid debut och vid senare skov. Relativ indikation: Ulcerös kolit – dokumentation saknas avseende den antiinflammatoriska effekten men behandlingen kan övervägas vid samtidig uttalad malnutrition för att säkerställa tillräckligt näringsintag. Till innehållsförteckning! 30 Näringspreparat som används vid enteral nutrition: - Helproteinpreparat (polymer kost) - Oligopeptidpreparat (semielementarkost) - Aminosyrepreparat (elementarkost) Den antiinflammatoriska effekten av preparaten anses likvärdig. Av smak- och kostnadsskäl väljs främst helproteinpreparat. Dosering: Vid aktiv inflammation är målet är att ge 110 – 140 % av det normala kaloribehovet. Beräkning av energibehov görs enligt Nordiska näringsrekommendationer för ålder och vikt. Utförande: Behandlingen bör pågå under 6–8 veckor. Under denna tid skall patienten inte inta annan mat. Helproteinpreparat kan av många tas per os. Elementarkostpreparaten behöver oftast ges via nasogastrisk sond. Tillförseln bör trappas upp under två till fem dagar. Efter att behandlingsperioden är slut så återinförs vanlig kost gradvis med nedtrappning av näringspreparat under 4-5 dagar. Vid behov av täta behandlingsperioder eller vid andra problem kan man överväga perkutan endoskopisk gastrostomi (PEG). Partiell enteral nutrition Efter en behandlingsperiod med TEN så kan näringspreparat användas dag- eller nattetid som kosttillskott för att förlänga remissionen och främja nutritionen, speciellt till patienter som uppvisar tillväxtstagnation och/eller sen pubertetsutveckling. Kostförstärkning med näringspreparat Enteral nutritionslösning kan användas utöver den vanliga maten som ett viktigt protein- och energitillskott men ger då inte samma antiinflammatoriska effekt som vid strikt total enteral nutrition. På marknaden finns även olika typer av balanserade näringstillägg som kan drickas i samband med måltid. Annan dietbehandling Mjölkfri kost kan i enstaka fall ge förbättring. Vegetarisk kost kan ge tillfällig symtomlindring men har ej visat sig ha någon bestående positiv effekt vid IBD. Vegetarisk dietregim tenderar att bli näringsfattig och är otillräcklig för de ökade behov som föreligger vid IBD. Vitaminer och mineraler Brist på mineraler och vitaminer kan föreligga och ge upphov till olika symtom; bl.a. järn, zink, kalcium, magnesium, fosfor, folat, samt vitaminer (A, B12, D, E och K). Till exempel hämmad benmineralisering (låg bentäthet) som ses vid IBD kan vara associerad till låga calcium- och Dvitaminnivåer, men sannolikt spelar inflammationsaktiviteten per se och nedsatt fysisk aktivitet även en betydande roll. Till innehållsförteckning! 31 Total parenteral nutrition (TPN) eller partiell parenteral nutrition (PPN) Används då enteral nutrition inte tolereras. Indikation: - Svårt skov av kolit, fulminant kolit - Före elektiv operation på malnutrierad patient - Svår fistelsjukdom (Crohns sjukdom) - Terapiresistent IBD, där kirurgi ej kan genomföras Utförande: TPN i storpåse. Som regel krävs tidig tillgång till central venkateter med de komplikationsrisker sådan medför (sepsis, endokardit, pneumothorax). Kirurgisk behandling Allmänna synpunkter Vid handläggning av IBD-patienter, där det i det fortsatta förloppet kan bli aktuellt med kirurgisk behandling, bör kirurg med erfarenhet av barn med IBD tidigt konsulteras. Det är angeläget för både patient och föräldrar samt behandlande läkare att man om möjligt redan har en etablerad relation när kirurgisk åtgärd blir aktuell och att man förmedlar en realistisk bild av vad kirurgisk behandling kan innebära på kort och lång sikt, både vad gäller positiva och negativa effekter. Preoperativa aspekter Om kirurgisk behandling skall ske är det viktigt att tillse att patienten preoperativt befinner sig i gott allmäntillstånd och bästa möjliga nutritionstillstånd. Detta kan innebära att patienten före operation behöver en period med fullgod enteral eller parenteral nutrition, såvida tillståndet inte kräver omedelbar operation. Önskvärt är också att inte utföra större kirurgiska ingrepp under pågående systemisk steroidbehandling i högdos p.g.a. ökad komplikationsrisk. För närvarande finns inga indikationer på att immunmodulerande behandling i övrigt, exempelvis tiopuriner eller infliximab, påtagligt skulle öka risken för postoperativa komplikationer. Ulcerös kolit Indikationer för akut kolektomi: - Svår kolit med akut komplikation (svår toxisk megakolon, kolonperforation eller massiv tarmblödning). - Utebliven effekt av intensiv medicinsk behandling (se avsnitt ”Svårt skov av kolit”). Indikationer för elektiv kolektomi: - Frekventa svåra attacker av kolit som svarar otillfredsställande på medicinsk behandling. - Kronisk terapikrävande sjukdom som inte svarar adekvat på behandling eller där sjukdom och/eller medicinering (steroidberoende) negativt påverkar tillväxt, pubertetsutveckling samt livskvalitet (utbredning ovan vänster flexur stärker indikationen för kirurgisk åtgärd). - Dysplasi/malignitet i kolon eller rektum. Till innehållsförteckning! 32 Tekniskt förfarande: Initialt rekommenderas kolektomi, och ileostomi, med kvarlämnad rektum. Rekonstruktiv kirurgi utförs när allmäntillståndet tillåter, vanligen minst 6 månader efter kolektomin. Ibland används skyddande loop-ileostomi några månader postoperativt. Detta två- eller tre-stegsförfarande rekommenderas framförallt vid akut kirurgi, om patienten behandlas med högdossteroider, är malnutrierad eller om Crohns sjukdom inte kunnat uteslutas. Vid elektiv kolektomi kan i selekterade fall, där det inte finns några riskfaktorer, kolektomi och rekonstruktion göras vid samma tillfälle. De två vanligaste kirurgiska alternativen för rekonstruktion, ileorektal anastomos (IRA) och ileoanal anastomos med reservoar (IPAA), bör noga vägas mot varandra i det individuella fallet. Föräldrar och barn måste informeras om för- och nackdelar och aktivt ges möjlighet att delta i valet av metod. IRA ger en bättre anorektal funktion än IPAA. IRA kan vara ett bra alternativ hos unga människor eftersom dissektion i lilla bäckenet i samband med IPAA ökar risken för sexuella störningar och nedsatt fekunditet eller fertilitet. Den kvarvarande rektum måste efter IRA kontrolleras regelbundet beroende på risken att utveckla dysplasi eller malignitet. Efter IRA krävs långtidsbehandling med antiinflammatoriska läkemedel för att förebygga inflammation i rektum. Det finns stor risk att det krävs en senare proktektomi. Många patienter kan temporärt ha nytta av IRA och vinna värdefulla år med kvarvarande ändtarm under en viktig fas i livet. Permanent ileostomi eller Kock-reservoar är sällan aktuella som behandlingsalternativ hos barn. Komplikationer till kirurgisk behandling av ulcerös kolit: Akuta - Blödning - Anastomosläckage/fistulering - Sårinfektion/abdominella abscesser - Adherensbildning/ileus Till innehållsförteckning! 33 Långsiktiga - Pouchit * - Ileo-anal strikturering - Otillfredsställande avföringskontinens - Adherensbildning/ileus - Sterilitet, nedsatt fekunditet, sexuella störningar och blåstömningsstörningar - Dysplasi/malignitet i kvarvarande rektum Vid stomi - Bandageringsproblem (läckage, lukt, hudproblem,) - Stora stomiflöden med saltförluster - Stomiprolaps, strikturering och parastomalt bråck * Pouchit är en inflammation i ileumreservoaren av oklar genes. Upp till hälften av patienterna drabbas någon gång. Hos några patienter (5-10%) blir den kronisk. Förstahandsbehandling är med ciprofloxacin och i andra hand metronidazol under två veckor. Långtidsbehandling med ciprofloxacin och/eller metronidazol kan vara effektivt mot kronisk pouchit. Vid terapiresistens kan man försöka med steroider lokalt eller i systemisk form (budesonid per os). Probiotika i form av VSL#3 kan eventuellt prövas (finns tabell över dosering i ECCO/ESPGHANs dokument för ulcerös kolit 2012). I enstaka fall kan man tvingas avlasta med ileostomi eller ta bort reservoaren. Postoperativ medicinsk behandling: Efter kolektomi kan systemisk antiinflammatorisk behandling avvecklas. Kvarvarande rektumstump fordrar ofta lokalbehandling med 5-ASA-suppositorier alternativt lokala steroider för att dämpa den inflammatoriska aktiviteten. Ibland kan även urspolning av rektum krävas om patienten tömmer rektum dåligt med åtföljande sekretstagnation, bakteriell överväxt och inflammatorisk reaktion. Patienter som opererats med ileorektal anastomos skall alltid erhålla antiinflammatorisk behandling Förväntat funktionellt resultat: - IRA/IPAA: Initialt ca 10-12 tömningar/dygn - efter stabiliseringsperiod på ½ - 1 år ca. 4-6 tömningar/dygn. Urgency i ca 15 – 30 % och soiling i ca 10 – 30 % av fallen. Perianal irritation relativt vanligt, speciellt vid hög tömningsfrekvens eller soiling. - Om aktivering av inflammationen i kvarvarande rektum eller pouchit ses ökade besvär. - Kvinnor med bäckenreservoar rekommenderas att föda barn med kejsarsnitt för att inte riskera skador på analsfinkter eller reservoar. Crohns sjukdom Indikationer för kirurgisk behandling vid Crohns sjukdom: - Otillräcklig effekt av medicinsk eller nutritiv behandling med kvarstående besvärande symptom eller tillväxtretardation samt uttalade medicinbiverkningar - Tarmperforation eller intraabdominella abscesser - Perianalabscess som fordrar incision - Fistlar som ej läker på annan behandling - Tarmstenos/obstruktion - Okontrollerbar blödning från mag-tarmkanalen - Behov av gastrostomi för enteral nutrition Till innehållsförteckning! 34 Tekniskt förfarande (generella synpunkter): Kirurgisk behandling är ej kurativ utan reducerar inflammatorisk belastning och/eller eliminerar obstruktion, fistelbildning eller abscess. Om möjligt utförs dilatationer eller enteroplastiker i stället för tarmresektioner. Är resektion av tarm nödvändig utförs den med minsta möjliga marginal. Ventrikeln. Gastrostomi är inte kontraindicerad vid Crohns sjukdom. Ibland kan gastrostomi vara ett bra alternativ vid nutritionsbehandling, exempelvis om patienten har svårt att fördra nasogastrisk sond. Tunntarmen. Tidigare använt förfarande med resektion av sjuk tarm med marginal botade ej patienten och resulterade ibland i ”kort-tarm-syndrom ”. Numera görs dilatationer, strikturplastiker eller kortast möjliga tarmresektioner, eventuellt med peroperativ intraluminal endoskopi som stöd för att bedöma omfattningen av ingreppet. Vid terminal ileit har laparoskopiskt assisterad ileocekalresektion visats innebära en lägre risk för komplikationer och mortalitet än konventionell öppen kirurgi, utan att risken för recidiv ökar. Kolon. Kolit (akut eller kronisk) som inte svarar tillfredsställande på medicinsk behandling kan kräva kolonresektion eller kolektomi, eventuellt med blind förslutning av proximala änden av distala tarmen och ileostomi. I senare skede eftersträvas att tarmkontinuiteten återställs med ileorektal anastomos. Efter detta ingrepp är recidivrisken relativt hög. Rektoanalregionen. Överväg alltid om anala förändringar hos barn och ungdom kan vara del i Crohns sjukdom. Kirurg bör tidigt involveras i bedömningen av patienter med symtomgivande anala Crohn-förändringar. Anala förändringarna kan vara de första och enda symtomen under lång tid. MR-undersökning av lilla bäckenet kan vara värdefullt vid utredning av anala fistlar och abscesser. Metronidazol, ciprofloxacin, azatioprin samt infliximab kan ha god behandlingseffekt. Risken för recidiv efter avslutad infliximab-behandling är stor. Anala Crohnförändringar svarar vanligen dåligt på steroidterapi och nutritionsbehandling (se även avsnitten ”Farmakologisk behandling” och ”Nutritionsbehandling”). Undvik extensiv kirurgi. Anala manifestationer som inte påtagligt besvärar patienten lämnas utan åtgärd. Förändringarna uppvisar inte sällan cykliskt förlopp, och även uttalade förändringar kan ibland försvinna utan åtgärd. Abscesser dräneras, låga fistlar kan ev. klyvas. Ofta föreligger utdraget postoperativt läkningsförlopp. Högre fistlar är komplicerade – resektion medför risk för sfinkterskada. Setonbehandling (permanent dräneringstråd) med löst satta setoner rekommenderas som förstahandsmetod. Vid terapisvikt kan avlastande ileostomi övervägas – läkning av anala manifestationer sker då ofta, men vid restitution av tarmkontinuiteten är recidivrisken hög. Till innehållsförteckning! 35 Komplikationer till kirurgiska åtgärder av Crohns sjukdom: Akuta - Blödning - Anastomosläckage/fistulering - Sårinfektion/abdominella abscesser - Adherensbildning/ileus - Stora stomiflöden med saltförluster Långsiktiga - Recidiv – vanligen i anslutning till anastomos eller prestomalt - Adherenser/ileus - Fistulering/abscessbildning - Malabsorption (B12, gallsalter, fettlösliga vitaminer) - Diarré - Vid utbredd sjukdom i tunntarm och extensiv kirurgisk behandling risk för kort-tarm-syndrom (liten risk vid modern medicinsk och kirurgisk behandling) Farmakologisk behandling efter kirurgisk åtgärd mot Crohns sjukdom: Den farmakologiska antiinflammatoriska systemterapin kan inte alltid som vid ulcerös kolit postoperativt avvecklas, utan även efter kirurgisk åtgärd mot Crohns sjukdom kan behandling behöva fortgå. Bra studier saknas om postoperativ recidivskyddande behandling. Det finns dock visst stöd för att immunsupprimerande terapi behandling (t.ex. azatioprin, metotrexat, anti-TNF preparat) eller 5-ASA-preparat kan ge skydd. Uppföljande skopi indicerad postoperativt. Fortsatt medicinering bör alltid ske i samråd mellan behandlande kirurg och pediatriker. Handläggning av patient med svårt skov av kolit. Den föreslagna handläggningen vid skov av svår kolit följer i stort de rekommendationer som sammanställdes 2011 av experter från ECCO och ESPGHAN. Viss anpassning av riktlinjerna har gjorts i enlighet med svenska erfarenheter och terapitraditioner inom såväl pediatriken som inom vuxengastroenterologin. Rekommendationerna är utarbetade för svårt skov av ulcerös kolit men kan vara vägledande även vid handläggning av svår kolit vid Crohns sjukdom eller vid oklassificerad kolit. Patienter med svår kolit bör läggas in på vårdavdelning för observation, utredning och behandling. Handläggningen förutsätts ske i samarbete mellan erfaren barngastroenterolog och kirurg och kräver daglig klinisk bedömning av sjukdomsutvecklingen. Beredskap för akut kolektomi bör finnas på enheten; detta gäller i synnerhet om patienten inte förbättrats inom 5– 7 dagar. Ett svårt skov av ulcerös kolit är ett livshotande tillstånd om inte handläggningen sker korrekt. Initial bedömning och utredning Bedömningen av sjukdomens svårighetsgrad bör grunda sig på en sammanvägning av sjukdomshistorien, allmäntillståndet, biokemiska provtagningsfynd och det senaste dygnets sjukdomsaktivitet enligt PUCAI (angående index-beräkning se avsnittet ”Bedömning av sjukdomsaktivitet” sidan 9). Till innehållsförteckning! 36 Allmäntillstånd, vikt, kroppstemperatur, andning, cirkulation (puls och blodtryck) och bukstatus (ömhet? uppspändhet? defense? resistenser? omfång?) bör kontrolleras. Vid inläggning bör följande prover tas: o Blodprov Blodstatus CRP, SR, Albumin Leverstatus Elektrolyter o Avföringsprov F-odling av bakteriella tarmpatogener Toxinbestämning av Clostridium difficile F- calprotectin Överväg virusdiagnostik (rota, adeno, CMV) o Överväg sigmoideoskopi Vid osäker diagnos bör en bekräftande sigmoideoskopi övervägas. Eventuell skopi bör göras utan förberedande laxering. Skopin bör utföras under försiktig luftinsufflation för att i största möjliga mån undvika perforation. Biopsier bör tas varsamt från nedre rektums bakvägg. Begär immunhistokemisk färgning avseende CMV-infektion. Initial handläggning Nutrition o I första hand bör fortsatt intag av vanlig mat och dryck ordineras. Om otillräckligt vätske- och näringsintag (daglig vätske- och kaloriberäkning) bör stödjande enteral nutrition övervägas. Vid tecken på ”akut buk” och misstanke om snart behov av kolektomi bör dock tarmvila ordineras. Tarmvila (total/partiell) bör även övervägas vid uttalade enterala förluster och/eller vid svår smärtproblematik. I dessa fall bör även intensivvårdsövervakning och etablerande av central venkateter för TPN övervägas. Bukröntgen o Vid svåra buksmärtor bör buköversikt (BÖS) utföras skyndsamt för att utesluta tarmperforation eller toxisk tarmdilatation. Erytrocyttransfusion o Vid uttalad anemi bör erytrocytransfusion övervägas. Kortikosteroider o Korticosteroid-medicinering är grunden i den medicinska behandlingen och bör till dess förbättring inträtt ges intravenöst: Prednisolon (Precortalon aquosum) 2 mg/kg/dygn (max 60 mg/dygn) delat i två doser eller Betametason (Betapred) 0,25 mg/kg/dygn (max 8 mg/dygn) delat i två doser. Till innehållsförteckning! 37 Antibiotika o Intravenös antibiotikabehandling bör endast ges vid misstanke om att koliten är triggad/orsakad av bakteriell infektion eller vid misstanke om att koliten givit upphov till komplicerande bakteriemi-sepsis eller toxisk megakolon. Vid misstanke om sådan bakteriell translokation bör antibiotika som täcker både gramnegativ och anaerob infektion ges. Smärtlindring o Analgetika Vid buksmärtor bör i första hand paracetamol övervägas. Vid svårare buksmärtor kan opiater användas med viss försiktighet eller annat av smärtläkare förordat analgetika övervägas. NSAID-preparat bör undvikas då dessa anses kunna förvärra tarminflammationen. o Tarmvila Vid uttalad smärtproblematik kan tillfällig tarmvila medföra smärtlindring. 5-ASA-läkemedel bör undvikas/utsättas o 5-ASA-preparat har ingen effekt vid akut svår kolit. De kan ge upphov till diarré och således grumla bilden av det kliniska förloppet. Om patienten står på 5ASA-preparat bör man göra uppehåll med denna medicinering till dess att tydlig förbättring inträtt. Fortlöpande övervakning av sjukdomsförloppet Allmäntillstånd, vikt, kroppstemperatur, andning, cirkulation (puls, blodtryck) och bukstatus (bukomfång) bör kontrolleras minst två gånger dagligen eller oftare vid behov. Sjukdomsaktiviteten bör utvärderas dagligen med PUCAI. Dagliga prover bör övervägas beroende på initiala provsvar och kliniskt förlopp, t.ex. blodstatus (Hb, lpk. tpk), CRP, albumin, elektrolytstatus, levervärden, urinsticka. Röntgen buköversikt bör övervägas dagligen vid klinisk bild som inger misstanke om toxisk megakolon eller kolonperforation. Till innehållsförteckning! 38 Monitorering av behandlingssvar och ställningstagande till ytterligare åtgärder Vid långsamt steroidsvarande kolit (PUCAI >45 dag 3 efter inledd kortisonbehandling) Följande förberedelser inför eventuellt behov av ytterligare medicinsk eller kirurgisk behandling bör inledas: o Bedömning av kirurg och information om kolektomi. o Förberedelse inför ev. TNF-blockadbehandling Riktad anamnes, lungröntgen och PPD (eller IGRA-test) för att utesluta tuberkulos inför behandling med TNF-blockare. o CMV-diagnostik (blod, faeces, biopsi) Sigmoideoskopi med biopsitagning för immunohistokemisk analys under frågeställningen CMV-kolit som underlag för eventuellt kompletterande behandlingsförsök med antiviral medicinering. Vid steroidresistent kolit (PUCAI >65 dag 5 efter inledd kortisonbehandling) Kompletterande behandling med infliximab prövas eller kolektomi utföras. Hos patienter som uppvisar visst svar på steroidbehandlingen (PUCAI ≤ 60 men ≥ 35 dag 5 efter inledd kortisonbehandling) I dessa fall kan man avvakta ytterligare 2-5 dygn innan beslut om att ge infliximab eller utföra kolektomi tas. Under väntetiden kan behandlingsförsök med ganciklovir, som tillägg till kortison, prövas om histopatologisk analys stöder misstanken om komplicerande CMV-kolit. Utvidgad medicinsk behandling (rescue) - Överväganden Inför övervägande av att utvidga den medicinska behandlingen bör man betänka att långvarig kortisonbehandling ökar risken för operativa och postoperativa komplikationer vid och efter kolektomi. Förutsatt att patienten med akut skov av IBD svarar på behandling med Infliximab*, givet som en dos (5 mg/kg), har denna rescue-behandling visat sig minska risken för kolektomi under åtminstone de efterföljande två åren. Infliximab har inte visats påverka risken för komplikationer vid och efter kolektomi. Vid uteblivet svar en vecka efter infliximabinfusionen eller vid otillräcklig respons (minskning med ≤ 20 PUCAI-poäng) två veckor efter infusionen bör akut kolektomi starkt övervägas. I den internationella rekommendationen ESPGHAN/ECCO 2011 framställs calcineurinhämmare som ett likvärdigt alternativ till infliximab. I Sverige har dock calcineurin-hämmare (cyklosporin och tacrolimus) mycket sällan prövats som rescue-behandling. Calcineurinhämmare bör därför betraktas som ett andrahands val, men preparaten kan övervägas vid utvalda fall på kliniker väl förtrogna med dessa läkemedel. Samtida infektion med clostridium difficile och CMV är associerade med sämre prognos hos patienter med svårt kolitskov. Påvisande av clostridium difficile och CMV vid svårt skov av kolit bör därför leda till riktad behandling men denna ersätter vanligen inte steroider eller TNF-blockad och anti-viral behandling bör inte fördröja beslut om kolektomi. 39 * Inga andra anti-TNF preparat har prövats på denna indikation. Vid akut behandling torde intravenös läkemedelstillförsel vara att föredra. Det finns således inga skäl att överväga annat anti-TNF preparat än infliximab vid rescue-behandling. Akut kolektomi - Överväganden Vid akut kolektomi på grund av svår kolit förordas subtotal kolektomi med bevarande av rektum och anläggande av ileostomi. För utförlig redogörelse för förberedelse, utförande och uppföljning av kirurgisk behandling hänvisas till särskilt kapitel i vårdprogrammet. Tarmperforation är en absolut indikation för akut kolektomi. Vid stora blödningar med upprepat transfusionsbehov bör akut kolektomi övervägas. Toxisk megakolon (toxisk kolondilatation) definieras som radiologiskt konstaterad kolondilation* i kombination med kliniska tecken på systemisk (toxisk) påverkan* (definitioner se nedan). Toxisk megakolon är ett potentiellt livshotande tillstånd och i första hand bör därför akut kolektomi övervägas. Vid stabila vitalparametrarna kan dock konservativ behandling med intravenös antibiotika, korrektion av elektrolytrubbningar och tarmvila prövas. Det saknas erfarenheter av behandling med TNF-blockad vid påvisad toxisk megakolon varför infliximab ej bör ges vid detta tillstånd. Om symptomen tilltar eller är oförändrade efter 48-72 timmar bör omedelbar kolektomi utföras. Till innehållsförteckning! 40 *Pediatriska kriterier för diagnosen toxisk megakolon Följande kriterier gäller för att ställa diagnosen toxisk megakolon hos barn: 1. Fynd vid röntgen av dilaterad kolon transversum: ≥ 56 mm i diameter för barn ≥ 10 års ålder och vuxna ≥ 40 mm för barn < 10 års ålder 2. Tecken på systemisk påverkan i form av minst någon av följande: Feber > 38 ° C Takykardi (hjärtfrekvens > 2 SD över medel för åldern) Dehydrering Elektrolytrubbning (natrium, kalium, klorider) Ändrad medvetandegrad Hypotension – cirkulatorisk chock Uppföljning Då den medicinska behandlingen lett till en tydlig förbättring (minskning med ≥ 20 PUCAIpoäng) kan steroiderna börja trappas ut. Då recidivrisken vid ulcerös kolit är hög bör de flesta patienter som genomgått ett skov med svår kolit ordineras underhållsbehandling med 5-ASA (eller sulfasalazin) och tiopurin. För de patienter som svarat på rescue-behandling med infliximab kan ytterligare två doser (efter 2 och 6 veckor) övervägas som brygga över tills den immunmodulerande behandlingen uppnått effekt. Psykosocialt stöd Forskning har visat att IBD i barn- och ungdomsåren är förenat med stora psykosociala påfrestningar. Barn med IBD är den grupp kroniskt sjuka barn som skattar sig lägst vid livskvalitetsundersökningar. Anledningen till detta är mångfacetterad. Symtomen vid IBD och även behandlingen kan vara påfrestande och leder ofta till begränsningar av olika aktiviteter. Vidare är sjukdomsförloppet oförutsägbart och går ofta i skov, vilket gör att aktiviteter och skolgång kan vara svåra att planera. Sjukdomens symtombild kan även uppfattas som ”socialt degraderande” och vara känslig att berätta om. Redan vid insjuknande/diagnos är påfrestningarna i familjen stora. En kronisk sjukdom påverkar alla i familjen. I anslutning till insjuknandet är det viktigt att kontakt etableras med pediatriker med gastroenterologisk profil, gastro-/nutritionssköterska, barndietist och kurator/ psykolog/barnpsykiatriker d.v.s. ett IBD-team som kan erbjuda socialt och psykologiskt stöd. Beakta även möjligheter till: - Tillfällig föräldrapenning för vård av sjukt barn Läkarutlåtande svårt sjukt barn Läkarutlåtande föräldrapenning barn 12-16 år Läkarutlåtande för vårdbidrag Till innehållsförteckning! 41 Uppföljning av barn/ungdomar med IBD Uppföljningen av barn och ungdomar med diagnostiserad IBD måste individualiseras allt efter den kliniska bilden. Återbesöksfrekvensen bestäms utifrån sjukdomsbild och typ av medicinering. Återbesök Under den inledande behandlingsfasen bör kontakten med behandlingsteamet vara tät. Efter att patienten kommit i remission bör patienten följas fyra gånger/år för kontroll av tarmsjukdomen, dess extraintestinala manifestationer, dess påverkan på tillväxtoch pubertet samt biverkningar av läkemedel.. Återbesöket som även kan inbegripa samtal med och bedömning av olika personer i IBD-teamet, bör omfatta kliniskt status, längd/vikt, , pubertetsbedömning, samt labprover (t.ex. blodprov avseende inflammatoriska markörer, blodstatus, albumin, leverstatus, S-pankreasamylas, kreatinin, samt avföringsprov för Fcalprotectin). I senare skede, vid lugnt sjukdomsförlopp och normal tillväxt, bör uppföljande kontroller till läkare ske med 6 till 12 månaders intervall. Kvartalsvis kontroll inkluderande provtagning och vikt/längd kan då ske hos sjuksköterska i teamet. Nutritionsbedömning sker minst en gång per år av dietist och/eller läkare. Endoskopikontroll vid IBD Strikta rekommendationer för endoskopikontroll för bedömning av sjukdomsaktiviteten går ej att ge. Kontrollbehovet får fastställas mot bakgrund av sjukdomstyp, duration, utbredning, aktivitet, samt aktuell behandling och blir således en individuell bedömning i varje enskilt fall. Utifrån aktuell frågeställning behöver man också ta ställning till endoskopins omfattning, d.v.s. vilka delar av mag-tarmkanalen som skall undersökas. Allmänna riktlinjer för endoskopikontroll: Vid differentialdiagnostiska överväganden Att utvärdera aktuell sjukdomsutbredning och intensitet Att utesluta tillkomst av komplikationer, t.ex. striktur Bör särskilt övervägas inför ställningstagande till större behandlingsförändringar som TNF-blockad eller kirurgi Utvärdering av behandlingseffekt vid användande av potenta läkemedel såsom antiTNF preparat. Till innehållsförteckning! 42 Långvarig duration av inflammatorisk tarmsjukdom - risk för dysplasi. Vid ulcerös kolit och Crohn-kolit föreligger en ökad risk för utveckling av dysplasi/malignitet i kolon och rektum, fr.a. vid utbredning proximalt om vänster flexur. Är inflammationen under kontroll minskar malignitetsrisken. Förekomst av skleroserande kolangit ökar risken för malignitet i kolon. Hereditet för koloncancer stärker indikationen för kontroll. Arbetsgruppen inom Svensk förening för gastroenterologi och gastrointestinal endoskopi har utarbetat rekommendationer för endoskopiska kontroller vid ulcerös kolit, vilka sammanfattas i protokoll från 2009 (se bilaga 2). Opportunistiska infektioner och vaccinationer vid IBD Vid IBD rekommenderas en översyn av patientens vaccinationsläge och immunitet inför start av immunmodulerande behandling. Denna översyn bör helst ske redan vid debut av sjukdomen, d.v.s. i samband med att diagnosen IBD ställs. Se vidare bilaga 3. Immunmodulerande behandling medför en ökad risk för opportunistiska infektioner. Svensk Gastroenterologisk Förening (SGF) har därför 2011 utarbetat följande dokument: ”Nationella riktlinjer för handläggning av infektionsproblem vid immunmodulerande behandling av IBD”, baserat på ECCOs rekommendationer från 2009. Följ länken: Nationella riktlinjer för handläggning av infektionsproblem vid immunmodulerande behandling av IBD (2011-03-06) Malignitetsrisk vid immunmodulerande läkemedelsbehandling Allt sedan kortison introducerades på 1950-talet har läkemedel som påverkar det systemiska immunförsvaret varit en viktig del av den farmakologiska behandlingen av IBD. Sedan mitten av 90-talet har tiopuriner förskrivits till barn och ungdomar med svårare IBD. Med introduktionen av anti-TNF preparaten vid millennieskiftet utökades den immunmodulerande terapiarsenalen. Inom de närmaste åren kommer förmodligen ytterligare proteinbaserade läkemedel (biologiska läkemedel) med immunmodulerande verkan att godkännas för behandling av pediatrisk IBD. Det råder en viss begreppsförvirring avseende begreppet ”immunmodulerande läkemedel”, men i vårdprogrammet används termen som ett samlingsnamn för mediciner (utöver kortikosteroiderna) vars behandlingseffekt förklaras av att de direkt påverkar immunförsvaret. Patienter som behandlas med immunmodulerande läkemedel (såsom tiopuriner, metotrexate och biologiska läkemedel) och kortikosteroider skall betraktas som mer eller mindre immunsupprimerade. Den utökade terapiarsenalen har avsevärt minskat symptombördan och förbättrat livskvaliteten hos många barn och ungdomar med IBD. Den ökande användningen av immunmodulerande läkemedel har dock medfört att en del av IBD-patienterna utsätts för en ökad risk för vissa infektioner men även för vissa tumörsjukdomar. Kortikosteroider ökar risken för infektioner men verkar inte påverka risken för tumörsjukdomar. Under de senaste åren har sambanden mellan tiopuriner och tumörrisk bland IBD-patienter kunnat studeras i stora registerstudier. En meta-analys av dessa studier har kunnat påvisa en något (cirka två gånger) ökad risk för att drabbas av framtida hudcancer i form av skivepitelcancer och basaliom (ej melanom) för de patienter som har behandlats med 43 tiopuriner. Barn och ungdomar som exponeras eller har exponerats för tiopuriner bör därför uppmanas till livslång varsamhet med hudskadande solstrålning. En annan meta-analys av dessa studier har visat att pågående behandling med tiopuriner medför en något ökad risk (cirka. fem gånger) för lymfom (av non-Hodgkin typ) bland IBDpatienter. Möjligen föreligger ett samband mellan durationen av tiopurin-behandlingen och en ökad risk för lymfom. Tidigare exponering för tiopuriner verkar dock inte vara associerat med en ökad risk för framtida lymfom. Risken för tiopurin-associerade lymfom synes vara dubbelt så stor bland män som bland kvinnor och ökar med stigande ålder. Möjligen är den relativa risken för lymfom något större bland ungdomar men den absoluta risken för yngre IBDpatienter som behandlas med tiopuriner att insjukna i lymfom är betydligt lägre än den för äldre IBD-patienter. I den enda större studie som försökt beräkna risken för lymfom bland barn och ungdomar med IBD skattades risken till cirka ett fall per 2000 tiopurinbehandlingsår. Avsaknaden av säkra samband mellan immunmodulerande läkemedel och uppkomst av lymfom bland patienter med juvenil reumatoid artrit (JRA) har lett till spekulationer om att metotrexat (som är grunden för den immunmodulerande läkemedelsbehandlingen vid JRA) vore att föredra framför tiopuriner även vid IBD. Jämförelser av malignitetsrisken mellan de båda sjukdomarna kompliceras dock av att obehandlad JRA, i motsats till IBD, är associerat med en ökad risk för lymfom. Antalet jämförande effektstudier mellan de båda preparaten är också få och erfarenheten av metotrexat-behandling vid IBD är ännu relativt liten. Tills vidare kvarstår därför rekommendationen om att tiopuriner i första hand bör användas som grund för den immunmodulerande läkemedelsbehandlingen vid pediatrisk IBD. Hepatosplenärt T-cellslymfom (HSTCL) är en mycket ovanlig och allvarlig lymfom-form. Global säkerhetsuppföljning under 15 år har identifierats ett 40-tal IBD-patienter som insjuknat i HSTCL. Nästan alla IBD-patienter som insjuknat i HSTCL har varit ynglingar eller yngre män. Lymfom-formen verkar uppträda något oftare hos patienter med Crohns sjukdom än bland de med ulcerös kolit. Drygt hälften av IBD-patienter som drabbats av HSTCL har behandlats samtidigt med både tiopuriner och anti-TNF, medan övriga endast medicinerat med tiopuriner. Då anti-TNF preparaten är tämligen nya finns relativt lite data om långtidsrisker för tumörsjukdomar för IBD-patienter som behandlats med denna läkemedelsgrupp. Det faktum att det stora flertalet IBD-patienter som behandlats med anti-TNF samtidigt har medicinerat med tiopuriner, gör att det är svårt att klarlägga vilket av preparaten som förklarar den observerade ökade lymfomrisken. Tillgängliga säkerhetsdata från såväl företag som myndigheter har dock ännu inte kunnat visa att monobehandling med anti-TNF ökar risken för cancer inklusive lymfom hos IBD-patienter. De senaste årens publicerade studier har delvis kommit att förskjuta skuldbördan för den ökade lymfomrisken bland IBD-patienter som behandlas med immunmodulerande läkemedel från anti-TNF till tiopuriner. För närvarande råder dock ingen konsensus bland internationella experter om tillgängliga data räcker som underlag för att ändra rådande behandlingsriktlinjer. Erfarenheter från transplantationsmedicinen talar för att immunmodulering i sig, snarare än någon enskild preparatgrupp, är en viktigare förklaring till den ökade risken för lymfom som ses bland organtransplanterade barn och ungdomar. Tills vidare gör vårdprogramgruppen fortsatt bedömningen att behandling med tiopuriner i de flesta fall bör prövas innan behandling med anti-TNF övervägs. Till innehållsförteckning! 44 I en dansk nationstäckande registerstudie har man påvisat en något ökad risk (ca två gånger) för cervixcancer bland kvinnliga IBD-patienter. Förmodligen kan riskökningen förklaras av att IBD-patienterna i större omfattning exponeras för immunmodulerande läkemedel. Man kan anta att den nyligen påbörjade allmänna HPV-vaccination på sikt kommer att leda till att den mindre överrisken för cervixcancer inom patientgruppen försvinner. De påvisade sambanden mellan immunmodulerande läkemedel och tumörsjukdomar vid IBD manar till reflektion avseende indikation och behandlingsduration. Samtidigt bör man ha i åtanke att den under de senaste decennierna kraftigt minskade incidensen av tjocktarmscancer hos IBD-patienter sammanfaller med ett ökat bruk av immunmodulerande läkemedel. För IBD-patienter med kronisk aktiv tarminflammation torde immunmodulerande behandling leda till en minskning av den absoluta risken för tjocktarmcancer som är betydligt större än ökningen av den absoluta risken för blod- och hudcancer. Sammantaget bedöms de nya rönen inte föranleda ändrade rekommendationer om när behandling med immunmodulerare bör inledas. Trots att studier på vuxna visat att samtidig behandling med anti-TNF och tiopuriner har bättre primär anti-inflammatorisk effekt och minskar risken för sekundär terapisvikt, kvarstår dock den pediatriska rekommendationen om att längre tids (> 6 mån) kombinationsbehandling bör undvikas om möjligt, särskilt hos pojkar och ynglingar. Då uppföljningsstudier talar för att inflammationsaktiviteten hos de flesta IBD-patienter avtar efter några års sjukdom bör möjligheten av att med tiden kunna minska eller sätta ut immunmodulerande läkemedel övervägas regelbundet hos patienter i stabil remission. Extraintestinala manifestationer Extraintestinala manifestationer uppträder hos cirka en tredjedel av patienter med IBD. Några av manifestationerna är tydligt relaterade till sjukdomsaktiviteten (t.ex. erytema nodosum, episklerit, perifer artrit, orofaciala lesioner) medan andra uppträder oberoende av sjukdomsaktivitet (t.ex. pyoderma gangrenosum, anterior uveit/irit, ankyloserande spondylit, sacroilit, primär skleroserande kolangit och autoimmun hepatit). Leder Artralgier engagerar fr.a. små leder vid en aktiv inflammation i tarmen. Artriter är ofta migrerande och asymmetriska och engagerar huvudsakligen nedre extremitetens stora leder. Vanligtvis är de inte deformerande. Ledinflammationen korrelerar väl med tarmens inflammationsaktivitet och lindras parallellt med att tarminflammationen går i remission. Detta gäller framför allt de oligoartikulära formerna. Den polyartikulära formen däremot tenderar att ge mer långvariga besvär. Ankyloserande spondylit Tillståndet är inte relaterat till den inflammatoriska aktiviteten i tarmen och brukar inte svara på medicinsk eller kirurgisk behandling av tarminflammationen. Ankyloserande spondylit är vanligast vid Crohns sjukdom. De flesta fall är HLA-B27 antigenpositiva. Sacroilit kan ses vid både Crohns sjukdom och ulcerös kolit. Den uppträder vanligen symmetriskt och är ofta asymptomatisk. OBS! NSAID-preparat som ofta används vid ledinflammation kan trigga tarminflammationen vid IBD. Till innehållsförteckning! 45 Hud Erytema nodosum förekommer främst vid Crohns sjukdom men även vid ulcerös kolit och anses vara associerad till kolonengagemang.. Pyoderma gangrenosum ses huvudsakligen vid ulcerös kolit. Tillståndet är inte korrelerat till den inflammatoriska tarmsjukdomens aktivitet och det kan ses flera år innan IBD är diagnostiserad och också flera år efter kolektomi hos patienter med ulcerös kolit. Orofacial granulomatos kan förekomma vid Crohns sjukdom. Denna kliniska bilden inkluderar bl.a. svullnad av läpparna och s.k. kullerstenslesioner i kindslemhinnan. Ögon Episklerit är den vanligast förekommande associerade ögonmanifestationen och ses främst vid Crohns sjukdom. Ofta är inflammationen mild och svarar bra på ögondroppar med steroider. Anterior uveit/irit kan ses både vid Crohns sjukdom och ulcerös kolit. Inflammationen har inget samband inflammationsaktiviteten i tarmen. Tillståndet kan utvecklas under remissionsperioder av tarmsjukdomen och efter kolektomi. Försämring av synen och ärr i iris kan uppträda. Lever och gallgångar Primär skleroserande kolangit (PSC) karakteriseras av multipla intrahepatiska och extrahepatiska gallgångsstrikturer. PSC är oberoende av tarmsjukdomens aktivitet. Tillståndet är vanligare vid ulcerös kolit än vid Crohns sjukdom. PSC är kopplat till en ökad risk för såväl gallgångs- som koloncancer. För närvarande finns ingen dokumenterad kurativ behandling. Behandling med ursodeoxycholsyra (Ursofalk) leder dock ofta till normalisering av leverprover, men man har ännu inte kunnat visa att denna medicinering leder till en bättre prognos på sikt. Autoimmun hepatit. Vid misstanke bör utredning ske skyndsamt då allvarlig leverpåverkan/leversvikt kan utvecklas på kort tid. Blandformer av autoimmun hepatit/PSC finns. Behandlas med steroider och/eller immunmodulerande terapi. Pankreas Akut pankreatit är ovanligt men kan förekomma vid såväl ulcerös kolit som Crohns sjukdom. Bakomliggande orsak kan också vara en läkemedelsbiverkan (t.ex. azatioprin, 5-ASA), eller en till grundsjukdomen associerad skleroserande kolangit. Tromboemboliska manifestationer Ökad koagulationsbenägenhet kan ses hos patienter med aktiv IBD; uppkommer till följd av trombocytos, högt fibrinogen, förhöjd faktor V och faktor VII samt sänkt antitrombin III. Detta kan leda till djupa ventromboser och lungemboli. Behandling med lågdos antitrombosmedel (Fragmin) kan övervägas hos riskpatienter vid t.ex. insättande av central venkateter, längre tids sängläge etc. För närvarande rekommenderas återhållsamhet med förskrivning av östrogeninnehållande p-piller till patienter med IBD, med tanke på risken för utveckling av trombos. Till innehållsförteckning! 46 Skelett – Låg bentäthet Låg bentäthet. Det föreligger en ökad risk för låg bentäthet vid IBD. Tillståndet synes något vanligare vid Crohns sjukdom än vid ulcerös kolit. Ökad risk är kopplad till hög sjukdomsaktivitet, malabsorption/malnutrition (lågt kalciumintag) samt steroidmedicinering. Bentätheten mäts med DEXA-teknik (dual energy x-ray absorptionmetry) och undersökning kan vara indicerad framför allt hos IBD-patienter med flera riskfaktorer. Tolkningsproblem kan uppstå då det saknas referensvärden för svenska barn; vid upprepad mätning kan patienten vara sin egen kontroll. Förebyggande/terapeutiska åtgärder: Behandla IBD d.v.s. minska inflammationsgraden, minimera steroidbehandlingen, kontrollera att kalkintaget är adekvat samt uppmuntra till fysisk aktivitet. Behandling/profylax med kalk och D-vitamintillskott kan övervägas enligt följande: Calcium 600-800 mg/dygn (rekommenderat intag för åldern) och vitamin D 400 IE/dygn. Tillväxt och IBD Tillväxtretardation och/eller försenad pubertet förekommer ofta vid IBD; vanligare vid Crohns sjukdom än vid ulcerös kolit. Tillväxtretardationen kan vara första symtomet vid pediatrisk IBD. Orsaksmekanismen är vanligen komplicerad: kombination av bristande kaloriintag (buksmärtor /anorexi), malabsorption, enterala förluster och den systemiska inflammationen per se. Åtgärder för att uppmärksamma och förhindra tillväxtavvikelse och försenad pubertet - Tillväxtkurvor rekvireras från BVC och skola. - Föräldralängden registreras och target height bestäms. - Längd, vikt och pubertetsutveckling registreras vid varje besök. Tillväxthastighet uträknas i cm/år. - Dietist bör träffa patienten i samband med första kontakten med sjukvården och planera för uppföljning - Nutritionell, farmakologisk och kirurgisk behandling kan var för sig eller i kombination leda till förbättrad tillväxt. - Vid uttalad tillväxtretardation bör barnendokrinolog konsulteras. Profylax och råd vid utlandsresa Profylax och råd sker självklart utifrån valt resmål. Råd ges om hur man undviker matvaror som kan tänkas ge gastroenterit samt råd om behandling med vätskeersättning (t.ex. Resorb brustabletter). En IBD-patient som trots allt blir infekterad riskerar skov. Patienten kan förses med antibiotika (ciprofloxacin) att inta i minst 3 (-5) dagar vid insjuknande i gastroenterit, särskilt om tarmsymtomen är kombinerade med feber, tenesmer och/eller blodiga diarréer. Vid resor i Asien är azitromycin i 3 dagar är att föredra. Behandling mot diarré med t.ex. loperamid skall ske med stor försiktighet, då medicineringen kan maskera alarmerande IBDsymtom och öka risken för utveckling av toxisk megakolon. Till innehållsförteckning! 47 Organisation av IBD-vården Allmänt om organisationen Vården av patienter med IBD kräver såväl en tillräcklig vana vid diagnosgruppen som ett samarbete inom ett IBD-team. Vården av barn med IBD inom ett geografiskt sjukvårdsområde bör ledas av en pediatriker med ”gastro-profil” och bör samlas på ett fåtal händer i ett multidisciplinärt team. Teamet måste ha ett tillräckligt antal patienter inom sitt område för att få erfarenhet och kompetens. Området får därför inte vara för litet. Är patientunderlaget litet rekommenderar vi samarbete med en näraliggande klinik eller ett större centrum. Specifika komplicerade medicinska och kirurgiska frågeställningar kan kräva samarbete med region- eller rikscentrum samt med vuxeninriktade specialister. IBD-teamets sammansättning, arbete och resurser Teammedlemmar: pediatriker med gastroenterologisk profil, gastro-/nutritionssköterska, barndietist och kurator/psykolog/barnpsykiatriker. Teamet bör ha regelbundna träffar för genomgång av patienter och erfarenhetsutbyte. Teamets organisation och arbetssätt bör vara så att patienten: - möter de delar av teamet hon/han har behov av vid sitt besök - vid skov snabbt får kontakt med teamets medlemmar för telefonrådgivning, mottagningsbesök, provtagning och/eller endoskopi efter behov. - känner trygghet och kontinuitet och får ett fullgott omhändertagande även om delar av teamet ej är i tjänst. Övriga resurser Tillgång till: Sjukhusets endoskopienhet med dess personal och instrument Pediatriska endoskop som komplement till vuxenendoskop Tarmkirurg Anestesiteam för narkos vid endoskopier Regelbundna konferenser med tarmkirurg, barn- och vuxengastroenterolog samt tarmpatolog Radiologavdelning Intensivvårdsavdelning förtrogen med barn Barnpsykiatriskt team inriktat mot psykosomatik och barn med svår kronisk sjukdom Utbildning Klinikens teammedlemmar måste få möjlighet att varje år delta i nationella och/eller internationella seminarier, kongresser samt medverka i nationella nätverk som berör patientgruppen. Tid skall avsättas för utbildning och vidareutbildning av all personal som kommer i kontakt med IBD-patienter. Resurser skall finnas för utbildning av primärvårdens läkare och läkare ansvariga för den kirurgiska akutvården av barn för att skapa förutsättningar för ett snabbt och rationellt omhändertagande vid symtomdebut. Till innehållsförteckning! 48 IBD-register Ett register bör finnas över områdets samtliga IBD-patienter. Förutom att vara ett verktyg i hanteringen av de enskilda patienterna och därmed underlätta vården, bör registret kunna utnyttjas i kvalitetssäkringsarbete. Det kan även vara ett redskap för epidemiologiska och andra studier. Vi rekommenderar att alla kliniker i landet registrerar sina patienter i det svenska nationella kvalitetsregistret för inflammatorisk tarmsjukdom (SWIBREG). Registret startade 2005 och är gemensamt för barn och vuxna. Det är uppbyggt i nivåer med en del specialdesignad för pediatrikens behov. Registrets hemsida - https://realq.sjunet.org/IBD kan bara nås via landstingsanslutna datorer. Till innehållsförteckning! 49 Referenser Epidemiologi Benchimol EI, Fortinsky KJ, Gozdyra P, Van den Heuvel M, Van Limbergen J, Griffiths AM. Epidemiology of pediatric inflammatory bowel disease: a systematic review of international trends. Inflamm Bowel Dis. 2011;17(1):423-39. Büsch K, Ludvigsson JF, Ekström-Smedby K, Ekbom A, Askling J, Neovius M. Nationwide prevalence of inflammatory bowel disease in Sweden: a population-based register study. Aliment Pharmacol Ther. 2014;39(1):57-68. Malmborg P, Grahnquist L, Lindholm J, Montgomery S, Hildebrand H. Increasing incidence of paediatric inflammatory bowel disease in northern Stockholm County 2002-2007. J Pediatr Gastroenterol Nutr. 2013;57(1):29-34. Sjöberg D, Holmström T, Larsson M, Nielsen AL, Holmquist L, Ekbom A, Rönnblom A. Incidence and natural history of ulcerative colitis in the Uppsala Region of Sweden 20052009 - Results from the IBD Cohort of the Uppsala Region (ICURE). J Crohns Colitis. 2013;7(9): 351-7. Etiologi och patogenes Bach JF. The effect of infections on suspectibility to autoimmune and allergic diseases. New Engl J Med. 2002; 347:911-920. Review. Hugot JP, Chamaillard M, Zouali H, Lesage S, Cezard JP, Belaiche J, et al. Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn's disease. Nature. 2001;411:599-603. Lees CW, Barrett JC, Parkes M, Satsangi J. New IBD genetics: common pathways with other diseases. Gut. 2011;60(12):1739-53. Tysk C, Lindberg E, Järnerot G, Floderus-Myrhed B. Ulcerative colitis and Crohn's disease in an unselected population of monozygotic and dizygotic twins. A study of heritability and the influence of smoking. Gut 1988;29:990-6. Diagnostik och klassificering Fagerberg UL, Lööf L, Myrdal U, Hansson LO, Finkel Y. Colorectal inflammation is well predicted by fecal calprotectin in children with gastrointestinal symptoms. J Pediatr Gastroenterol Nutr. 2005;40;450-5. Levine A, Koletzko S, Turner D, Escher JC, Cucchiara S, de Ridder L, Kolho KL, Veres G, Rusell RK, Paerregaard A, Buderus S, Greer ML, Greer ML, Dias JA, Veereman-Wauters G, Lionetti P, Sladek M, Martin de Carpi J, Staiano A, Ruemmele FM, Wilson DC. The ESPGHAN revised Porto criteria for the diagnosis of inflammatory bowel disease in children and adolescents: J Pediatr Gastroenterol Nutr. 2013;58(6):795-806. Till innehållsförteckning! 50 Magro F, Langner C, Driessen A, Ensari A, Geboes K, Mantzaris GJ, Villanacci V, Becheau G, Borralho Nunes P, Cathomas G, Fries W, Jouret-Mourin A, Mescoli C, de Petris G, Rubio CA, Shepherd NA, Vieth M, Eliakim R; European Societu of Pathology (ESP); European Crohn´s and Colitis Organisation (ECCO). European consensus on the histopathology of inflammatory bowel disease. J Crohn´s Colitis. 2013;7(10):827–51. Malmborg P, Grahnquist L, Ideström M, Lindholm J, Befrits R, Björk J, Montgomery S, Hildebrand H. Presentation and progression of childhood-onset inflammatory bowel disease in northern Stockholm county. Inflamm Bowel Dis.2015;21(5):1098-108. Ruemmele FM, Turner D. Differences in the management of pediatric and adult onset ulcerative colitis — lessons from the joint ECCO and ESPGHAN consensus guidelines for the management of pediatric ulcerative colitis. J Crohn´s Colitis. 2014;8(1):1–4. Turner D, Levine A, Escher JC, Griffiths AM, Russell RK, Dignass A, Dias JA, Bronsky J, Braegger CP, Cucchiara S, de Ridder L, Fagerberg UL, Hussey S, Hugot JP, Kolacek S, Kolho KL, Lionetti P, Paerregard A, Potapov A, Ritala R, Serban DE, Staiano A, Sweeny B, Veerman G, Veres G, Wilson DC, Ruemmele FM; European Society for Paediatric Gastroenterology, Hepatology, and Nutrition. Management of pediatric ulcerative colitis: Joint ECCO and ESPGHAN evidence-based consensus guidelines. J Pediatr Gastroenterol. 2012;55(3):340–61. Uhlig HH, Schwerd T, Koletzko S, Shah N, Kammermeier J, Elkadri A, Ouahed J, Wilson DC, Travis SP, Turner D, Klein C, Snapper SB, Muise AM; COLORS in IBD Study Group and NEOPICS. The diagnostic approach to monogenic very early onset inflammatory bowel disease. Gastroenterology. 2014;147(5):990-1007. Waugh N, Cummins E, Royle P, Kandala N-B, Shyangdan D, Arasaradnam R, Clar C, Johnston R. Faecal calprotectin testing for differentiating amongst inflammatory and noninflammatory bowel diseases: systematic review and economic evaluation. Health Technol Assess. 2013;17(55):1–211. Bedömning av sjukdomsaktivitet Harvey RF, Bradshaw JM. A simple index of Crohn's-disease activity. Lancet. 1980; 8;1(8167):514. Hjortswang H, Järnerot G, Curman B, Sandberg-Gertzen H, Tysk C, Blomberg B, Almer S, Ström M. The Short Health Scale: a valid measure of subjective health in ulcerative colitis. Scand J Gastroenterol. 2006 Oct;41(10):1196-203. Hyams JS, Ferry GD, Mandel FS, Gryboski JD, Kibort PM, Kirschner BS, et al. Development and validation of a pediatric Crohn's disease activity index. J Pediatr Gastroenterol Nutr. 1991;12:439-47. Otley A, Loonen H, Parekh N, Corey M, Sherman PM, Griffiths AM. Assessing activity of pediatric Crohn's disease: which index to use? Gastroenterology. 1999;116:527-31. Till innehållsförteckning! 51 Stjernman H, Grännö C, Järnerot G, Ockander L, Tysk C, Blomberg B, et al. Short health scale: a valid, reliable, and responsive instrument for subjective health assessment in Crohn's disease. Inflamm Bowel Dis. 2008; 14(1):47-52. Truelove SC WL. Cortisone in ulcerative colitis: final report on a therpeutic trial. Br Med J. 1955; 2:1041-1048. Turner D, Griffith AM, Walters TD, Seah T, Markowitz J, Pfefferkorn M, Keljo D, Waxman J, Otley A, LeLeiko NS, Mack D, Hyams J, Levine A.. Mathematical Weighting of the pediatric Crohn´s disease activity index (PCDAI) and comparison with its other short versions. Inflamm Bowel Dis. 2012;18:55-62. Turner D, Otley AR, Mack D, Hyams J, de Bruijne J, Uusoue K, et al. Development, Validation, and Evaluation of a Pediatric Ulcerative Colitis Activity Index: A Prospective Multicenter Study. Gastroenterology. 2007; 133(2):423-32. Wright JG, Feinstein AR. A comparative contrast of clinimetric and psychometric methods for constructing indexes and rating scales. J Clin Epidemiol. 1992; 45(11):1201-18. 1998; 43(1):29-32. Farmakologisk behandling - översikt Escher JC, Taminiau JA, Nieuwenhuis EE, Buller HA, Grand RJ. Treatment of inflammatory bowel disease in childhood: best available evidence. Inflamm Bowel Disease. 2003;9(1):3458. Review. Ruemmele FM, Veres G, Kolho KL, Griffiths A, Levine A, Escher JC,Amil Dias J, Barabino A,Braegger CP, Bronsky J, Buderus S, Martin-de-Carpi J, De ridder L, Fagerberg UL, Hugot JP, Kierkus J, Kolacek S, Koletzko S, Lionetti P, Miele E, Navas Lopez VM, Paerregard A, Rusell RK, Seban DE, Shaoul R, Van Rheenen P, Veereman G, Weiss B, Wilson D, Diagnass A, Eliakim A, Winter H, Turner D; ECCO/ESPGHAN.. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease. J Crohns Colitis. J Crohn´s Colitis. 2014;8(10):1179-207. Turner D, Levine A, Griffiths AM, Russell RK, Dignass A, Dias JA, , Braegger CP, Cucchiara S, , Fagerberg UL, Hussey S, Hugot JP, Kolacek S, Kolho KL, Lionetti P, Pærregaard A, Potapov A, Rintala R, Serban DE, Staiano A, Sweeny B, Veerman G, Veres G, Wilson DC, Ruemmele FM. Management of Pediatric Ulcerative Colitis: Joint ECCO and ESPGHAN Evidence-based Consensus Guidelines. J Pediatr Gastroenterol Nutr. 2012;55(3):340-361. Wilson D, Thomas A, Croft N, Newby E, Akobeng A, Sawczenko A, Fell J, Murphy M, Beattie R, Sandhu B, Mitton S; and the IBD working group of the British Society of Paediatric Gastroenterology, Hepatology and Nutrition. Systematic review of the evidence base for the medical treatment of paediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2010;50:14-34. Till innehållsförteckning! 52 5-ASA-preparat Griffiths A, Koletzko S, Sylvester F, Marcon M, Sherman P. Slow-release 5-aminosalicylic acid therapy in children with small intestinal Crohn's disease. J Pediatr Gastroenterol Nutr 1993;17:186-92. Hedlin A, Ehrsson H, Eksborg S, Finkel Y, Hildebrand H, Lidehall AK. 5-ASA preparat till barn med Crohns sjukdom. Läkartidningen. 2001; 98:4343-6. Steroid-preparat Escher JC. Budesonide versus prednisolone for the treatment of active Crohn's disease in children: a randomized, double-blind, controlled, multicentre trial. Eur J Gastroenterol Hepatol. 2004; 16:47-54. Hyams JS, Carey DE. Corticosteroids and growth. J Pediatr. 1988;113:249-54. Kundhal P, Zachos M, Holmes JL, Griffiths AM. Controlled ileal release budesonide in pediatric Crohn disease: efficacy and effect on growth. J Pediatr Gastroenterol Nutr. 2001;33:75-80. Löfberg R, Ostergaard Thomsen O, Langholz E, Schioler R, Danielsson A, Suhr O, et al. Budesonide versus prednisolone retention enemas in active distal ulcerative colitis. Aliment Pharmacol Ther. 1994;8:623-9. Otley A, Steinhart AH. Budesonide for induction of remission in Crohn's disease. Cochrane Database Syst Rev. 2005;(4). Steinhart AH, Ewe K, Griffiths AM, Modigliani R, Thomsen OO. Corticosteroids for maintenance of remission in Crohn's disease. Cochrane Database Syst Rev. 2003;(4). Antibiotika-preparat Greenbloom SL, Steinhart AH, Greenberg GR. Combination ciprofloxacin and metronidazole for active Crohn's disease. Can J Gastroenterol. 1998;12:53-6. Markowitz J, Daum F, Aiges H, Kahn E, Silverberg M, Fisher SE. Perianal disease in children and adolescents with Crohn's disease. Gastroenterology. 1984;86:829-33. Turunen UM, Farkkila MA, Hakala K, Seppala K, Sivonen A, Ogren M, et al. Long-term treatment of ulcerative colitis with ciprofloxacin: a prospective, double-blind, placebocontrolled study. Gastroenterology. 1998;115:1072-8. Azatioprin Benkov K, Lu Y, Patel A, Rahhal R, Russell G, Teitelbaum J; NASPGHAN Committee on Inflammatory Bowel Disease. Role of thiopurine metabolite testing and thiopurine methyltransferase determination in pediatric IBD.J Pediatr Gastroenterol Nutr. 2013;56(3):333-40. Till innehållsförteckning! 53 Hindorf U, Johansson M, Eriksson A, Kvifors E, Almer S. Mercaptopurin treatment should be considered in azathioprine intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008;29:654-61. Hindorf U, Lindqvist M, Hildebrand H, Fagerberg U, Almer S. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006;24:331-42. Markowitz J, Grancher K, Kohn N, Lesser M, Daum F. A multicenter trial of 6mercaptopurine and prednisone in children with newly diagnosed Crohn's disease. Gastroenterology 2000;119:895-902. Metotrexate Alfadhli AAF, McDonald JWD, Feagan BG. Methotrexate for induction of remission in refractory Crohn´s disease. The Cochrane Library 2009, Issue 1. (Review). Chande N, Mac Donald JK, McDonald JWD. Methotrexate for induction of remission in ulcerative colitis. The Cochrane Library 2008, Issue 3. (Review). Dignass A, Van Asche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF, Danese A, D´Hoore M, Gassul F, Gomollon F, Hommes DW, Michetti P, T O´Morain, Öresland T, Windsor A, Stange EF, Travis SPL for European Crohn´s and Colitis organisation (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn´s disease: Currrent management. Journal of Crohn´s and Colitis. 2010;4:28-62. El-Matary W, Vandermeer B, Griffith AM. Methotrexate for maintenance of remission in ulcerative colitis. The Cochrane Library 2009, Issue 4. (Review). Mack DR, Young R, Kaufman SS, Ramey L, Vanderhoof JA. Methotrexate in patients with Crohn´s disease after 6-mercaptopurin. J Pediatr. 1998; 132(5):830-5. Patel V, MacDonald JK, McDonald JWD, Chande N. Methotrexate for maintainance of remission in Crohn´s disease The Cochrane Library 2009, Issue 4. (Review). Ravikumara M, Hinsberger A, Spray CH. Role of methotrexate in the management of Crohn´s disease. J Pediatr gastroenterol Nutr. 2007; 44(4):427-430. Turner D, Grossman AB, Rosh J, Kugathasan S, Gilman AR, Baldassano R, Griffith AM. Methotrexate following unsuccessful tiopurine therapy in pediatric Crohn´s disease. American Journal of gastroenterology. 2007;102:2804-2812. Uhlen S, Belbouab R, Narebski K, Goulet O, Schmitz J, Cezard JP et al. Efficacy of methotrexate in pediatric Crohn's disease: a French multicenter study. Inflamm Bowel Dis. 2006;12:1053-7. Biologiska läkemedel de Bie CI, Escher JC, de Ridder L. Antitumor Necrosis Factor treatment for pediatric inflammatory bowel disease. Inflam Bowel Dis. 2012;18:981-998. Till innehållsförteckning! 54 Hyams J, Crandall W, Kugathasan S, Griffiths A, Olson A, Johanns J, Liu G, Travers S, Heuschkel R, Markoewitz J, Cohen S, Winter H, Veereman-Wauters G, Ferry G, Baldassano R; REACH Study Group. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn’s disease in children.Gastroenterology. 2007;132:863-73. Hyams J, Damaraju L, Blank M, Johanns J, Guzzo C, Winter HS, Kugathasan S, Cohen S, Markowitz J, Escher JC, Veereman-Wauters G, Crandall W, Baldassano R, Griffiths A; T72 Study Group. Induction and maintenance therapy with infliximab for children with moderate to severe ulcerative colitis. Clin Gastroenterol Hepatol. 2012;10(4):391-9. Hyams JS, Griffiths A, Markowitz J, Baldassano RN, Faubion WA Jr, Colletti RB, Dubinsky M, Kierkus J, Rosh J, Wang Y, Huang B, Bittle B, Marshall M, Lazar A. Safety and efficacy of adalimumab for moderate to severe Crohn's disease in children. Gastroenterology. 2012;143(2):365-74. Peyrin-Biroulet L, Laclotte C, Bigard MA. Adalimumab maintenance therapy for Crohn's disease with intolerance or lost response to infliximab: an open-label study. Aliment Pharmacol Ther. 2007;25(6):675-80. Ruemmele FM, Lachaux A, Cesard JP, Morali A, Maurage C, Ginies JL, Viola S, Goulet O, Lamireau T, Scallon M, Breton A, Sarles J. Efficacy of Infliximab in pediatric Crohn´s disease: A randomized multicenter open-label trial comparing scheduled to on demand maintenance therapy. Inflamm Bowel Dis. 2009; 15:388-394. Nutritionsbehandling Critch J, Day AS, Otley A, King-Moore C, Teitelbaum JE, Shashidhar H; NASPGHAN IBD Committee. User of enteral nutrition for the control of intestinal inflammation in pediatric Crohn disease. J Pediatr Gastroenterol Nutr. 2012;54: 298-305. Fell JM, Paintin M, Arnaud-Battandier F, Beattie RM, Hollis A, Kitching P, Donnet-Hughes A, MacDonald TT, Walker-Smith JA. Mucosal healing and a fall in mucosal proinflammatory cytokine mRNA induced by a specific oral polymeric diet in paediatric Crohn's disease. Aliment Pharmacol Ther. 2000;14:281-9. Gråfors JM, Casswall TH. Exclusive enteral nutrition in the treatment of children with Crohn´s disease in Sweden: a questiooaire survey. Acta Paediatr. 2011;100(7):1018-22. Heuschkel RB, Menache CC, Megerian JT, Baird AE. Enteral nutrition and corticosteroids in the treatment of acute Crohn's disease in children. J Pediatr Gastroenterol Nutr. 2000; 31:815. Johnsson T, MacDonald S, Hill SM, Thomas A, Murphy MS. Treatment of active Crohn´s disease in children using partial enteral nutrition with liquid formula; a randomised controlled trial. Gut. 2006; 55:356-61. Till innehållsförteckning! 55 Ludvigsson JF, Krantz M, Bodin L, Stenhammar L, Lindquist B. Elemental versus polymeric enteral nutrition in paediatric Crohn's disease: a multicentre randomized controlled trial. Acta Paediatr. 2004; 93:327-35. Sullivan M, O'Morain C. Liquid diets for Crohn's disease. Gut. 2001; 48:757. Whitten KE, Rogers P, Ooi CY, Day AS. International survey of enteral nutrition protocols used in children with Crohn´s disease. Journal of Digestive Diseases. 2012;13:107-112. Zachos M, Tondeur M, Griffiths AM. Enteral nutritional therapy for induction of remission in Crohn's disease. Cochrane Database Syst Rev. 2007;(1). Kirurgisk behandling Da Luz Moreira A, Kiran RP, Lavery I. Clinical outcomes of ileorectal anastomosis for ulcerative colitis. Br J Surg. 2010;97:65-69. Falcone RA, Jr., Lewis LG, Warner BW. Predicting the need for colectomy in pediatric patients with ulcerative colitis. J Gastrointest Surg. 2000;4:201-6. Fonkalsrud EW, Thakur A, Beanes S. Ileoanal pouch procedures in children. J Pediatr Surg. 2001; 36(11):1689-92. Mahajan L, Oliva L, Wyllie R, Fazio V, Steffen R, Kay M. The safety of gastrostomy in patients with Crohn's disease. Am J Gastroenterol. 1997;92:985-8. Mattioli G, Pini-Prato A, Barabino A, et al. Laparoscopic approach for children with inflammatory bowel diseases. Pediatr Surg Int. 2011;27:839-846. Pakarinen MP, Matunene J, Ashorn M, Koivusalo A, Turunen P, Rintala RJ, Kolho KL. Long-term outcomes of restorative proctocolectomy in children with ulcerative colitis. Pediatrics. 2009;123:1377-1382. Patel HI, Leichtner AM, Colodny AH, Shamberger RC. Surgery for Crohn's disease in infants and children. J Pediatr Surg. 1997;32:1063-7; discussion 1067-8. Rintala RJ, Lindahl HG. Proctocolectomy and J-pouch ileo-anal anastomosis in children. J Pediatr Surg. 2002;37:66-70. Seetharamaiah R, Wester BT, Ignash J, Pakarinen MP, Koivusalo A, Rintala RJ, Liu DC, Spencer AU, Skipton K, Geiger JD, Hirschi RB, Coran AG, Teitelbaum DH. Outcomes in pediatric patients undergoing straight vs J pouch ileoanal anastomosis: a multicenter analysis. J Pediatr Surg. 2009:44;1420-1417. Tilney HS, Constantinides V, Ioannides AS, Tekkis PP, Darzi AW, Haddad MJ. Pouch-anal anastomosis vs straight ileoanal anastomosis in pediatric patients: a meta-analysis. J Pediatr Surg. 2006;41:1799-1808. Tolia V. Perianal Crohn's disease in children and adolescents. Am J Gastroenterol. 1996;91:922-6. Till innehållsförteckning! 56 Turner D, Levine A, , Griffiths AM, Russell RK, Dignass A, Dias JA, Bronsky J, Braegger CP, Cucchiara S, de Ridder L, Fagerberg UL, Hussey S, Hugot JP, Kolacek S, Kolho KL, Lionetti P, Pærregaard A, Potapov A, Rintala R, Serban DE, Staiano A, Sweeny B, Veerman G, Veres G, Wilson DC, Ruemmele FM. Management of Pediatric Ulcerative Colitis: Joint ECCO and ESPGHAN Evidence-based Consensus Guidelines. J Pediatr Gastroenterol Nutr. 2012;55(3):340-361. Waljee A, Waljee J, Morris AM, Higgins PD. Threefold increased risk of infertility: a metaanalysis of infertility after ileal pouch anal anastomosis in ulcerative colitis. Gut. 2006;55:1575-1580. Wu X-J, He X-S, Zhou X-Y, Zhou XY, Ke J, Lan P. The role of laparoscopic surgery for ulcerative colitis: systematic review with meta-analysis. Int J Colorectal Dis. 2010;25:949957. Handläggning av akut svår kolit Turner D, Otley AR, Mack D, Hyams J, de Bruijne J, Uusoue K, Walters TD, Zachos M, Mamula P, Beaton DE, Steinhart AH, Griffiths AM. Development, Validation, and Evaluation of a Pediatric Ulcerative Colitis Activity Index: A Prospective Multicenter Study. 2007;133(2):423-32. Turner D, Travis SP, Griffiths AM, Ruemmele FM, Levine A, Benchimol EI, Dubinsky M, Alex G, Baldassano RN, Langer JC, Shamberger R, Hyams JS, Cucchiara S, Bousvaros A, Escher JC, Markowitz J, Wilson DC, van Assche G, Russell RK. Consensus for Managing Acute Severe Ulcerative Colitis in Children: A Systematic Review and Joint Statement from ECCO, ESPGHAN, and the Porto IBD Working Group of ESPGHAN. Am J Gastroenterol. 2011.106(4):574-88. Tysk C, Almer S, Andersson MV, Befrits R, Hertevig E, Kilander A, Lindgren S, Suhr O. Management of severe attack of ulcerative colitis. Läkartidningen. 2009 4-12;106(45):2994-8. Malignitetsrisk vid immunmodulerande läkemedelsbehandling Ariyaratnam J, Subramanian V. Association between thiopurine use and nonmelanoma skin cancers in patients with inflammatory bowel disease: a meta-analysis. Am J Gastroenterol. 2014;109(2):163-9. Ashworth LA, Billett A, Mitchell P, Nuti F, Siegel C, Bousvaros A. Lymphoma risk in children and young adults with inflammatory bowel disease: analysis of a large single-center cohort. Inflamm Bowel Dis. 2012;18(5):838-43. Cucchiara S, Escher JC, Hildebrand H, Amil-Dias J, Stronati L, Ruemmele FM. Pediatric inflammatory bowel diseases and the risk of lymphoma: should we revise our treatment strategies? J Pediatr Gastroenterol Nutr. 2009;48(3):257-67. Kotlyar DS, Lewis JD, Beaugerie L, Tierney A, Brensinger CM, Gisbert JP, Loftus EV Jr, Peyrin-Biroulet L, Blonski WC, Van Domselaar M, Chaparro M,Sandilya S, Bewtra M. Till innehållsförteckning! 57 Beigel F, Biancone L, Lichtenstein GR. Risk of Lymphoma in Patients With Inflammatory Bowel Disease Treated With Azathioprine and 6-Mercaptopurine: A Meta-analysis. Clin Gastroenterol Hepatol. 2014 May 28. pii: S1542-3565(14)00767-8. doi: 10.1016/j.cgh.2014.05.015. [Epub ahead of print]. Kotlyar DS, Osterman MT, Diamond RH, Porter D, Blonski WC, Wasik M, Sampat S, Mendizabal M, Lin MV, Lichtenstein GR. A systematic review of factors that contribute to hepatosplenic T-cell lymphoma in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol. 2011;9(1):36-41. Osterman MT, Sandborn WJ, Colombel JF, Robinson AM, Lau W, Huang B, Pollack PF, Thakkar RB, Lewis JD. Increased risk of malignancy with adalimumab combination therapy, compared with monotherapy, for Crohn's disease.Gastroenterology.2014;146(4):9419. Rungoe C, Simonsen J, Riis L, Frisch M, Langholz E, Jess T. Inflammatory Bowel Disease and Cervical Neoplasia: A Population-Based Nationwide Cohort Study. Clin Gastroenterol Hepatol. 2015;13(4):693-700. Psykosocialt stöd Engström I. Inflammatory bowel disease in children and adolescents: mental health and family functioning. J Pediatr Gastroenterol Nutr. 1999;28:S28-33. Griffiths AM, Nicholas D, Smith C, Munk M, Stephens D, Durno C, Sherman PM. Development of a quality-of-life index for pediatric inflammatory bowel disease: dealing with differences related to age and IBD type. J Pediatr Gastroenterol Nutr. 1999;28:S46-52. Lindfred H, Saalman R, Nilsson S, Reichenberg K. Inflammatory bowel disease and selfesteem in adolescence. Acta Paediatr. 2008;97(2):201-5. Loonen HJ, Grootenhuis MA, Last BF, Koopman HM, Derkx HH. Quality of life in paediatric inflammatory bowel disease measured by a generic and a disease-specific questionnaire. Acta Paediatr. 2002;91:348-54. Tillväxt och IBD Griffiths AM, Nguyen P, Smith C, MacMillan JH, Sherman PM. Growth and clinical course of children with Crohn's disease. Gut. 1993; 34:939-43. Hildebrand H, Karlberg J, Kristiansson B. Longitudinal growth in children and adolescents with inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 1994;18:165-73. Kirschner BS. Permanent growth failure in pediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr 1993; 16:368-9. Schmidt S, Mellström D, Norjavaara E, Sundh SV, Saalman R. Low bone mineral density in children and adolescents with inflammatory bowel disease: A population-based study from Western Sweden. Inflamm Bowel Dis. 2009;15(12):1844-1850. Till innehållsförteckning! 58 Sentongo TA, Stettler N, Christian A, Han PD, Stallings VA, Baldassano RN. Growth after intestinal resection for Crohn's disease in children, adolescents, and young adults. Inflamm Bowel Dis. 2000; 6:265-9. 59 Medarbetare som arbetat med det aktuella vårdprogrammet Robert Saalman Sektionen för gastroenterologi, hepatologi och nutrition Drottning Silvias barn- och ungdomssjukhus 416 85 Göteborg e-mail. [email protected] Ulrika Fagerberg Barn- och ungdomsmedicin Centrallasarettet 721 89 Västerås e-mail. [email protected] Torbjörn Lind Barnkliniken Norrlands Universitetssjukhus, Umeå e-mail. [email protected] Petter Malmborg Sektionen för pediatrisk gastroenterologi och nutrition, Solna Astrid Lindgrens Barnsjukhus, Karolinska Universitetssjukhuset 171 76 Stockholm e-mail. [email protected] Gun Persson Barn- och ungdomsmedicin Helsingborgs lasarett 251 87 Helsingborg e-mail [email protected] Tomas Wester Barnkirurgiska kliniken Astrid Lindgrens Barnsjukhus, Karolinska Universitetssjukhuset 171 76 Stockholm e-mail. [email protected] Tidigare medarbetare i vårdprogramgruppen som bidragit till det aktuella vårdprogrammet: Mats Edenholm Hans Hildebrand Urban Myrdal Jan Neiderud Lars Stenhammar Johan Svahn Eva Lindberg Adress till webmaster: Mats Eriksson e-mail. [email protected]