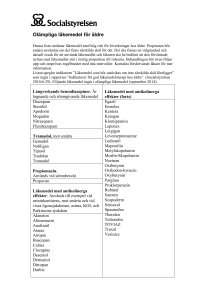
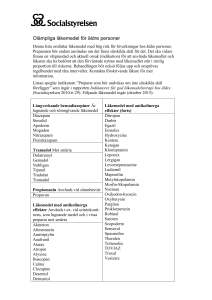
SI/SR Template
advertisement

1. ------IND- 2016 0162 UK- SV- ------ 20160420 --- --- PROJET LAGINSTRUMENT 2016, nr 000 LÄKEMEDEL 2016 års förordning om humanläkemedel (ändring) (nr 2) Utfärdad den - - - - 2016 Framlagd för parlamentet den Träder i kraft - - 2016 den 1 oktober 2016 INNEHÅLL 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Hänvisning, ikraftträdande och tolkning Ändring av föreskrift 3 i 2012 års förordning Upphävande av föreskrift 4 i 2012 års förordning Nya föreskrifter 4A till 4C i 2012 års förordning Ändring av föreskrift 8 i 2012 års förordning Ändring av föreskrift 18 i 2012 års förordning Ändring av föreskrift 46 i 2012 års förordning Ny föreskrift 234A i 2012 års förordning Ändring av föreskrift 258 i 2012 års förordning Ny föreskrift 258A i 2012 års förordning Ändring av föreskrift 269 i 2012 års förordning Ny föreskrift 269A i 2012 års förordning Ändring av föreskrift 368 i 2012 års förordning Ändring av bilaga 25 till 2012 års förordning Ändring av bilaga 26 till 2012 års förordning Upphävande av avsnitten 10 och 15 i 1968 års läkemedelslag Ändring av avsnitt 69 i 1968 års läkemedelslag Statssekreteraren och ministern för hälsa, socialtjänst och allmänhetens säkerhet utfärdar följande förordning i kraft av de befogenheter som tilldelas genom avsnitt 2.2 och 2.5 i 1972 års lag om Europeiska gemenskaperna (a). Förordningen har utformats i enlighet med avsnitt 2.2 i nämnda lag avseende läkemedel(b). (a) 1972 kap. 68. Avsnitt 2.2 ändrades genom avsnitt 27.1 a i 2006 års lag om lagstiftnings- och regleringsreformer (kap. 51) och genom avsnitt 3.3 och del 1 i bilagan till 2008 års lag om Europeiska unionen (ändring) (kap. 7). Avsnitt 2.5 ändrades genom avsnitt 41.1 och del 1 i bilaga 6 till 1973 års lag om konstitution för Nordirland (kap. 36). (b) S.I. 1972/1811. Hänvisning, ikraftträdande och tolkning 1.(1) Denna förordning har benämningen 2016 års förordning om humanläkemedel (ändring) (nr 2) och träder i kraft den 1 oktober 2016. (2) I denna förordning avses med 2012 års förordning 2012 års förordning om humanläkemedel(a). Ändring av föreskrift 3 i 2012 års förordning 2.(1) Föreskrift 3 i 2012 års förordning (förordningens tillämpningsområde: särskilda bestämmelser) ändras enligt följande: (2) Punkt 9 ska ersättas med följande: “(9) Detta villkor är (a) när det gäller sammansättning, att sammansättningsprocessen varken är en industriell beredning av ett läkemedel eller tillverkning av ett läkemedel genom en metod som inbegriper en industriell process, eller (b) när det gäller tillverkning, att det läkemedel som framställs vid denna tillverkningsprocess varken bereds industriellt eller tillverkas genom en metod som inbegriper en industriell process.”. (3) I punkt 10 (a) ska texten ”eller 12” utgå, (b) ska texten från ”, utom i den” till ”ska tillämpas” utgå. (4) I punkt 11 (a) ska ”eller sammansättning” infogas efter ”tillverkning”, (b) ska texten ”5 eller” utgå. (5) Efter punkt 11 ska följande punkter infogas: “ (11A) Om inte annat följer av punkt 11B är kapitel 1 i del 13, bortsett från föreskrifterna 258A, 269, 269A och 271, inte tillämpligt när det gäller försäljning eller leverans, eller ett erbjudande om försäljning eller leverans, av ett läkemedel som (a) har sammansatts i enlighet med punkt 4, eller (b) har tillverkats eller sammansatts i enlighet med punkt 5. (11B) Punkt 11A är inte tillämplig när det gäller ett läkemedel som har sammansatts i enlighet med punkt 4 eller 5, om den enda genomförda sammansättningsprocessen (a) har genomförts med avseende på ett godkänt läkemedel, (b) inte innebär någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen. (6) Punkterna 12 till 14 ska utgå. (7) I punkt 15 (a) ska texten ”och föreskrift 4 (särskilda bestämmelser för apotek etc.),” ersättas med ”och föreskrifterna 4A och 4C,”, och (b) efter led a ska följande infogas: “(aa) en licens för parallellimport,”. (a) S.I. 2012/1916. 2 Upphävande av föreskrift 4 i 2012 års förordning 3. Föreskrift 4 i 2012 års förordning (särskilda bestämmelser för apotek etc.) upphävs. Nya föreskrifter 4A till 4C i 2012 års förordning 4. Före föreskrift 5 i 2012 års förordning (klassificering av läkemedel) ska följande infogas: “Farmaceuter: särskilda bestämmelser med avseende på artikel 2 i 2001 års direktiv 4A. (1) Föreskrift 17.1 är inte tillämplig när det gäller sammansättning i en godkänd klinisk miljö av ett läkemedel som sammansätts (a) för distribution vid eller från en godkänd klinisk miljö av eller under tillsyn av en farmaceut, och (b) för försäljning eller leverans i enlighet med ett recept eller en anvisning som har utfärdats av sjukvårdspersonal eller i enlighet med en anvisning för en patientgrupp. (2) Om inte annat följer av punkt 3 är föreskrift 46 inte tillämplig när det gäller (a) distribution vid eller från en godkänd klinisk miljö av ett läkemedel som (i) sammansattes i en godkänd klinisk miljö i enlighet med punkt 1, och (ii) distribueras till en enskild patient av eller under tillsyn av en farmaceut, eller (b) försäljning eller leverans av läkemedlet i enlighet med (i) det recept eller den anvisning som har utfärdats av sjukvårdspersonal, eller (ii) den anvisning som har utfärdats för en patientgrupp, i enlighet med vilka läkemedlet distribuerades. (3) Punkt 2 är inte tillämplig när det gäller ett läkemedel som har sammansatts i enlighet med punkt 2 a i, om den enda genomförda sammansättningsprocessen (a) har genomförts med avseende på ett godkänt läkemedel, (b) inte innebär någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen. (4) Föreskrift 17.1 är inte tillämplig när det gäller beredning vid ett registrerat apotek, av eller under tillsyn av en farmaceut, av ett läkemedel i enlighet med en specifikation som har tillhandahållits av den person (P1) till vilken läkemedlet ska säljas eller levereras om läkemedlet bereds för administrering till P1 eller till en person i P1:s vård. (5) Föreskrift 46 är inte tillämplig när det gäller (a) distribution vid eller från ett registrerat apotek av ett läkemedel som (i) bereddes vid ett registrerat apotek i enlighet med punkt 4, och (ii) distribueras för administrering till P1 eller till en person i P1:s vård, eller (b) försäljning eller leverans av läkemedlet med avseende på administreringen. (6) Föreskrift 17.1 är inte tillämplig när det gäller beredning vid ett registrerat apotek, av eller under tillsyn av en farmaceut, av ett läkemedel för administrering till en person (P2), som utförs (a) på begäran av P2 eller en person som vårdar P2, och som är närvarande vid det registrerade apoteket vid tidpunkten för begäran, och (b) i enlighet med farmaceutens egen bedömning av vilken behandling som krävs för P2. (7) Föreskrift 46 är inte tillämplig när det gäller 3 (a) distribution vid eller från ett registrerat apotek av ett läkemedel som (i) bereddes vid ett registrerat apotek i enlighet med punkt 6, och (ii) distribueras för administrering till P2 eller till den person som vårdar P2, eller (b) försäljning eller leverans av läkemedlet med avseende på administreringen. (8) Beredning som genomförs i enlighet med (a) punkt 4 kan ske i väntan på att specifikationen tillhandahålls, eller (b) punkt 6 kan ske i väntan på att begäran tas emot, men endast om läkemedlet finns till försäljning eller leverans antingen av det registrerade apotek till vilket specifikationen tillhandahålls eller vid vilket begäran görs, eller av ett annat registrerat apotek som är en del av samma detaljhandelsföretag. (9) Punkterna 1, 4 och 6 är inte tillämpliga (a) när det gäller sammansättning, om sammansättningsprocessen antingen innebär en industriell beredning av ett läkemedel eller tillverkning av ett läkemedel genom en metod som inbegriper en industriell process, eller (b) när det gäller beredning, om det läkemedel som framställs genom denna tillverkningsprocess antingen bereds industriellt eller tillverkas genom en metod som inbegriper en industriell process. (10) Om inte annat följer av punkt 11 är kapitel 1 i del 13, bortsett från föreskrifterna 258A, 269, 269A och 271, inte tillämpligt när det gäller försäljning eller leverans, eller ett erbjudande om försäljning eller leverans, som är eller kommer att bli en försäljning eller leverans för vilken punkterna 2 b, 5 b eller 7 b är tillämpliga. (11) Punkt 10 är inte tillämplig när det gäller ett läkemedel som har sammansatts i enlighet med punkt 2 a i, om den enda genomförda sammansättningsprocessen (a) har genomförts med avseende på ett godkänt läkemedel, (b) inte innebär någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen. Farmaceuter: särskilda bestämmelser med avseende på artikel 3 i 2001 års direktiv 4B. (1) Föreskrift 17.1 är inte tillämplig när det gäller beredning i en godkänd klinisk miljö av ett läkemedel som (a) bereds i enlighet med (i) ett recept för en enskild patient som har utfärdats av sjukvårdspersonal och i vilket sammansättningen och den farmaceutiska formen av läkemedlet specificeras i tillräcklig detalj för att göra det möjligt att bereda läkemedlet i en godkänd klinisk miljö, eller (ii) föreskrifterna i en farmakopé, eller båda, (b) för distribution vid eller från en godkänd klinisk miljö av eller under tillsyn av en farmaceut, och (c) för försäljning eller leverans i enlighet med ett recept eller en anvisning som har utfärdats av sjukvårdspersonal eller i enlighet med en anvisning för en patientgrupp. (2) Föreskrift 46 är inte tillämplig när det gäller (a) distribution vid eller från en godkänd klinisk miljö av ett läkemedel som (i) bereddes i en godkänd klinisk miljö i enlighet med punkt 1 a, och (ii) distribueras till en enskild patient av eller under tillsyn av en farmaceut, eller 4 (b) försäljning eller leverans av läkemedlet i enlighet med (i) det recept eller den anvisning som har utfärdats av sjukvårdspersonal, eller (ii) den anvisning som har utfärdats för en patientgrupp, i enlighet med vilka läkemedlet distribuerades. (3) Om den godkända kliniska miljö vid eller från vilken ett läkemedel distribueras skiljer sig från den godkända kliniska miljö vid eller från vilken läkemedlet säljs eller levereras är punkt 2 inte tillämplig när det gäller läkemedel (a) som beretts i enlighet med föreskrifterna i en farmakopé, och (b) vars sammansättning och farmaceutiska form slutfördes (i) innan det recept eller den anvisning som anges i punkt 2 b i utfärdades, eller (ii) om läkemedlet säljs eller levereras enligt anvisningen för en patientgrupp, innan de enskilda patienternas identitet är känd för personen som distribuerar läkemedlet. (4) Kapitel 1 i del 13, bortsett från föreskrifterna 258A, 269, 269A och 271, är inte tillämpligt när det gäller en försäljning eller leverans, eller ett erbjudande om försäljning eller leverans, som är eller kommer att bli en försäljning eller leverans för vilken punkt 2 b är tillämplig. Anvisningar för patientgrupper: särskilda bestämmelser 4C. (1) Om inte annat följer av punkterna 2 och 3 är föreskrift 17.1 inte tillämplig när det gäller beredning eller sammansättning av ett läkemedel som utförs av sjukvårdspersonal som handlar inom ramen för sitt yrke om läkemedlet säljs, levereras eller administreras av sjukvårdspersonalen till en person i enlighet med en anvisning för en patientgrupp. (2) Punkt 1 gäller endast i samband med sammansättning, om (a) sammansättningsprocessen varken omfattar industriell beredning av ett läkemedel eller tillverkning av ett läkemedel genom en metod som inbegriper en industriell process, och (b) sammansättningsprocessen är nödvändig för att (i) uppfylla villkoren i anvisningen för patientgruppen, eller (ii) ändra utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, för att kunna ange de uppgifter som anges i bilaga 25 eller 26, eller båda dessa syften. (3) Punkt 1 gäller endast i samband med beredning, om (a) beredningsprocessen varken omfattar industriell beredning av ett läkemedel eller tillverkning av ett läkemedel genom en metod som inbegriper en industriell process, och (b) beredningsprocessen är nödvändig för att uppfylla villkoren i anvisningen för patientgruppen. (4) Föreskrift 46 är inte tillämplig när det gäller försäljning eller leverans, eller ett erbjudande om försäljning eller leverans, som utförs av sjukvårdspersonal som handlar inom ramen för sitt yrke, av ett läkemedel som inte är ett godkänt läkemedel, men som (a) säljs eller levereras eller ska säljas eller levereras i enlighet med en anvisning för en patientgrupp, och som (b) sammansatts i enlighet med punkt 2 eller beretts i enlighet med punkt 3. (5) Om inte annat följer av punkt 6 är kapitel 1 i del 13, bortsett från föreskrifterna 258A, 269, 269A och 271, inte tillämpligt när det gäller försäljning eller leverans, eller ett erbjudande om försäljning eller leverans, som utförs av sjukvårdspersonal av ett läkemedel som sammansatts i enlighet med punkt 2 eller beretts i enlighet med punkt 3. 5 (6) Punkt 5 är inte tillämplig när det gäller ett läkemedel som har sammansatts i enlighet med punkt 2, om den enda genomförda sammansättningsprocessen (a) har genomförts med avseende på ett godkänt läkemedel, (b) inte innebär någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen.”. Ändring av föreskrift 8 i 2012 års förordning 5. I föreskrift 8 i 2012 års förordning(a) (allmän tolkning), i punkt 1, ska följande infogas på lämplig plats i den alfabetiska ordningen: “hälso- och sjukvård: tjänst med samma innebörd som avses i avsnitt 266.6 i 2006 års lag om nationell hälso- och sjukvård (kontroller: kompletterande),”, “läkemedel inom hälso- och sjukvården: läkemedel med samma innebörd som avses i avsnitt 266.6 i 2006 års lag om nationell hälso- och sjukvård,”, och “ godkänd klinisk miljö: ett registrerat apotek, ett sjukhus, en vårdcentral, en patientmottagning eller en hemvårdstjänst, och i detta avseende avses med (a) hemvårdstjänst: en tjänst med samma innebörd som den som anges i punkt 2 i bilaga 12 till 2010 års lag om reformering av offentliga tjänster (Skottland), och (b) patientmottagning: en lokal vid eller från vilken primära sjukvårdstjänster tillhandahålls som en del av hälso- och sjukvården,”. Ändring av föreskrift 18 i 2012 års förordning 6. I föreskrift 18 i 2012 års förordning( b ) (partihandel med läkemedel), efter punkt 5, ska följande infogas: “(5A) När det gäller ett läkemedel som (a) distribueras vid eller från en godkänd klinisk miljö (C1) (i) till en enskild patient av eller under tillsyn av en farmaceut, och (ii) i enlighet med ett recept eller en anvisning som har utfärdats av sjukvårdspersonal eller i enlighet med en anvisning för en patientgrupp, och som (b) säljs eller levereras av C1 till en annan godkänd klinisk miljö (C2) i syfte att säljas eller levereras av C2 till eller för den enskilda patient till vilken läkemedlet distribuerades, räknas den försäljning eller den leverans av läkemedlet av C1 till C2 som avses i led b inte som en försäljning i enlighet med punkt 4 a.”. Ändring av föreskrift 46 i 2012 års förordning 7. I föreskrift 46 i 2012 års förordning (krav för godkännande), i punkt 7, ska följande infogas före led a: “(za) föreskrifterna 4A till 4C,”. Ny föreskrift 234A i 2012 års förordning 8. Efter föreskrift 234 i 2012 års förordning (undantag för leverans etc. av läkemedel i enlighet med en anvisning för en patientgrupp för att bistå polisen etc.) ska följande infogas: (a) Ändrad genom S.I. 2013/1855 och 2593 och 2015/1503. (b) Ersatt av S.I. 2013/1855. 6 “ Ändringar av läkemedel för att uppfylla villkoren för en anvisning för en patientgrupp 234A. (1) Om denna punkt är tillämplig ska hänvisningen till en tidpunkt för leverans eller administrering i bestämmelserna i (a) föreskrift 229.3 f, (b) föreskrift 230.8, (c) föreskrift 231.8, (d) föreskrift 232.8, (e) föreskrift 233.7, och (f) föreskrift 234.9, om leveransen eller administreringen gäller ett läkemedel (det distribuerade läkemedlet) som har beretts eller sammansatts i enlighet med föreskrift 4C, betraktas som en hänvisning till tidpunkten för leveransen av ett läkemedel (det ursprungliga läkemedlet) till den person som använde det ursprungliga läkemedlet för att bereda eller sammanställa det distribuerade läkemedlet i enlighet med föreskrift 4C. (2) Punkt 1 är endast tillämplig om berednings- eller sammansättningsprocessen var nödvändig för att uppfylla villkoren i anvisningen för en patientgrupp.”. Ändring av föreskrift 258 i 2012 års förordning 9. I föreskrift 258 i 2012 års förordning (förpackningskrav: särskilda bestämmelser) ska punkt 1 ersättas med följande: “(1) Utöver de övriga uppgifter som krävs enligt denna del, om ett läkemedel (oavsett om det är ett receptbelagt läkemedel eller ej) säljs eller levereras i enlighet med en anvisning för en patientgrupp, eller ett recept eller en anvisning som har utfärdats av en person som är en godkänd förskrivare, ska de uppgifter som anges i (a) punkterna 1 till 3 i bilaga 25 finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, (b) punkterna 4, 6 och 6A i bilaga 25, om inte annat följer av punkt 2, finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, om villkoren för angivande av de uppgifter som anges i dessa punkter är uppfyllda.”. Ny föreskrift 258A i 2012 års förordning 10. Efter föreskrift 258 i 2012 års förordning ska följande infogas: “Märkningskrav för undantagna läkemedel: särskilda bestämmelser 258A. (1) Denna punkt är tillämplig om ett läkemedel (oavsett om det är ett receptbelagt läkemedel eller ej) säljs eller levereras under omständigheter där läkemedlet tillverkades, bereddes eller sammansattes av sjukvårdspersonal i enlighet med föreskrift 3.4 eller 3.5 eller 4C, bortsett från de fall som avser en sammansättning där den enda genomförda sammansättningsprocessen (a) genomfördes med avseende på ett godkänt läkemedel, (b) inte innebar någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen. (2) I de fall där punkt 1 är tillämplig, om inte annat följer av punkterna 5 till 9, gäller att de uppgifter som anges i 7 (a) punkterna 1 till 3 i bilaga 26 finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, (b) punkt 4 eller 4A ska finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, om villkoren för angivande av de uppgifter som anges i dessa punkter är uppfyllda. (3) Denna punkt är tillämplig om ett läkemedel (oavsett om det är ett receptbelagt läkemedel eller ej) säljs eller levereras under omständigheter där läkemedlet bereddes eller sammansattes av eller under tillsyn av en farmaceut i enlighet med föreskrift 4A eller 4B, bortsett från de fall som avser en sammansättning där den enda genomförda sammansättningsprocessen (a) genomfördes med avseende på ett godkänt läkemedel, (b) inte innebar någon förändring bortsett från utseendet på läkemedlets yttre förpackning, eller läkemedlets behållare om det inte finns någon yttre förpackning, och (c) innebär att läkemedlet förblir godkänt trots ändringen. (4) I de fall där punkt 3 är tillämplig, om inte annat följer av punkterna 5 till 9, gäller att de uppgifter som anges i (a) punkterna 5 till 7 i bilaga 26 finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, (b) punkterna 8, 10, 11, 11A och 11B ska finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, när läkemedlet säljs eller levereras, om villkoren för angivande av de uppgifter som anges i dessa punkter är uppfyllda. (5) Om fler än ett läkemedel i en fast doseringsform ingår i läkemedlets behållare, till följd av en sammansättningsprocess, och om läkemedlets förpackning är utformad så att doser av olika läkemedel kan intas vid ett och samma tillfälle av en enskild patient ska (a) kraven i denna föreskrift, att uppgifterna ska finnas väl synliga på läkemedlets yttre förpackning, eller på läkemedlets behållare om det inte finns någon yttre förpackning, tolkas som krav på att uppgifterna ska finnas väl synliga på den yttre förpackningen eller på behållaren, eller en kombination av båda, när så är lämpligt, men (b) uppgifterna i punkterna 1 och 2 i bilaga 26 ska under dessa omständigheter, där så är möjligt, finnas väl synliga både på läkemedlets yttre förpackning (om det finns en yttre förpackning) och på läkemedlets behållare. (6) Vid tillämpningen av denna föreskrift ska kraven i punkt 8 eller 10 i bilaga 26 betraktas som uppfyllda när det gäller ett läkemedels förpackning om läkemedlet ingår i en förpackning som innehåller flera förpackningar av läkemedel med samma beteckning och om de uppgifter som anges i dessa punkter finns angivna på en av dessa förpackningar. (7) Ingenting i denna föreskrift eller i bilaga 26 medför något krav på att uppgifter ska finnas väl synliga på (a) en förpackning som innehåller ett läkemedel där en del av förpackningen är transparent eller öppen, under förutsättning att de uppgifter som krävs enligt denna föreskrift och den bilagan är väl synliga genom den transparenta eller öppna delen av förpackningen, (b) en papperspåse eller ett liknande emballage som innehåller en förpackning med ett läkemedel, under förutsättning att de uppgifter som krävs enligt denna föreskrift och den bilagan finns väl synliga på läkemedlet, (c) en ampull eller annan behållare som har en normal kapacitet som inte överstiger 10 milliliter och som är innesluten i en förpackning, under förutsättning att de 8 uppgifter som krävs enligt denna föreskrift och den bilagan finns väl synliga på förpackningen, (d) en blisterförpackning eller ett liknande emballage som är inneslutet i en annan förpackning, under förutsättning att de uppgifter som krävs enligt denna föreskrift och den bilagan finns väl synliga på förpackningen. (8) Ingenting i denna föreskrift eller i bilaga 26 gäller behållare för antivirala läkemedel som har formen av en lösning och som ska användas för behandling av barn under ett års ålder, om (a) behållaren har väl synliga uppgifter om (i) namnet på barnet till vilket läkemedlet ska administreras, (ii) det datum då läkemedlet säljs eller levereras, och (iii) nödvändiga anvisningar för korrekt användning, och (b) läkemedlet säljs eller levereras med avsikt att behandla en sjukdom som är (i) en allvarlig risk för människors hälsa, eller potentiellt utgör en allvarlig risk för människors hälsa, och (ii) pandemisk eller riskerar att bli pandemisk. (9) Ingenting i denna föreskrift eller i bilaga 26 gäller ett traditionellt växtbaserat läkemedel eller ett registrerbart homeopatiskt läkemedel. (10) Ingenting i denna föreskrift eller i bilaga 26 utgör hinder för att på en sådan förpackning med läkemedel som avses i punkt 1 eller 3 ange uppgifter som skulle krävas av denna del om läkemedlet vore godkänt. (2) Vid tillämpningen av denna föreskrift ska godkänd tolkas i enlighet med föreskrift 3.15.”. Ändring av föreskrift 269 i 2012 års förordning 11.(1) Föreskrift 269 (överträdelser avseende förpackningar och bipacksedlar: övriga personer) ska ändras enligt följande: (2) I punkt 2 ska ”Om inte annat följer av punkt 3 ska” infogas före ”en person att”. (3) Efter punkt 2 ska följande punkter infogas: “(3) Inga överträdelser har begåtts enligt punkt 2 a om en förpackning inte uppfyller de tillämpliga kraven i denna del till följd av att de uppgifter som finns på förpackningen, i enlighet med föreskrifterna 258 och 258A, på den yttre förpackningen av ett läkemedel, eller på läkemedlets behållare om det inte finns någon yttre förpackning, är (a) obefintliga eller endast delvis kompletta uppgifter av den typ som kan tas med i enlighet med punkt 6A i bilaga 25, eller 4A eller 11A i bilaga 26, eller (b) uppgifter som kan tas med i enlighet med punkt 6A i bilaga 25, eller 4A eller 11A i bilaga 26, men om de angivna uppgifterna är felaktiga eller vilseledande.”. Ny föreskrift 269A i 2012 års förordning 12. Efter föreskrift 269 i 2012 års förordning ska följande infogas: “Läkemedelsetiketter och förfaranden för tillhandahållande av NHS apotekstjänster 269A. Ingenting i denna förordning utgör hinder för att, vid förfaranden för tillhandahållande av farmaceutiska tjänster som en del av hälso- och sjukvården, införa regler eller villkor som medför (a) ett krav att på förpackningen till ett läkemedel inom hälso- och sjukvården ange uppgifter som kan anges på förpackningen i enlighet med punkt 6A i bilaga 25 eller punkt 6A eller 11A i bilaga 26, eller 9 (b) ett förbud mot att på förpackningen till ett läkemedel inom hälso- och sjukvården ange uppgifter som (i) är av den typ som anges i punkt 6A i bilaga 25, eller punkt 6A eller 11A i bilaga 26, men som (ii) är felaktiga eller vilseledande.”. Ändring av föreskrift 368 i 2012 års förordning 13. I föreskrift 346 i 2012 års förordning(a) (granskning), i punkt 2 c, (a) ska följande infogas före punkt i: “(zi) 4A till 4C,”, och (b) efter punkt xxviiig ska följande infogas: “(xxviiih) 258.1 och 258A,”. Ändring av bilaga 25 till 2012 års förordning 14. I del 1 i bilaga 25 till 2012 års förordning (förpackningskrav: särskilda bestämmelser – receptbelagda läkemedel) ska följande infogas efter punkt 6: “6A. I fråga om ett läkemedel inom hälso- och sjukvården, om detta är ett krav vid förfaranden för tillhandahållande av farmaceutiska tjänster som en del av hälso- och sjukvården, (a) det pris som har fastställts för läkemedlet på grundval av dessa förfaranden (som kan vara ett pris som finns förtecknat i den tillämpliga läkemedelstaxan), (b) en redogörelse för hur kostnaden för läkemedlet täcks (till exempel en redogörelse om att den täcks av skattebetalarna).”. Ändring av bilaga 26 till 2012 års förordning 15.(1) Bilaga 26 till 2012 års förordning (förpackningskrav: särskilda bestämmelser) ska ändras enligt följande: (2) I rubriken till del 1, efter ”och barnmorskor” ska ”, eller i enlighet med en anvisning för en patientgrupp” infogas. (3) I del 1 (a) ska punkt 2 ersättas med följande: “2. (1) Om inte annat följer av led 2, namn och adress till den person som säljer eller levererar läkemedlet. (2) Vid tillämpning av led 1, om ett läkemedel har distribuerats och om den person som distribuerade läkemedlet inte är samma person som den person som säljer eller levererar det, kan namn och adress till den person som distribuerade läkemedlet anges istället för eller i tillägg till namnet och adressen till den person som säljer eller levererar det.”, (b) ska följande infogas efter punkt 4: “4A. I fråga om ett läkemedel inom hälso- och sjukvården, om detta är ett krav vid förfaranden för tillhandahållande av farmaceutiska tjänster som en del av hälso- och sjukvården, (a) det pris som har fastställts för läkemedlet på grundval av dessa förfaranden (som kan vara ett pris som finns förtecknat i den tillämpliga läkemedelstaxan), (a) Ersatt av S.I. 2013/1855 och sedan ändrad genom S.I. 2013/2593, 2014/323, 2015/178, 259 och 1503. 10 (b) en redogörelse för hur kostnaden för läkemedlet täcks (till exempel en redogörelse om att den täcks av skattebetalarna).”. (4) I del 2 (undantag för apotek) ska följande infogas efter punkt 11: “11A. I fråga om ett läkemedel inom hälso- och sjukvården, om detta är ett krav vid förfaranden för tillhandahållande av farmaceutiska tjänster som en del av hälso- och sjukvården, (a) det pris som har fastställts för läkemedlet på grundval av dessa förfaranden (som kan vara ett pris som finns förtecknat i den tillämpliga läkemedelstaxan), (b) en redogörelse för hur kostnaden för läkemedlet täcks (till exempel en redogörelse om att den täcks av skattebetalarna). 11B. Om (a) fler än ett läkemedel i en fast doseringsform ingår i läkemedlets behållare till följd av en sammansättningsprocess, och (b) läkemedlets förpackning är utformad så att doser av olika läkemedel kan intas vid ett och samma tillfälle av en enskild patient, sådana uppgifter som gör det möjligt för patienten att identifiera och särskilja de olika läkemedlen så som den person under vars ansvar sammansättningsprocessen genomförs finner lämpligt.”. Upphävande av avsnitten 10 och 15 i 1968 års läkemedelslag 16.(1) Avsnitt 10 i 1968 års läkemedelslag (undantag för farmaceuter) upphävs. (2) Avsnitt 15 i 1968 års läkemedelslag (bestämmelser för förlängning och ändring av undantag) upphävs. Ändring av avsnitt 69 i 1968 års läkemedelslag 17. I avsnitt 69 i 1968 års läkemedelslag(a) (allmänna bestämmelser) ska följande infogas efter underavsnitt 2: “(2A) Om ett företag distribuerar ett läkemedel på uppdrag av ett annat företag i syfte att (a) sälja läkemedlet genom detaljhandel, eller (b) leverera läkemedlet under omständigheter som motsvarar detaljhandelsförsäljning, men inte säljer läkemedlet genom detaljhandel eller levererar det under omständigheter som motsvarar detaljhandelsförsäljning är underavsnitt 2B tillämpligt. (2B) Inom ramen för tillämpningen av denna del ska (a) det företag som avses i underavsnitt 2A som inte säljer läkemedlet genom detaljhandel eller levererar det under omständigheter som motsvarar detaljhandelsförsäljning likväl anses göra detta via en mellanhand, och (b) följaktligen är både den lokal vid vilken läkemedlet distribueras och den lokal som tillhör det andra företag som avses i det underavsnittet och vid vilket läkemedlet säljs genom detaljhandel eller levereras under omständigheter som motsvarar detaljhandelsförsäljning lokaler där en verksamhet med detaljhandel av läkemedel äger rum.”. Underskrift på uppdrag av statssekreteraren (a) Avsnitt 69 har ändrats genom 1993 års författningslag (upphävanden) (kap. 50), bilaga 1.12, punkt 1, och genom S.I. 2007/289 och 3101 och 2010/231. 11 Datum Juniorminister Hälsovårdsministeriet Datum Ministern för hälsa, socialtjänst och allmänhetens säkerhet 12 FÖRKLARANDE ANMÄRKNING (Denna anmärkning är inte del av förordningen.) Denna förordning är en ändring av 2012 års förordning om humanläkemedel (nedan kallad 2012 års förordning), som reglerar förfaranden, över hela Förenade kungariket, för licensiering, tillverkning, grossisthandel och försäljning eller leverans av humanläkemedel. Ändringen utförs till stor del på grundval av ett genomförande av Europaparlamentets och rådets direktiv 2001/83/EG om upprättande av gemenskapsregler för humanläkemedel(a). Del 1 av 2012 års förordning omfattar bland annat allmänna undantag från kraven på att inneha godkännanden för försäljning av enskilda läkemedel – och att inneha tillverkningslicenser. Undantagen avseende distribution av läkemedel av eller under tillsyn av en farmaceut ingick tidigare i avsnitt 10 i 1968 års läkemedelslag och i föreskrift 4 i 2012 förordning, vilka har upphävts och återkallats. De nya föreskrifterna 4A och 4B i 2012 års förordning föreskriver, generellt sett, att beredning eller sammansättning av ett läkemedel av eller under tillsyn av en farmaceut i en godkänd klinisk miljö (en term som omfattar registrerade apotek inom detaljhandeln, sjukhus, vårdcentraler, patientmottagningar och hemvårdstjänster) – om läkemedlet ska distribueras i enlighet med ett recept eller en anvisning av en förskrivare eller en anvisning för en patientgrupp – inte kräver någon tillverkningslicens. Det framställda läkemedlet kräver inte heller något godkännande för försäljning – men om sammansättningsförfarandet (till exempel införandet av en läkemedelsetikett) inte upphäver godkännandet för försäljning måste all försäljning eller leverans av läkemedlet fortfarande uppfylla villkoren i läkemedlets godkännande för försäljning. Fyra viktiga ändringar görs av de tidigare förfarandena. För det första hindrade de tidigare bestämmelserna att distribuerade läkemedel som sammansatts av ett apotek inom detaljhandeln först levererades mellan olika företag och sedan vidare till eller för patienten. Detta hindrade det apotek inom detaljhandeln som sålde eller levererade ett läkemedel till eller för patienten från att använda en annan juridisk enhets tjänster för att distribuera läkemedlet för apotekets räkning. Detta hinder har tagits bort. I de fall där apotek inom detaljhandeln utnyttjar denna nya flexibilitet måste emellertid både den lokal som läkemedlet distribueras från och den lokal som läkemedlet levereras till registreras som apotek. För det andra kommer godkända kliniska miljöer som bereder egna läkemedel endast att kunna lagerhålla läkemedel som har beretts i förväg och som baseras på föreskrifterna i en farmakopé, om dessa läkemedel ska levereras direkt till patienterna från den godkända kliniska miljön i fråga. De kommer inte att kunna lagerhålla sådana läkemedel och sedan leverera dem till patienterna indirekt via en annan godkänd klinisk miljö. Detta klargörande görs mot bakgrund av domen i Europeiska unionens domstol i fallet Abcur AB mot Apoteket Farmaci AB (CJEU 17.07.2015 C544/13). För det tredje införs separata bestämmelser för sammansättning av läkemedel för försäljning eller leverans enligt en anvisning för en patientgrupp – vilket påverkar all sjukvårdspersonal som är behörig att leverera läkemedel enligt anvisningar för patientgrupper, inte bara farmaceuter. Vidare klargörs att sammansättning som utförs av sjukvårdspersonal i syfte att följa en anvisning för en patientgrupp inte kräver någon tillverkningslicens, och att försäljning eller leverans av ett läkemedel enligt en anvisning för en patientgrupp kan utföras på annat sätt än i enlighet med ett godkännande för försäljning om detta är nödvändigt för att uppfylla villkoren i anvisningen för patientgruppen. För det fjärde förtydligas det inbördes förhållandet mellan undantagen för farmaceuter, det nya undantaget för anvisningar för patientgrupper – och andra gällande undantag för läkare, tandläkare, sjuksköterskor och barnmorskor – samt bestämmelserna för etikettering enligt 2012 års förordning. Om läkemedel som levereras i enlighet med dessa undantag har en godkänd form (a) EGT L 311, 28.11.2001, s. 67. Direktiv 2001/83/EG ändrades senast genom direktiv 2011/62/EU (EUT L 174, 1.7.2011, s. 74). 13 gäller en uppsättning av regler (föreskrift 258 i och bilaga 25 till 2012 års förordning), medan en annan uppsättning av regler gäller för läkemedel som inte är i en godkänd form (den nya föreskriften 258A och bilaga 26). Samtidigt har möjligheten tagits till vara att införa de kompletterande kraven för etikettering i 2012 års förordning – i synnerhet vidfästningen av en etikett på läkemedlet – för produkter som levereras i enlighet med anvisningar från förskrivare och anvisningar för patientgrupper såväl som de som levereras enligt ett recept. Den nya föreskriften 258A i 2012 års förordning innehåller även nya bestämmelser avseende etikettering av doseringssystem för flera läkemedel. Dessa system har införts till följd av sammansättningen av flera olika läkemedel i samma förpacknig för att underlätta för patienter som tar olika läkemedel vid särskilda tidpunkter. Nya etiketteringskrav har införts för att göra det möjligt att ange uppgifter så att patienterna kan identifiera och särskilja de olika läkemedlen. De nya kraven är flexibla, så att de flesta av uppgifterna som normalt måste finnas antingen på den yttre förpackningen eller på behållaren vid användning av doseringssystem för flera läkemedel kan anges på en kombination av endera eller båda av dessa typer av förpackningar. Ett undantag görs avseende namnet på patienten och namnet på den person som levererar läkemedlet, vilka vid användning av doseringssystem för flera läkemedel måste finnas på båda typerna av förpackning. I de fall där olika företag distribuerar och levererar läkemedlet kan förpackningen innehålla endera eller båda av namnen, enligt vad som är lämpligt. Ändringar görs även av kraven för etikettering i 2012 års förordning för att göra det möjligt att ange kostnaden för läkemedlet och en redogörelse för hur kostnaden täcks på etiketten till läkemedel som tillhandahålls av NHS. Alla sådana krav måste införas via NHS användarvillkor och kommer att verkställas via NHS förfaranden för att säkerställa överensstämmelse med dessa villkor, inte via straffrättsliga förfaranden i enlighet med 2012 års förordning. En bedömning av konsekvenserna av denna förordning har genomförts. En kopia av denna konsekvensbedömning har offentliggjorts med motivering tillsammans med instrumentet på www.legislation.gov.uk. Kopior kan även erhållas från Medicines and Healthcare products Regulatory Agency, 151 Buckingham Palace Road, Victoria, London, SW1W 9SZ. 14