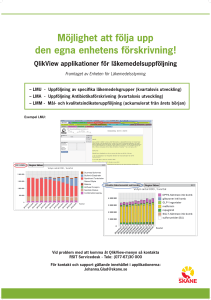
Ordnat införande och strukturerad uppföljning av nya läkemedel
advertisement

Ordnat införande och strukturerad uppföljning av nya läkemedel Nationella läkemedelsstrategin, delprojekt 6.2 Rapport från Läkemedelsverket Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds väg 42, Uppsala Telefon/Phone: +46 (0)18 17 46 00 Fax: +46 (0)18 54 85 66 Internet: www.lakemedelsverket.se E-mail: [email protected] Innehållsförteckning 1. Förord ............................................................................................................................................................... 4 2. Sammanfattning ............................................................................................................................................... 5 3. Bakgrund .......................................................................................................................................................... 8 4. Uppdraget och dess genomförande .............................................................................................................. 11 5. 6. 7. 4.1. Uppdraget ............................................................................................................................................. 11 4.2. Projektets organisation, arbetssätt och deltagare .................................................................................. 12 4.3. Tolkning av uppdraget .......................................................................................................................... 13 4.4. Avgränsningar ...................................................................................................................................... 13 4.5. Samråd .................................................................................................................................................. 13 4.6. Val av pilotprojekt ................................................................................................................................ 14 4.7. Särskilda uppdrag ................................................................................................................................. 14 Pilotprojekt och andra modeller för ordnat införande och strukturerad uppföljning ............................ 15 5.1. Inledning ............................................................................................................................................... 15 5.2. Ordnat införande av nya orala antikoagulantia i Auriculas regi ........................................................... 18 5.3. Ordnat införande av nya orala antikoagulantia i Stockholms läns landsting ........................................ 22 5.4. Ordnat införande av nya orala antikoagulantia i Västra Götalandsregionen ........................................ 24 5.5. Ordnat införande av nya direktverkande antivirala läkemedel som behandling av hepatit C – ett 4länssamarbete ....................................................................................................................................... 27 5.6. Ordnat införande och strukturerad uppföljning av eculizumab vid paroxysmal nokturn hemoglobinuri .............................................................................................................................................................. 30 5.7. Ordnat införande och strukturerad uppföljning av Votubia – ett förmånsbegränsat särläkemedel ....... 33 5.8. Kvalitetsregister – en modell för ordnat införande och strukturerad uppföljning av läkemedel........... 35 5.9. Det nationella vaccinationsprogrammet – om införande och uppföljning ............................................ 40 Internationell utblick – exempel från andra europeiska länder ................................................................ 46 6.1. Bakgrund .............................................................................................................................................. 46 6.2. Europeiska exempel – ett urval från rapporten ..................................................................................... 46 6.3. Rapportens förslag för Sverige ............................................................................................................. 46 6.4. Diskussion och prioritering av förslagen i rapporten............................................................................ 47 Möjlighet till uppföljning av följsamhet ...................................................................................................... 49 7.1. Begreppet följsamhet ............................................................................................................................ 49 7.2. Källor för datafångst ............................................................................................................................. 49 7.3. Uppföljning av följsamhet .................................................................................................................... 49 7.4. Befintlig uppföljning av följsamhet ...................................................................................................... 50 7.5. Utvecklingsmöjligheter ........................................................................................................................ 51 7.6. Kliniska beslutstöd ............................................................................................................................... 51 Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 2 (75) 8. 9. Samhällsekonomisk analys av pilotprojekten ............................................................................................. 52 8.1. Bakgrund .............................................................................................................................................. 52 8.2. Resultat ................................................................................................................................................. 53 8.3. Diskussion ............................................................................................................................................ 53 8.4. Sammanfattning från Läkemedelsverket .............................................................................................. 54 Metodologiska aspekter på insamling och analys av uppföljningsdata .................................................... 55 9.1. Ordnat införande ................................................................................................................................... 55 9.2. Strukturerad uppföljning....................................................................................................................... 55 9.3. Vilka frågor kan ställas och besvaras? .................................................................................................. 55 9.4. Hur kan man göra? ............................................................................................................................... 56 9.5. Vad styr läkemedelsbehandling och uppföljning i praktiken? .............................................................. 56 9.6. Datainsamling och kvalitet ................................................................................................................... 57 9.7. Bearbetning och analys ......................................................................................................................... 57 9.8. Rapportering och avnämare .................................................................................................................. 57 9.9. Värdering av rapporter och åtgärder ..................................................................................................... 58 9.10. Nivå och omfattning av strukturerad uppföljning ................................................................................. 58 9.11. Datakällor ............................................................................................................................................. 59 10. Generella slutsatser och rekommendationer ............................................................................................... 60 10.1. Projektets målbild ................................................................................................................................. 60 10.2. Generella slutsatser ............................................................................................................................... 60 10.3. Rekommendationer och förslag ............................................................................................................ 65 10.4. Avslutande kommentar ......................................................................................................................... 68 11. Referenser ....................................................................................................................................................... 69 12. Definitioner och förkortningar ..................................................................................................................... 71 12.1. Definitioner........................................................................................................................................... 71 12.2. Förkortningar ........................................................................................................................................ 71 13. Projektets styr-, metod- och projektgrupp .................................................................................................. 74 13.1. Projektets styrgrupp .............................................................................................................................. 74 13.2. Projektets metodgrupp .......................................................................................................................... 74 13.3. Läkemedelsverkets projektgrupp .......................................................................................................... 74 14. Bilagor............................................................................................................................................................. 75 Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 3 (75) 1. Förord Detta uppdrag initierades som en aktivitet i handlingsplanen för den nationella läkemedelsstrategin (NLS, 2011) som tagits fram i samverkan mellan regeringen, Sveriges Kommuner och Landsting och en rad aktörer på läkemedelsområdet. Syftet med strategin är att få en nationell kraftsamling kring prioriterade förbättringar inom läkemedelsområdet. Läkemedelsstrategin har identifierat sju insatsområden. Detta uppdrag (delprojekt 6.2) ingår i insatsområdet att ”Upprätta en process för ordnat och effektivt införande samt utöka uppföljning av läkemedels användning och effekter.” Delprojektet 6.2 har senare även inkluderats som en uppgift i Läkemedelsverkets regleringsbrev 2012, med komplettering i april 2013. Eftersom uppdragsbeskrivningen har lyft fram användandet av pilotprojekt som ett sätt att visa på goda exempel, utgör en huvuddel av rapporten redovisningar av ett antal utvalda pilotprojekt och modeller (Kapitel 5). Dessa beskrivs i detalj i Bilaga I. Fokus för denna rapport är uppföljning av nya läkemedel. I tillägg till projektgruppens arbete har några specifika frågeställningar belysts genom särskilda externa uppdrag. De externa författarna är ansvariga för sina rapporter som i sin helhet återfinns i Bilaga II–IV. Dessa rapporter har även sammanfattats och kommenterats i huvudrapporten (Kapitel 6–8) och utgör också underlag för de rekommendationer och förslag som tas upp i kapitel 10. Kapitel 9 redovisar grundläggande metodologiska aspekter på uppföljning och kan läsas av den som saknar erfarenhet av området. Kapitel 2 ”Sammanfattning” och kapitel 10 ”Generella slutsatser och rekommendationer” bör tillsammans ge läsaren en huvudsaklig bild av projektets resultat. För en fullständig belysning av området introduktion och uppföljning av nya läkemedel i klinisk vardag behöver man även beakta den kommande rapporten från delprojektet 6.1 som fokuserar på ordnat införande. Läkemedelsverket är ansvarigt för innehållet i huvudrapporten. Projektets externa styrgrupp har varit ansvarigt för inriktning, val av pilotprojekt och övergripande beslut. Projektets styr- och metodgrupp, liksom medarbetare inom Läkemedelsverket, har bidragit med värdefulla synpunkter. Ett särskilt tack riktas till de som intervjuats om pilotprojekten och som bidragit med stort engagemang och kunskaper. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 4 (75) 2. Sammanfattning Det finns flera orsaker till ett ökat behov av ordnat införande och strukturerad uppföljning av nya läkemedel och andra behandlingsinsatser. De nya behandlingarnas större komplexitet, med mer individualiserad behandling och ibland okända risker kräver nya former för uppföljning. Strukturerad uppföljning behövs också för att säkra bättre kostnadskontroll, transparens vid prioriteringar och jämlikhet i behandlingen. Evidensbaserad utmönstring av befintliga terapier måste grundas på systematiskt insamlade uppföljningsdata. För att identifiera viktiga faktorer som kan utgöra grunden för ordnat införande och strukturerad uppföljning studerades sex i sjukvården initierade projekt. Utgående från dessa pilotprojekt, fördjupade analyser i särskilda delrapporter och andra omvärldsobservationer ges ett antal förslag för att förbättra möjligheterna för strukturerad uppföljning av nya läkemedel. Rapportens viktigaste slutsatser och förslag är följande: • Tydligare fördelning av ansvar Genom uppdelning av ansvar på beställare och utförare och en rationell fördelning mellan tillgängliga kompetenser, skapas bra förutsättningar för en strukturerad uppföljning av nya läkemedel. Uppdelningen bör grundas på såväl formellt ansvar som relevant kompetens. Utförare kan vara landsting/regioner, myndigheter, akademiska centra, regionala cancer- och kvalitetsregistercentra med flera. Ett råd tillsätts med uppgift att föreslå fördelning av ansvar för nationella uppföljningar. I rådet bör de aktörer ingå som har nationellt ansvar för läkemedelsuppföljning. • Tidig identifiering av uppföljningens frågeställning De frågeställningar som ska styra uppföljningen måste identifieras och prioriteras tidigt, dvs. senast vid tidpunkten för beslut om införande. Produktspecifika frågor preciseras och relateras till potentiella säkerhetsproblem, subventionsbegränsningar etc. I många fall kommer befintliga strukturer för uppföljning att kunna användas men ibland kommer nya modeller att behövas. I dessa situationer krävs längre framförhållning, särskilt om uppföljningen ska göras i internationell samverkan. • Klinisk förankring och professionella incitament Förankring i berörda verksamheter och professioner görs tidigt och med en trovärdig och kliniskt relevant motivering för den beslutade introduktionen/uppföljningen. Positiva professionella drivkrafter identifieras och förstärks, exempelvis möjligheterna till forskning förbättras och att uppföljningsdata har ett tydligt kliniskt mervärde. Snabb och meningsfull återkoppling som ger trovärdig evidens för det kliniska arbetet och dess prioriteringar är viktig. Åtgärder vidtas för att öka kunskapen om och förståelsen för regulatoriska uppföljningskrav och hur dessa kan hanteras i klinisk praxis. Detta kan kräva en mera proaktiv ansats bland annat från myndigheter. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 5 (75) Resurser och tekniska lösningar är viktiga men identifiering av de medverkandes incitament att engagera sig och förstärkning av dessa förefaller vara en av de centrala framgångsfaktorerna. • Patientperspektivet Framtidens patienter kommer att vara alltmer informerade och mer delaktiga i behandlingsbeslut men kommer också kunna fungera som en viktig rapportör av uppföljningsinformation. En mera individualiserad läkemedelsbehandling grundad på bioinformatiska data (”personalized medicine”) ökar betydelsen av patientmedverkan. Patientaspekter behöver i större utsträckning vägas in redan vid planering av ordnat införande och strukturerad uppföljning av nya läkemedel. • EU-aspekter behöver beaktas Godkännande av nya läkemedel, särskilt de som kan bli aktuella för ordnat införande, styrs i hög grad av EU-gemensamma regelverk och procedurer. Även delar av uppföljningen, särskilt företagens ansvar, regleras via EU-beslut. Därför måste regulatoriska aspekter beaktas i större utsträckning vid planering och genomförande av nationell uppföljning. Myndigheterna har här en viktig roll, bland annat att förmedla kunskap om detta. • Forsknings- och innovationsaspekter ska vägas in Genom att beakta forsknings- och innovationsaspekter kan incitamentet för aktivt deltagande från berörda professioner ökas, kvaliteten på uppföljningsdata höjas och läkemedelsutveckling attraheras. Genom att erbjuda företagen möjligheter att följa upp nya läkemedel i klinisk praxis ökar deras vilja att förlägga studier i tidig fas till Sverige. Inte minst om konceptet ”adaptive licensing” (stegvis godkännande) introduceras kan en väl fungerande ”uppföljningsmiljö” utgöra en internationell konkurrensfördel, liksom om möjligheten att följa upp nya biologiska läkemedel, så kallade biosimilarer, kan erbjudas i Sverige. • Datatillgång och IT-stöd Mycket av de data som behövs för uppföljning finns i befintliga datakällor. Tillgängligheten behöver dock förbättras och hinder, såväl vad gäller juridiska aspekter som logistik, behöver avlägsnas för att möta alla avnämares behov. Särskilda insatser krävs när det gäller rekvisitionsläkemedel eftersom möjligheter till nationellt samlad uppföljning av dessa för närvarande saknas. Detta gäller även för uppföljning av läkemedelsbehandling i primärvården. Möjligheterna att överföra data mellan journalsystem och kvalitetsregister behöver förbättras och journaler struktureras för att möjliggöra direkt extraktion av data för uppföljningsändamål. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 6 (75) Denna rapport ger klara indikationer inom vilka områden som åtgärder är mest angelägna. Det är tydlighet i fördelning av ansvar och rationell användning av kompetens som framstår som viktigast. Med detta klargjort kan de protokoll och processer som behövs, implementeras utan dröjsmål. Även om insamling och användning av uppföljningsdata behöver förbättras är det uppenbart att värdefulla och i internationellt perspektiv delvis unika register och datakällor redan finns – men att de kan utnyttjas bättre. Flera huvudmän har väl fungerande modeller för ordnat införande medan de flesta behöver utveckla formerna för uppföljning ytterligare. Alla bör dock inte göra allt – frågeställningar som kräver nationella data för att besvaras ska göras med tydlig nationell samordning. Inom vissa terapiområden med väl fungerande kvalitetsregister har man genom att utnyttja dessa och koppla dem till hög medicinsk och vetenskaplig kompetens skapat synergier. Detta har möjliggjort ordnat införande och strukturerad uppföljning samtidigt som det gett internationellt vetenskapligt och regulatoriskt genomslag. Endast ett begränsat antal läkemedel kan initialt förväntas bli föremål för nationellt ordnat införande och uppföljning. Det är dock angeläget att uppföljning av redan tillgängliga läkemedel och behandlingsinsatser inte försummas. God överblick och möjligheter att jämföra olika behandlingar, gamla som nya, är en förutsättning för att kunna erbjuda medborgarna en värdebaserad, effektiv, säker och jämlik vård. ”Detta är inte slutet. Det är inte ens början på slutet. Men kanske är det slutet på början” – Winston Churchill Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 7 (75) 3. Bakgrund Ett flertal utvecklingstendenser såväl nationellt som internationellt, visar på ett ökat behov av ordnat införande och strukturerad uppföljning av nya läkemedel och andra behandlingsinsatser. Ökade kostnader för nya terapier är en uppenbar drivkraft. De nya behandlingarnas större komplexitet, med mer individualiserad behandling och ibland okända risker då nya verkningsmekanismer tillämpas, kräver också nya former för uppföljning. Strukturerad uppföljning behövs vidare för att säkra transparens vid prioriteringar och jämlikhet i behandlingen mellan olika patientgrupper såväl som mellan olika regioner. Detta är särskilt relevant för sällsynta sjukdomar och särläkemedel där en flernationell ansats ofta krävs för att möjliggöra utvärdering. Uppföljningsdata behövs även för evidensbaserad utmönstring av befintliga terapier. Figur 1. En schematisk bild över ett läkemedels livscykel – från utveckling till introduktion och uppföljning. Förklaringar: PASS = Post-authorisation safety studies, PAES = Post-authorisation efficacy studies Även om införande och uppföljning har kommit att få en allt större betydelse under ett läkemedels livscykel är det nödvändigt att den kunskap som genereras under utvecklingen före godkännandet (Figur 1) beaktas under hela den tid läkemedlet finns på marknaden. Så kallad ”adaptive licensing” är en term som introducerats för att beskriva en mer flexibel ansats för godkännande och subvention av nya läkemedel. Användningen av en sådan procedur kommer att kräva mycket tydliga och effektiva system för introduktion och uppföljning. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 8 (75) Behov av ordnat införande och uppföljning har beskrivits såväl i internationell vetenskaplig litteratur (1) som i nationellt utarbetade dokument, exempelvis i den så kallade P16-gruppens rapport från 2009 (2). I USA har betydande resurser avsatts för att utveckla uppföljning av behandling i klinisk praktik, så kallad Comparative Effectiveness Research. Inom EU har nya regelverk introducerats bland annat för att bidra till ökad patientsäkerhet, vilket kräver ökad tillgång till uppföljningsdata. En EU gemensam, så kallad Joint Action, initierad av Kommissionen pågår för att förbättra möjligheterna till registerbaserad uppföljning inom Europa (3). Nationella Health Technology Assessment (HTA)-myndigheter ställer högre krav på uppföljning av kostnadseffektivitet, och i det europeiska HTA-nätverket (EUnetHTA) ses en ökad samverkan mellan medlemsländerna för en effektivare utvärdering av nya behandlingar. Nya former för läkemedelsprövning, som möjliggör uppföljning av läkemedel i klinisk praxis men som också kan bryta den snabba ökningen av kostnader för läkemedelsstudier, efterlyses av många aktörer. Tillgången till stora datamängder i form av databaser med information om läkemedel och deras effekt, säkerhet och kostnad ger en möjlighet till förbättrad uppföljning men kan också utgöra ett problem så länge inte krav på datakvalitet, IT-stöd och juridiska/etiska aspekter är väl tillgodosedda. En del av de studier som företagen ålagts för att svara mot regulatoriska krav har trots att data finns varit svåra att utföra eftersom tillgängligheten är begränsad (4). Oklarhet vad gäller vem – landsting, myndigheter eller företag – som ansvarar för olika uppföljningsåtgärder inklusive analys och återföring har hittills bromsat utvecklingen av rationella arbetsmodeller. I Sverige har flera olika initiativ tagits för att förbättra möjligheterna till uppföljning av nya läkemedel. Ett exempel är sedan år 2010 ändrad lagstiftning som ger landstingen tillgång till krypterade individdata från Apotekens Service AB. Ett vaccinationsregister (ett hälsodataregister hos Smittskyddsinstitutet) har nyligen inrättats som kan användas för uppföljning av vaccinationer inom det nationella vaccinationsprogrammet. Inom Cancerstrategin, som har som övergipande syfte att förbättra behandling av cancersjukdomar, har ett särskilt läkemedelsprojekt kommit med förslag på nya former för introduktion och uppföljning av nya cancerläkemedel med utnyttjande av Regionala cancercentra. Arbetet med Öppna jämförelser och Socialstyrelsens uppföljning av indikatorer i Nationella riktlinjer, förbättrar möjligheterna till uppföljning av läkemedel. Flera lokala och regionala initiativ har tagits för ett ordnat införande medan strukturerad uppföljning implementerats i mindre utsträckning. Den satsning som nu görs på nationella kvalitetsregister kan förbättra möjligheterna till ordnat införande och strukturerad uppföljning. Exempelvis skulle randomiserad introduktion av en ny terapi inom kvalitetsregister vara ett sätt att utnyttja dessa. En tidigare inventering har emellertid visat på stora brister vad gäller omfattning och kvalitet i data om läkemedel i olika kvalitetsregister (5). Som framgår av kapitel 6 och Bilaga II i denna rapport ”Internationell utblick – exempel från andra europeiska länder” har flera EU-länder gjort försök med olika former av ”managed introduction”. En modell i Skottland (Scottish Medicines Consortium) har varit särskilt framgångsrik. Utvecklingen av innehåll och struktur vad gäller uppföljning har dock där – liksom i andra länder – varit långsammare än åtgärder relaterade till introduktion. Mot denna nationella och internationella bakgrund är det angeläget att sammanställa kunskap från olika modeller som kan omvandlas till rekommendationer för praktiskt genomförande av ordnat införande och strukturerad uppföljning. Nationella läkemedelsstrategin adresserar frågorna kring introduktion och uppföljning i ett flertal ansatser, mest tydligt i delprojekten 6.1 och 6.2. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 9 (75) Dessa båda delprojekt har dock relevans även för flera andra av den nationella läkemedelsstrategins mål – medicinska resultat och patientsäkerhet i världsklass; jämlik vård; kostnadseffektiv användning; och attraktivitet för produkter och tjänster – vilka alla kan nå bättre måluppfyllelse med hjälp av väl fungerande system för ordnat införande och strukturerad uppföljning. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 10 (75) 4. Uppdraget och dess genomförande 4.1. Uppdraget Uppdraget för nationella läkemedelsstrategins delprojekt 6.2 framgår i sin ursprungliga formulering i Figur 2. Läkemedelsverkets ansvar för projektet har senare förtydligats i och med att det inkluderats i verkets regleringsbrev för år 2012 och senare i form av ett tillägg till 2013 års regleringsbrev (april 2013). Figur 2. NLS-projekt 6.1 och 6.2 har flera berörningspunkter. Uppdragen beskrivs i rutorna nedan och deras respektive fokusområde illustreras av cirklarna. 6.2. Utveckla nationell modell för framtagande av införandeprotokoll samt inför samordnad utvärdering av läkemedel i den kliniska verkligheten. (Huvudansvarig: Läkemedelsverket) ”Genomförande av pilotprojekt där införandeprotokoll för utvalda läkemedel konstrueras som gör det möjligt att systematiskt undersöka vilka effekter och biverkningar det nya läkemedlet åstadkommer i klinisk vardag samt i vilken grad godkända indikationer, beslut från Tandvårds- och läkemedelsförmånsverket om begränsad subvention och läkemedelskommittéernas rekommendationer följs. Med erfarenhet från pilotprojekten utvecklas mer generella slutsatser och rekommendationer för utformning av införandeprotokoll och samordnad uppföljning av nyintroducerade läkemedel.” Beslutade ändringar i Läkemedelsverkets regleringsbrev 2013-04-04: …”Läkemedelsverket ska även identifiera och utvärdera projekt där olika modeller för uppföljning tillämpas inom följande områden: läkemedel med förmånsbegränsning, särläkemedel, minst ett läkemedel som kan följas via kvalitetsregister.” …”Slutrapportera den 15 november 2013”… 6.1. Upprätta en process mellan myndigheter, landsting och industri rörande ordnat införande av nya läkemedel. (Huvudansvarig: SKL) ”Upprättande av en process mellan myndigheter, landsting och industri rörande ordnat införande inklusive horizon scanning och prognostisering, informationen kring beslut om godkännande, subvention och nationella riktlinjer, kommunikation och dialog med medicinska experter och berörda förskrivare. Detta med utgångspunkt i tidigare erfarenheter av ordnat införande i landstingen.” Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 11 (75) 4.2. Projektets organisation, arbetssätt och deltagare En projektgrupp tillskapades på Läkemedelsverket under hösten 2011. Projektet organiserades för att få en god förankring bland avnämarna av resultaten av ordnat införande och strukturerad uppföljning, men också utifrån vilka pilotprojekt som identifierades som praktiskt möjliga att följa (se Figur 3). Figur 3. Skiss över hur arbetet med delprojekt 6.2 bedrivits. Styrgruppen, som speglar sammansättningen av nationella läkemedelsstrategins högnivågrupp, har varit ansvarig för inriktning av arbetet, prioriteringar och övergripande beslut. Läkemedelsverkets projektgrupp har utfört det löpande arbetet, framför allt vad gäller interaktionen med de utvalda pilotprojekten, ansvarat för rapporter till Centrum för bättre läkemedelsanvändnings (CBL) kansli med flera, och utarbetandet av slutrapporten. Sedan uppdraget även inkluderats i Läkemedelverkets regleringsbrev har myndighetens ansvar tydliggjorts. Målsättningen har dock varit att ha konsensus i styrgruppen kring alla viktiga beslut och slutsatser. En metodgrupp med särskild kompetens inom läkemedelsepidemiologi, läkemedelsuppföljning, läkemedelsstatistik med mera har fungerat som stöd i metodologiska frågor. För en förteckning över representanter i styr-, metod- och projektgrupp, se kapitel 13. För att besvara frågeställningar, specifika för de olika terapiområden som studerats, har kliniska experter inom Läkemedelsverket konsulterats. Enskilda medlemmar i styrgruppen och metodgruppen har bidragit särskilt i vissa delar av slutrapporten. Den kunskap som förmedlats av representanter för de olika pilotprojekten vid intervjuer, i skriftliga underlag med mera har varit avgörande för ett framgångsrikt genomförande av projektet. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 12 (75) 4.3. Tolkning av uppdraget Utformningen av uppdraget gällande delprojekt 6.2 har sin grund i de diskussioner som fördes i projektgruppen som utarbetade nationella läkemedelsstrategin, och speglar de olika önskemål som de medverkande aktörerna ville ha tillgodosedda. Den så kallade P16-gruppen hade tidigare gjort en tämligen heltäckande behovsinventering (2) så det var framför allt konkreta åtgärdsförslag som efterlystes. ”Det goda exemplet” föreslogs som ett sätt att beskriva olika användbara modeller, och det resulterade i förslaget att arbeta med pilotprojekt. Eftersom arbetsinnehållet blev omfattande gjordes en fördelning på två projekt, 6.1 och 6.2 (se Figur 2), det senare med fokus på att inhämta erfarenheter från pågående projekt om läkemedelsuppföljning i vården. Delprojektets styrgrupp har tolkat uppdraget för delprojekt 6.2 som att ansvaret för själva genomförandet av pilotprojekten skulle ligga i sjukvården och att delprojektet utvärderar dessa som underlag för ”generella slutsatser och rekommendationer för utformning av införandeprotokoll och samordnad uppföljning av nyintroducerade läkemedel”. 4.4. Avgränsningar Begreppet ”införandeprotokoll” kan tolkas på olika sätt. Med protokoll avses oftast en mycket detaljerad beskrivning, exempelvis av en klinisk läkemedelsprövning som ska genomföras. Delprojekt 6.2 har sett ”införandeprotokoll” som ett vidare begrepp som omfattar tidig värdering, inklusive hälsoekonomi, pris- och förmånsfrågor samt rekommendationer. I diskussion med delprojekt 6.1 har överenskommits att delprojektet 6.2 fokuserar på strukturerad uppföljning medan 6.1 tar huvudansvar för de delar som gäller ordnat införande inklusive horizon scanning. Introduktion och uppföljning av nya cancerläkemedel bedömdes som viktigt, men i samråd med delprojekt 6.1 beslöts att inte välja ett pilotprojekt inom cancerområdet eftersom det redan belysts inom cancerstrategins läkemedelsprojekt. Introduktion och uppföljning av medicintekniska produkter har inte heller berörts i denna rapport. Regelverket för medicintekniska produkter skiljer sig avsevärt från det för läkemedel, men när det gäller uppföljning bör utformningen i stor utsträckning kunna vara densamma. Juridiska aspekter på uppföljning har inte utretts inom ramen för detta delprojekt. 4.5. Samråd Tidigt (hösten 2011) inhämtades synpunkter framför allt på tänkbara pilotprojekt från aktörer som bedömdes ha en god överblick över vilka terapi-/läkemedelsområden som borde vara av allmänt intresse att studera. Bland aktörerna kan nämnas Nya läkemedelsterapier (NLT)-gruppen, Läkemedelskommittéernas ordförandekollegium (LOK), Sveriges kommuner och landsting (SKL) och dess kontaktmannagrupp samt företrädare för Nationella cancerstrategins läkemedelsprojekt. Samråd har skett med Socialdepartementet med avseende på tolkningen av uppdraget under projektets genomförande. Samverkan mellan delprojekten 6.1 och 6.2 har skett löpande för att undvika dubbelarbete. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 13 (75) För att få återkoppling på de val och prioriteringar som gjorts har projektet bland annat diskuterats med Läkemedelsverkets läkemedelsnämnd, Nationell Samverkansgrupp för Kunskapsstyrning (NSK), Svensk Läkemedelsepidemiologisk Förening (SLEF) liksom vid Läkarsällskapets Riksstämma 2012. Läkemedelsverkets projektgrupp har deltagit i seminarium och andra aktiviteter med Stockholms läns landsting vid deras arbete med att ta fram en Metodbok för läkemedelsuppföljning i landstinget. 4.6. Val av pilotprojekt Valet av pilotprojekt förankrades så brett som möjligt genom samråd som beskrivits ovan. Diskussionen kring pilotprojekt utgick från ett antal urvalskriterier: • Terapiområde med nyligen registrerade läkemedel eller med nya indikationer på väg att introduceras • Viktig frågeställning angående effekt/säkerhet som kräver nationell/flerlandstingsansats för att besvaras • Väsentlig ekonomisk/hälsoekonomisk betydelse • Misstänkt ojämlik förskrivning (över-, under-, geografiskt, kön) • Risk för ”off-label”förskrivning • Arbetsmodell som stimulerar samarbete och metodutveckling • Potentiellt attraktivt för läkemedelsutveckling och innovation • Kan potentiellt förbättra vårdens arbetssätt/organisation inom visst sjukdomsområde Kriterierna är ursprungligen avsedda för att identifiera läkemedel lämpliga för ordnat införande, men bedömdes också kunna styra valet av pilotprojekt. Förutom att uppfylla några av urvalskriterierna skulle pilotprojekten vara tillräckligt långt framme i sitt genomförande för att kunna utvärderas. Det senare innebar att vissa terapiområden som ansågs angelägna, exempelvis diabetes, ändå inte kunde prioriteras av styrgruppen. Särläkemedel valdes som ett prioriterat område med avseende på tilläggsuppdraget i Läkemedelsverkets regleringsbrev (april 2013). 4.7. Särskilda uppdrag Projektet har initierat tre uppdrag utförda av externa sakkunniga för att särskilt genomlysa i) internationella erfarenheter, ii) uppföljning av följsamhet till förmånsbegränsningar och behandlingsrekommendationer, samt iii) en samhällsekonomiskt inriktad utvärdering av utvalda pilotprojekt (se Bilaga II–IV). Det senare uppdraget har kompletterats med en särskild redovisning angående säkerhetsuppföljning med hjälp av kvalitetsregister (se bilaga 3 i Bilaga IV). Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 14 (75) 5. Pilotprojekt och andra modeller för ordnat införande och strukturerad uppföljning 5.1. Inledning 5.1.1. Utvalda pilotprojekt och modeller Med utgångspunkt från tidigare redovisade urvalskriterier prioriterade styrgruppen att följande projekt/modeller för ordnat införande och strukturerad uppföljning studerades: • Nya antikoagulantia inom o de landsting som är anslutna till kvalitetsregistret Auricula o Stockholms läns landsting o Västra Götalandsregionen • Nya antivirala läkemedel vid hepatit C inom 4-länsgruppen • Särläkemedlet Soliris vid paroxysmal nocturn hemoglobinuri (PNH) • Det förmånsbegränsade särläkemedlet Votubia vid tuberös skleros (TSC) • Kvalitetsregister – läkemedelsuppföljning inom Svensk Reumatologisk Förenings kvalitetsregister (SRQ/ARTIS) • Introduktionsprocess för nya vacciner i det nationella vaccinationsprogrammet Målsättningen var att pilotprojekten skulle spegla olika perspektiv av ordnat införande och strukturerad uppföljning, till exempel olika sjukdomar med varierande prevalens och tillgång till möjlig behandling med läkemedel. Andra viktiga aspekter var projektens olika metodik, ”mognadsgrad”, arbetssätt och potential att belysa eventuella framgångs- och problemfaktorer. Några av pilotprojekten är mer omfattande till sin karaktär. Till den gruppen hör projekten om ordnat införande av nya orala antikoagulantia och av nya antivirala läkemedel vid hepatit C. Dessutom studerades två mindre projekt som berör införande av särläkemedel vid sällsynta och allvarliga sjukdomar (PNH och TSC). De sistnämnda projekten har sin utgångspunkt i uppföljningskrav från EMA och TLV, vid godkännande av marknadsföringstillstånd respektive av läkemedelssubvention. Erfarenheter från ett väletablerat kvalitetsregisters arbete med införande av nya läkemedel studerades som ett eget projekt. Ett avsnitt om introduktion av vacciner i det nationella vaccinationsprogrammet har inkluderats då det är en viktig läkemedelsgrupp men som också har en i detalj utarbetad nationell process för introduktion, som saknar motsvarighet inom andra terapiområden. En sammanställning av de inkluderade pilotprojekten presenteras i Tabell I. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 15 (75) Tabell I. Sammanfattande beskrivning av studerade pilotprojekt med statistik över försäljning och antalet behandlade med för projekten aktuella läkemedel. Införande av Huvudman Läkemedel Start (antal invånare) Försäljning DDDa per 1000 invånare Antal individer som hämtat ut receptb 2013 kvartal 2 2012 2013 Kvartal Kvartal 4 2 Uppföljning juni 2013 (nivå) Pradaxa 2011 -dec 92 1 038 1 563 Xarelto 2012 -okt 89 223 983 - Pradaxa 2012 -feb 55 763 807 Basal Xarelto 2012 -dec 33 27 248 - Pradaxa 2011 -dec 1 670 2 429 Xarelto 2012 -okt 277 1 537 - 4-läns samarbete Incivo 2011 0,5 (Median)g -d -d - (5,4 miljoner) Victrelis 2011 0,2 (Median)g -d - d - Soliris 2011 0,2 -d -d - DDD saknas 5 11 - SLL Basal NOAK (2,1 miljoner) VGR NOAK (1,6 miljoner) Auricula NOAK (3,9 miljonere) Nya antivirala läkemedel hepatit C Eculizumab vid PNH Everolimus vid TSC PNH-gruppen (9,6 miljoner) Novartis (9,6 miljoner) Votubia - 49 (Median)f Min/Max (15–204) 41 (Median)f Min/Max (5–416) Basal (x 5 c) Avancerad (RS) NOAK = Nya orala antikoagulantia, PNH = Paroxysmal nocturn hemoglobinuri, TSC = Tuberös skleros, RS = Region Skåne a Totalförsäljning oavsett dos i enheten definierad dygnsdos (DDD) per tusen invånare (Källa: Consice, Apotekens Service AB) b Uthämtade recept av Pradaxa (110 och 150 mg) och Xarelto (15 och 20 mg) (Källa: Läkemedelsregistret) c Förskrivningsdata framtagna i fem län, enligt uppgifter som delgetts Läkemedelsverket d Klinikläkemedel, uppgift saknas om antal behandlade e Antal invånare i aktuella län oberoende av grad av användning av Auricula f Se figur 5 och 6 g Se figur 9 Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 16 (75) I detta kapitel ges en sammanfattande beskrivning av de studerade pilotprojekten. Beskrivningarna omfattar tiden från respektive projekts inledning och avslutas vanligen med projektets status i juni 2013 samt framtida planer. Merparten av pilotprojekten och modellerna som studerats beskrivs mer utförligt i Bilaga I, där även referenser anges. 5.1.2. Tre pilotprojekt inom området nya antikoagulantia Behandling med antikoagulantia (AK) har under många år bedrivits med regelbundna, relativt täta kontroller på särskilda mottagningar. Såväl för patienter som behandlare har det erbjudit en ovanligt tydlig strukturerad form av vård och uppföljning. De nya läkemedel som nu introduceras innebär en stor potentiell påverkan på vårdens organisation, förutom de nya medicinska frågeställningar som behöver hanteras. Sammantaget innebär det starka skäl till ordnat införande och strukturerad uppföljning för att ta hand om såväl medicinska som ekonomiska och strukturella konsekvenser av deras användning. De indikationer som är godkända för de aktuella AK-läkemedlen och som är föremål för ett ordnat införande, är profylax mot stroke vid förmaksflimmer (FF) samt behandling och förebyggande behandling av djup ventrombos (DVT) och lungemboli. Annan tidigare användning såsom korttidsprofylax mot venös trombos i anslutning till ortopedisk kirurgi, innefattas inte i det ordnade införandet. Innan de nya AK-läkemedlen var tillgängliga behandlades de aktuella sjukdomarna med warfarin och/eller med lågmolekylärt heparin. Prevalensen AK-behandlade beskrivs i en svensk studie. Där påvisas att 42 % av alla patienter hämtat ut ett recept på warfarin i anslutning till den första vårdkontakten på grund av förmaksflimmer. I åldersgruppen 70-75 år var andelen som högst (~59 %). Det anses allmänt inom professionen att fler patienter med förmaksflimmer bör behandlas med AK-läkemedel. De nya läkemedel som är aktuella för ordnat införande är dabigatran (Pradaxa) och rivaroxaban (Xarelto). De blev i praktiken tillgängliga från december 2011 respektive oktober 2012. Dabigatran är endast aktuellt på indikationen förmaksflimmer i motsats till rivaroxaban som även är godkänt vid DVT och lungemboli. De båda preparaten har en relativt likvärdig effekt och biverkningsprofil, liknande warfarin. I Figur 4 visas tidslinjen för olika moment i godkännandeprocessen för de aktuella läkemedlen. Vid sidan av dessa substanser finns även ett annat nytt antikoagulantia – apixaban (Eliquis) – tillgängligt i Sverige, men det har inte varit aktuellt för ordnat införande under den studerade perioden, eftersom TLV först i juni 2013 beslutade att Eliquis ska ingå i läkemedelsförmånen. Gemensamt för dabigatran och rivaroxaban är att de till stor del utsöndras via njurarna om än i olika grad, och att njurfunktionen ska kontrolleras regelbundet vid behandling. Preparatens egenskaper medför att utebliven dos kan få större konsekvenser och följsamhet till behandlingen bedöms som viktig. Det finns ingen känd antidot till något av de nya läkemedlen men tillförsel av koagulationsfaktorer kan ha viss neutraliserande effekt. Kostnaden för de nya läkemedlen har beräknats till cirka 20 kronor per dag för dabigatran respektive rivaroxaban, vilket ska jämföras med cirka 2 kronor per dag för warfarin. De nya läkemedlen förväntas leda till färre återbesök än vid behandling med warfarin, en förenkling för patienten men med en möjlig risk för försämrad följsamhet. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 17 (75) Gemensamt är att alla AK-läkemedel ökar risken för allvarliga blödningar, men vissa skillnader i typ och frekvens av blödning har noterats vid behandling med de nya läkemedlen i jämförelse med warfarin. Ett antal bedömare, däribland Läkemedelsverket, anser att det utifrån svenska förhållanden, inte går att dra några säkra slutsatser om skillnader i effekt och säkerhet mellan de nya läkemedlen eftersom relevanta jämförande studier saknas. I samband med de nya AK-läkemedlens kliniska introduktion i Sverige aktualiserades ett flertal frågeställningar, till exempel hantering i akuta sammanhang eller vid operation. Dessa har beretts av Svenska Sällskapet för Trombos och Hemostas (SSTH) som har utarbetat kliniska råd med en bred förankring inom professionen. Figur 4. Tidslinje för godkännandeprocesser för aktuella nya AK-läkemedel i förhållande till ordnat införande. Förkortningar: FF= Förmaksflimmer, DVT= Djup ventrombos, TLV= Tandvårds- och läkemedelsförmånsverket 5.2. Ordnat införande av nya orala antikoagulantia i Auriculas regi 5.2.1. Auricula Auricula är ett kvalitetsregister och doseringsstöd som sedan 2006 används vid läkemedelsbehandling med perorala antikoagulantia (AK). Auricula bildades med utgångspunkten att underlätta behandling med warfarin och att möjliggöra en nationell uppföljning. Idag används Auricula inom totalt 14 landsting och mer än 100 000 AK-behandlade patienter har inkluderats. 5.2.2. Ordnat införande av nya AK-läkemedel i Auricula Projektet Ordnat införande och strukturerad uppföljning i Auriculas regi utgår från Auriculas normala verksamhet i tio av de landsting som ingår i Auricula. Någon specifik projektorganisation för ordnat införande har inte tillsatts. De huvudmän som är aktuella är Region Skåne, Region Halland, Landstingen i Västmanland, Örebro, Uppsala, Gävleborg, Dalarna, Jämtlands län, Västernorrland och Västerbottens län. Befolkningsunderlaget utgör cirka 3,9 miljoner individer. Region Skåne är störst och är drivande i projektet och inom Auricula. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 18 (75) Det har inom Auricula inte utarbetats några gemensamma riktlinjer för införande eller uppföljning av de nya AK-läkemedlen, utan deras introduktion och användning varierar utifrån lokala riktlinjer och tidigare inarbetade lokala rutiner. Riktlinjer för de nya läkemedlen har framtagits i de aktuella landstingen som i vissa fall är gemensamma. De berör vanligen behandling med dabigatran vid förmaksflimmer och påtalar när och hur användning ska ske. I de flesta riktlinjer anges att warfarin är förstahandsmedlet och i övriga anges att ”såväl warfarin som dabigatran” kan användas. Alla riktlinjer anger omständigheter när det är lämpligt att välja dabigatran, mestadels kopplat till problem med warfarin. Exempel är alltför varierande värden på International Normalized Ratio (INR) eller interaktionsrisk med andra läkemedel. Tre landsting har även utarbetat liktydiga riktlinjer för rivaroxaban vid förmaksflimmer, utan någon prioritering av något av de nya läkemedlen. Gemensamt för alla riktlinjer är att behandlade patienter ska följas på ett strukturerat sätt i Auricula. Uppföljning av njurfunktionen ska ske enligt riktlinjer, med undantag för ett län som anger att njurfunktionen ska följas upp enligt klinikrutiner. Doseringsstödet har också anpassats till de nya behandlingarna, med introduktion av två nya moduler. 5.2.3. Uppföljning Uppföljningen av behandlingen med de nya AK-läkemedlen utgår från data som genererats i Auriculas databas, och sker enligt tidigare framtagna lokala och centrala rutiner i Auricula. Uppföljningen av effekt och säkerhet baseras på doseringsverktygets rapportfunktion, som fungerar fullt ut för warfarin men har försenats för behandlingen med dabigatran och rivaroxaban. När rapportfunktionen är i drift (under hösten 2013) kan övergripande uppföljning av de nya AKläkemedlens införande göras på enhets-, regional och nationell nivå, inom hela Auricula under styrgruppens ledning. Inom Auricula har inga övergripande frågeställningar formulerats men traditionella mått som trombos, allvarlig blödning och död beskrivs vara aktuella. 5.2.4. Utfall i juni 2013 Det ordnade införandet har skett inom befintliga resurser inom de aktuella länen. Inför införandet av de nya läkemedlen har ett antal utbildnings- och informationsaktiviteter av varierande omfattning genomförts. Införandet inom Auricula har skett med skiftande grad av organisation, allt från Region Skånes mycket strukturerade och forskningsinriktade arbetssätt till den uppföljning som sker i det vardagliga arbetet i andra landsting. Mest resurskrävande i arbetet med ordnat införandet har varit implementeringen i sjukvården och utvecklingen av doseringsstödet, enligt företrädare för Auricula. På grund av tekniska begränsningar har det inte gått att göra en övergripande sammanställning av uppgifter om effekt och säkerhet vid behandling med de nya AK-läkemedlen. Någon sammanställning av antal behandlade är inte tillgänglig (juni 2013). Basal uppföljning av förskrivningsdata från fem län har presenterats för Läkemedelsverket. En begränsad, avancerad analys har gjorts i Region Skåne (161 patienter). Uppgift om antal personer inom Auricula som har hämtat ut de nya läkemedlen på apotek i doser anpassade för aktuella indikationer, har erhållits från Socialstyrelsens Läkemedelsregister. Under det andra kvartalet 2013 hämtade 2 429 personer ut recept på dabigatran (110 och 150 mg) och 1 537 personer recept på rivaroxaban (15 och 20 mg). Motsvarande siffror för fjärde kvartalet 2012 var 1 670 respektive 277 personer. Försäljningsstatistik i definierade dygnsdoser (DDD) per 1 000 invånare för dabigatran och rivaroxaban inom aktuella landsting presenteras i Figur 5 och 6. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 19 (75) Figur 5. Tidslinjer för ordnat införande och försäljning av dabigatran inom de län/landsting som är anslutna till Auricula. Total försäljning (alla doser) i DDD per 1000 invånare och kvartal. (Källa: Concise, Apotekens Service AB) Förkortningar: DDD = Definierad dygnsdos, FF = Förmaksflimmer, DVT = Djup ventrombos, TLV = Tandvårds- och Läkemedelsförmånsverket Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 20 (75) Figur 6. Tidslinjer för ordnat införande och försäljning av rivaroxaban inom de län/landsting som är anslutna till Auricula. Total försäljning (alla doser) i DDD per 1000 invånare och kvartal. (Källa: Concise, Apotekens Service AB) Förkortningar: DDD = Definierad dygnsdos, FF = Förmaksflimmer, DVT = Djup ventrombos, TLV = Tandvårds- och Läkemedelsförmånsverket 5.2.5. Framtid Det ordnade införandet av de nya AK-läkemedlen kommer att fortgå inom Auriculas normala verksamhet och utvidgas från juni 2013 till att även inkludera läkemedel som innehåller apixaban. 5.2.6. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet • Auricula har en väl etablerad och fungerande infrastruktur och organisation med förutsättningar att vara en bra bas för införande- och uppföljningsprojekt. De publika årsrapporter som studerats bekräftar den bilden. • Det aktiva arbete med uppföljning av förskrivning och säkerhet som bedrivs inom Region Skåne ter sig som ett föredöme som kan stimulera andra till ett liknande arbetssätt. • Auricula har en potential att i realtid fånga data från ett stort antal behandlade patienter för bedömning av effekt och säkerhet vid behandling med de nya läkemedlen. Svagheter med projektet • Om målet är att uppföljning ska kunna göras omgående efter introduktion av nya läkemedel måste planering av tekniska lösningar vara i tidsmässig fas och adekvat resurssatta. Trots ett inarbetat elektroniskt doseringsverktyg uppkommer en försening av rapportfunktionen för de nya läkemedlen, vilket anges ha ekonomiska orsaker. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 21 (75) Utvecklingsmöjligheter • 5.3. Auriculas potential med avseende på mängd inkluderade patienter och möjlig uppföljning synes inte utnyttjas fullt ut. Avancerad uppföljning av effekt och säkerhet kräver en forskningsansats samt samordning, lämpligtvis under styrgruppens ledning. Ordnat införande av nya orala antikoagulantia i Stockholms läns landsting Ordnat införande-processer inom Stockholms läns landsting (SLL) har en mer än tio år lång historia, vilket skapat en bred kompetens på området. Projektet om ordnat införande av nya antikoagulantia (AK) är ett delprojekt i ett större överordnat projekt (Innovis) och bygger på SLL:s modell för ordnat införande. I modellen ingår framtidsspaning efter nya läkemedel (horizon scanning), beräkning av budgetpåverkan, utarbetande av riktlinjer och kommunikationsplan samt en organisation för uppföljning och återkoppling. Inom SLL sker huvuddelen av all AK-behandling inom primärvården men sjukhusbunden vård förekommer. Vården dokumenteras huvudsakligen i journalsystemet TakeCare. Primärvården har delvis andra journalsystem (~40 %) och externa ordinationsverktyg för AK-läkemedel används på vissa sjukhus. I TakeCare ska en speciell AK-journal användas när förskrivning är aktuell. Projektet om ordnat införande av nya AK-läkemedel inleddes under 2011 på initiativ av bland annat SLL:s läkemedelskommitté. Inom SLL anger riktlinjer att warfarin är förstahandsmedel vid de aktuella indikationerna och att de nya preparaten (dabigatran och rivaroxaban) kan användas under vissa förutsättningar. Exempel är alltför varierande värden på INR eller när interaktionsrisk med andra läkemedel föreligger. Vid användning av de nya läkemedlen ska behandlande läkare genomföra riskskattning och fortlöpande följa njurfunktionen. 5.3.1. Uppföljning Journalsystemet TakeCare och SLL:s interna administrativa databaser utgör grunden för uppföljning av de nya AK-läkemedlen och bygger på att data kan extraheras automatiskt. Efter sammanlänkning av dessa och andra, externa register kan analys av bland annat förskrivningsmönster, effekt och säkerhet göras. Metoden som är avancerad och erbjuder bland annat anonymiserade datauttag, är delvis under utveckling. Metoden har varit underlag för flera vetenskapliga publikationer. I riktlinjer har inga specificerade frågeställningar för uppföljning formulerats, men traditionella mått som trombos och allvarlig blödning är aktuella. Ansvarig för uppföljning är antikoagulantiagruppen, en expertorganisation inom SLL. Uppföljningen sker månadsvis. 5.3.2. Utfall i juni 2013 Projektet har pågått under drygt två år med en stabil organisation som har haft adekvata resurser samt en god förankring i professionen. Ett aktivt, utåtriktat informations- och utbildningsarbete om de nya terapierna och SLL:s riktlinjer har genomförts, riktat till läkare, vårdpersonal och patienter. Ett etablerat webbaserat förskrivarstöd (www.janusinfo.se) har utnyttjats för fortlöpande information. Det har hittills inte gjorts någon övergripande analys av effekt och säkerhet vid behandling med de nya läkemedlen inom SLL. En retrospektiv tvärsnittsstudie med förskrivningsmönster av dabigatran och warfarin till patienter med förmaksflimmer är publicerad, baserad på data från augusti 2011 till och med september 2012. Under perioden utfärdades recept på dabigatran till 1 010 individer varav 40,5 % var kvinnor. Cirka 100 nya patienter per månad startade behandling med dabigatran. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 22 (75) Förskrivningen har utvecklats enligt plan och uppfattas ha varit avvaktande till äldre patienter med riskfaktorer. Förskrivningen av warfarin bedöms inte ha påverkats. Någon analys av förskrivning av rivaroxaban har inte gjorts men beskrivs pågå. Projektet har medfört en ökad medvetenhet inom professionen om vikten av behandling med AK-läkemedel vid förmaksflimmer. Försäljningsstatistik inom SLL för dabigatran och rivaroxaban i relation till dessa läkemedels introduktion i Sverige, presenteras i Figur 7. Uppgift om antal personer inom SLL som hämtat ut de nya läkemedlen på apotek i doser anpassade för aktuella indikationer, har erhållits från Socialstyrelsens Läkemedelsregister. Under det andra kvartalet 2013 hämtade 1 563 personer ut recept på dabigatran (110 och 150 mg) och 983 personer recept på rivaroxaban (15 och 20 mg). Motsvarande siffror för fjärde kvartalet 2012 var 1 038 respektive 223 personer. Figur 7. Tidslinjer för ordnat införande och försäljning av dabigatran och rivaroxaban inom Stockholms läns landsting. Total försäljning (alla doser) i DDD per 1000 invånare och kvartal. (Källa: Concise, Apotekens Service AB) Förkortningar: DDD = Definierad dygnsdos, FF = Förmaksflimmer, DVT = Djup ventrombos, TLV = Tandvårds- och Läkemedelsförmånsverket, RL = Riklinjer 5.3.3. Framtid Projektet avslutas i december 2013 och övergår troligen därefter i förvaltning. 5.3.4. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet • Projektet är väl förankrat med en stark organisation med adekvata resurser och mandat. • En bred kompetens och mångårig erfarenhet av ordnat införande och strukturerad uppföljning finns att tillgå i projektet. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 23 (75) • Uppföljningen kräver ingen extra dokumentation av vårdgivare utan bygger på den vårddokumentation som sker oberoende av projektet. • Projektet har medfört en utveckling av befintliga strukturer för ordnat införande och strukturerad uppföljning inom SLL. • Metoden för uppföljning bygger på direktextraktion från journalsystem och har förutsättningar att appliceras på andra sjukdomsområden. Svagheter med projektet • Uppföljningen baseras på hög användning av journalsystemet TakeCare och är delvis beroende av täckningsgraden för journalmallen vid AK-behandling. • Den avancerade metoden för uppföljning erbjuder stora möjligheter men bedöms kräva stora resurser för utveckling och sammanställning, som hittills skett i forskningssammanhang. Utvecklingsmöjligheter • Införandet av de nya läkemedlen har varit begränsat i SLL. För att få tillgång till tillräckligt underlag för bedömning av effekt och säkerhet krävs någon form av ökat samarbete. Ett alternativ skull kunna vara att utveckla redan inarbetade kanaler inom 4-länsgruppen, vilket har potentialen att radikalt öka mängden av bedömbar information. 5.4. Ordnat införande av nya orala antikoagulantia i Västra Götalandsregionen 5.4.1. Ordnat införande i Västra Götalandsregionen Inom Västra Götalandsregionen (VGR) tillämpas en organisation för ordnat införande av nya läkemedel och metoder som kan tilldelas en regiongemensam finansiering. Läkemedel som är aktuella kan nomineras för ordnat införande, bland annat av läkemedelskommitté eller vårdprogramoch terapigrupper. Efter accepterad nominering vidtar en omfattande berednings- och beslutsprocess i regi av program- och prioriteringsrådet (PPR). Det slutgiltiga beslutet om ordnat införande fattas av Hälso- och sjukvårdutskottet. 5.4.2. Ordnat införande av nya orala antikoagulantia i VGR I VGR nominerades dabigatran för ordnat införande i december 2010 på indikationen prevention av stroke vid förmaksflimmer. Beslutsprocessen hade inletts i juni 2010 och påverkades av samtidiga nationella granskningar av dabigatran. I februari 2012 fastställdes att dabigatran ska införas i VGR på ett ordnat och strukturerat sätt, med en introduktionsfinansiering på 14,8 miljoner kronor för 2012. Införandet regleras i regionala riktlinjer och vårdprogram som utarbetats under beslutsprocessen. I riktlinjerna anges att warfarin är förstahandsmedlet för prevention av stroke vid förmaksflimmer. Dabigatran kan användas till de patienter som har eller förväntas få problem vid behandling med warfarin, till exempel vid överkänslighet, svårkontrollerad behandling eller interaktionsrisk. Ansvarig för behandlingen är enligt riktlinjerna den ordinerande läkaren, som även ska remittera patienten till en AK-mottagning för uppföljning och – om man så önskar – kontroll av njurfunktionen. AK-mottagningarna inom VGR är normalt ansvariga för behandling med warfarin. För dokumentation av ordinationer och utfall används ett vårddataregister – Journalia – som är väsentligen fristående från ordinarie vårdjournal. Samma register ska även användas för dokumentation av behandlingen med dabigatran och utgör också underlag för den strukturerade uppföljningen. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 24 (75) I februari 2012 nominerades rivaroxaban för ordnat införande på indikation djup ventrombos (DVT). Beslut om ordnat införande togs i december 2012 med en regiongemensam finansiering på 1,5 miljoner kronor under 2013. Under beredningsprocessen fastställdes att warfarin är förstahandsmedlet vid DVT och att användning av rivaroxaban ska ha samma begränsning som dabigatran, enligt ovan. Prioriteringen av warfarin har inte förankrats i VGR:s regionala vårdprogram för venös tromboembolism. 5.4.3. Uppföljning För uppföljning av dabigatran används data som registrerats i vårddataregistret Journalia. Även behandling med rivaroxaban kan följas i registret, om än i liten praktisk omfattning. Samkörning med andra externa och interna register är planerad. Initialt i processen saknades en organisation för övergripande uppföljning. Under hösten 2012 gavs ansvaret för uppföljning till expertorganisationen Område Läkemedel, med ansvar för medicinsk uppföljning delegerat till Klinisk Farmakologi på Sahlgrenska Universitetssjukhuset. 5.4.4. Utfall i juni 2013 Det ordnade införandet av dabigatran på indikationen förmaksflimmer har under 2013 övergått i vanlig klinisk användning, analogt med inarbetade rutiner och riktlinjer. För rivaroxaban fortgår införandet på indikationen DVT om än i mindre omfattning. I juni 2013 uppskattas att cirka 500 patienter har behandlats med dabigatran och cirka 70 patienter med rivaroxaban inom VGR utgående från data i Journalia, i huvudsak på ovanstående indikationer. Av den regiongemensamma finansieringen för dabigatran som endast avsåg 2012, har 9 % utnyttjats vilket motsvarar 353 behandlade patienter. Användningen prognostiserades till cirka 1 800 patienter under 2012. Vissa tecken på bristande följsamhet med att remittera behandlade patienter till AKmottagningarna har noterats för dabigatran. Det har inte gjorts någon övergripande analys av effekt och säkerhet vid behandling med dabigatran eller rivaroxaban inom VGR, eftersom användningen och därmed datamängden har blivit så liten. Försäljningsstatistik för dabigatran och rivaroxaban inom VGR presenteras i Figur 8, i relation till respektive läkemedels ordnat införande-process. Uppgift om antal personer inom VGR som hämtat ut de nya läkemedlen på apotek i doser anpassade för aktuella indikationer, har erhållits från Socialstyrelsens Läkemedelsregister. Under det andra kvartalet 2013 hämtade 807 personer ut recept på dabigatran (110 och 150 mg) och 248 personer recept på rivaroxaban (15 och 20 mg). Motsvarande siffror för fjärde kvartalet 2012 var 763 respektive 27 personer. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 25 (75) Figur 8. Tidslinjer för ordnat införande och försäljning av dabigatran och rivaroxaban i VGR. Total försäljning (alla doser) i DDD per 1000 invånare och kvartal. (Källa: Concise, Apotekens Service AB) Förkortningar: DDD = Definierad dygnsdos, OI = Ordnat införande, TG = Terapigrupp, DVT = Djup ventrombos, FF = Förmaksflimmer, PPR = Program- och Prioriteringsrådet 5.4.5. Framtid Under våren 2013 nominerades båda substanserna tillsammans med apixaban för ordnat införande till patienter med förmaksflimmer som tidigare haft stroke/transitorisk ischemisk attack (TIA). Under sommaren 2013 beslutade PPR att de nominerade läkemedlen ska genomgå en särskild beredningsprocess och ett seminarium kommer genomföras med berörda experter i regionens kunskapsorganisation. Ett samordnat förslag till beslut om ordnat införande är planerat att läggas fram under hösten 2013. 5.4.6. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet • Beslutsprocessen i VGR för ordnat införande är väletablerad och kan vid en snabb process säkerställa att nya läkemedel och metoder införs på ett ordnat sätt. • Förutsättningarna inom VGR för ett ordnat införande av nya AK-läkemedel var goda, med inarbetade rutiner för behandling och uppföljning kring AK-behandling. • Införandet av dabigatran i VGR synes väsentligen ha skett i fas med att försäljning/användning var möjlig. En snabb och kliniskt förankrad process i fas med regulatoriska och andra godkännanden är viktig för styrning av ordnat införande-processer. Svagheter med projektet • Organisationen för uppföljning uppfattas ha varit eftersatt initialt. De praktiska konsekvenserna är troligtvis begränsade, eftersom introduktion av dabigatran har gått långsamt. En tidig planering av en organisation för uppföljning synes viktig. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 26 (75) • Noterade tecken på brister i följsamhet vad gäller registrering av behandlade patienter enligt riktlinjer, kan vara ett uttryck för ett begränsat ”oordnat” införande. Det selektiva bortfallet som blir följden riskerar att förhindra adekvat analys. • Inom VGR har förskrivningen av rivaroxaban hittills varit begränsad. Behandlingen har etablerats utan att processer för ordnat införande varit implementerade. Detta kan sannolikt förklaras av en utdragen beslutsprocess för ordnat införande. Utvecklingsmöjligheter • Efter initiala oklarheter om organisationen för uppföljning, har adekvat tillgång till läkemedelsepidemiologisk kunskap säkrats. Det möjliggör en fördjupad uppföljning som utifrån sin komplexitet kan kräva en forskningsansats. • Införandet av de nya läkemedlen har varit begränsat i VGR. För att få tillgång till tillräckligt underlag för bedömning av effekt och säkerhet krävs någon form av ökat samarbete. Ett alternativ skull kunna vara att utveckla redan inarbetade kanaler inom 4-länsgruppen, vilket har potentialen att radikalt öka mängden av bedömbar information. • Informationsspridningen om ordnat införande via det webbaserade Vårdgivarstödet kan utvecklas, till exempel genom att få högre prioritet i det befintliga journalsystemet. 5.5. Ordnat införande av nya direktverkande antivirala läkemedel som behandling av hepatit C – ett 4-länssamarbete 5.5.1. Varför ordnat införande? De fyra landstingen/regionerna – Stockholm läns landsting (SLL), Västra Götalandsregionen (VGR), Region Skåne (RS) och Landstinget i Östergötland (LiÖ) – ville med utgångspunkt från införandet av nya antivirala läkemedel vid hepatit C i respektive län, arbeta fram ett underlag för en gemensam generisk process för ordnat införande och uppföljning. 5.5.2. Aktuell sjukdom – hepatit C Hepatit C är en virussjukdom som huvudsakligen sprids via blod och orsakar en inflammation av levern. Den vanligaste smittvägen är delade sprutor vid intravenöst missbruk. Drygt hälften av de som smittas drabbas av en kronisk infektion som kan utvecklas till levercirros och cancer. Det finns sex genotyper av hepatit C, varav genotyp 1 är vanligast. Målet vid behandling är att förhindra uppkomst av levercirros och därpå följande komplikationer. När inga virusnivåer (HCV-RNA) kan uppmätas i blodet 24 veckor efter avslutad behandling anses man botad. Uppskattningsvis har 40 000–50 000 personer i Sverige sjukdomen och under 2012 fick 1 977 personer diagnosen, varav 1 084 var skrivna i de fyra deltagande landstingen/regionerna. 5.5.3. Tidigare behandling Före 2011 behandlades hepatit C med kombinationer av substanserna ribavirin och interferon. Behandlingen resulterade i att 50 % av de behandlade patienterna med genotyp 1 botades, men var förenad med avsevärda biverkningar. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 27 (75) 5.5.4. Nya läkemedel – aktuella för ordnat införande Under 2011 godkändes två nya antivirala läkemedel på indikationen hepatit C genotyp 1: Victrelis (boceprevir) och Incivo (telaprevir). De nya läkemedlen förbättrar prognosen för sjukdomen och behandlingstiderna kan förkortas hos många patienter, framför allt med telaprevir. Behandlingen sker i kombination med substanserna ribavirin och interferon, vars kända blodbiverkningar, till exempel anemi, förstärks. De nya läkemedlen är dyrare och förväntas medföra en ökad kostnad om 155 000–235 000 kronor per patient och år, beroende på val av preparat och behandlingstid. Tidigare behandlingar kostade cirka 160 000 kronor per patient och år. Sedan 2011 ingår Incivo i läkemedelsförmånen, men båda preparaten är kostnadsfria för patienten eftersom hepatit C bedömts som en allmänfarlig sjukdom enligt smittskyddslagen. Behandlingsrekommendationer för de nya läkemedlen utarbetades 2011 av Läkemedelsverket och Referensgruppen för AntiViral terapi (RAV) och är väl accepterade i de fyra landstingen/regionerna. Under 2014 förväntas andra läkemedel för behandling av hepatit C att introduceras. Dessa preparat förväntas vara lindrigare för patienten, med bland annat skonsammare biverkningar. Därför avstår man redan idag från att behandla vissa patienter med telaprevir eller boceprevir. 5.5.5. Aktuellt projekt inom de fyra landstingen/regionerna Projektet har sin utgångspunkt i ett flerårigt samarbete mellan de fyra landstingen/regionerna som inleddes under 2008. Syftet är att kartlägga vad som kan göras gemensamt utifrån införandet av de nya antivirala läkemedlen snarare än att driva och genomföra ett eget regelrätt ordnat införandeprojekt. Initiativet till projektet togs under 2011 av respektive läns läkemedelsenhet och en arbetsgrupp tillsattes. Under ledning av projektets styrgrupp har arbetsgruppen under 2011 till 2013 byggt upp ett nätverk med ett antal infektionsläkare. Ett flertal kartläggningar har också genomförts i de fyra landstingen/regionerna med anledning av de nya läkemedlen, med utgångspunkt från bland annat budgetpåverkan, riktlinjer, beslut om introduktion, kommunikation, utbildning och uppföljning. För uppföljning av behandlingsutfall planerades att ett webbaserat beslutstöd – InfCare Hepatit – skulle användas inom projektet. InfCare Hepatit är utvecklat och ägs av två infektionskliniker och används med varierande täckningsgrad i de fyra länen, på de 13 infektionskliniker som är aktuella. InfCare Hepatit har en egen och från projektet oberoende styrgrupp. Arbetet har sedan projektstarten skett med begränsade resurser och mandat mot aktuella infektionskliniker. Arbetsgruppen har försökt att förankra projektet hos kliniskt aktiva infektionsläkare, men bristande resurser har utgjort ett hinder. 5.5.6. Utfall i juni 2013 Projektet har i juni 2013 inte lyckats få tillgång till några behandlingsuppgifter i InfCare Hepatit avseende de nya läkemedlen, för bedömning av effekt och säkerhet. Ett registeruttag från Socialstyrelsens Läkemedelsregister visar att sammanlagt 350 personer i de fyra landstingen/regionerna, någon gång under 2012 hämtat ut ett recept för telaprevir (n= 325) eller boceprevir (n= 25). Antalet behandlade är i vissa län färre än förväntat. En förklaring uppges vara att många patienter avråds från behandling, i väntan på mer effektiva kommande behandlingar. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 28 (75) Enligt en grov skattning av Läkemedelsverket har de nya läkemedlen medfört en ökad kostnad på cirka 53–79 miljoner kronor i de fyra landstingen/regionerna under 2012, givet siffror från TLV och VGR. Försäljningsstatistik för boceprevir och telaprevir i aktuella regioner i relation till respektive läkemedels introduktion i Sverige, presenteras i Figur 9. Figur 9. Tidslinjer för ordnat införande och försäljning av telaprevir och boceprevir inom 4-länsgruppen. Total försäljning (alla doser) i DDD per 1000 invånare och kvartal. (Källor: Concise, Apotekens Service AB. Årliga incidenssiffror för hepatit C från Smittskyddsinstitutet.) Errata: Figur 9 rättad och utbytt pga färgförväxling i diagram 2014-03-21 Förkortningar: DDD = Definierad dygnsdos, RS = Region Skåne, SLL = Stockholms läns landsting, VGR = Västra Götalandsregionen, LiÖ = Landstinget i Östergötland 5.5.7. Framtid På grund av svårigheterna beroende på tids- och resursbrist har styrgruppen under 2013 beslutat om ändrad inriktning. Arbetsgruppen har fått uppdraget att sammanställa erfarenheter från projektet för tiden 2011–2012 och kommer inte att arbeta vidare med hela syftet/frågeställningen. Enligt en preliminär tidsplan kommer en studierapport lämnas till styrgruppen 31 december 2013. SLL har också i form av ett examensarbete åtagit sig att göra en registeruppföljning där övriga län kommer att bidra i möjligaste mån. 5.5.8. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet Projektet har gett arbetsgruppen viktiga erfarenheter och kunskaper om problem vid ordnat införande-processer. Tack vare en kompetent arbetsgrupp har med mycket begränsade resurser ett kontaktnät utvecklats och adekvata frågeställningar identifierats. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 29 (75) • Projektet hade bra förutsättningarna att lyckas givet en väl avgränsad diagnos, ett begränsat antal kliniker och patienter samt ett befintligt IT-verktyg. Svagheter med projektet • Projektet har haft begränsade resurser trots en relativt stor ekonomisk belastning av de nya läkemedlen inom de fyra länen. • Projektet har haft begränsat mandat i förhållande till berörda kliniker. • Projektets företrädare har inte haft någon kontroll över uppföljningsverktyget. • Initiativet har utgått från en administrativ nivå i respektive landsting/region och har utifrån de bristande resurserna inte fått den kliniska förankring som varit nödvändig för projektet. Utvecklingsmöjligheter • Denna form av samarbete kan användas för insamlande av aggregerade data även inom andra terapiområden. 5.6. Ordnat införande och strukturerad uppföljning av eculizumab vid paroxysmal nokturn hemoglobinuri 5.6.1. Varför ordnat införande? När läkemedlet Soliris (eculizumab) under 2007 godkänts för behandling av Paroxysmal Nokturn (nattlig) Hemoglobinuri (PNH) och det framkom att behandlingen skulle medföra en mycket hög kostnad per behandlad patient, såg en grupp hematologer behovet av att arbeta fram nationella riktlinjer för behandling av PNH. De ville skapa förutsättningar att ge behandling med eculizumab till svenska PNH-patienter och säkerställa att behandlingen ges på rätt indikation med en transparent motivering. Det fanns också ett regulatoriskt krav på företaget Alexion Pharma Nordics AB att följa upp Soliris i ett register. 5.6.2. Aktuell sjukdom – Paroxysmal Nokturn Hemoglobinuri PNH är en mycket sällsynt och allvarlig genetisk stamcellssjukdom. Prevalensen i Sverige skattas till cirka 140 personer varav 40 har en allvarligare form. Per år beräknas 8–12 personer insjukna. Sjukdomen leder till ett försämrat skydd för blodets alla celler med bland annat cellsönderfall av röda blodkroppar (hemolys) som resultat. Följderna blir blodbrist (anemi), ökad trombos- och infektionsrisk, risk för njur-, hjärt- och lungpåverkan, försämrad livskvalitet och förkortad livslängd. 5.6.3. Tidigare behandling Sedan tidigare används stamcellstransplantation som är potentiellt botande men är förenad med väsentliga medicinska risker. Anemin behandlas i allvarliga fall med återkommande blodtransfusioner och för att förhindra tromboser ges ofta warfarin. PNH kan även påverka glatt muskulatur (sväljningssvårigheter, buksmärtor, erektil dysfunktion), lungor (pulmonell hypertension) och njurar. Svårare fall av sjukdomen kan ge en avsevärd påverkan på livskvaliteten. Behandlingen av PNH är beroende av vilka symtom patienten har och hur allvarliga de är. Påverkan på lungor, hjärta och njurar åtgärdas när behandlingsbehov uppstår. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 30 (75) 5.6.4. Aktuellt läkemedel – Soliris (eculizumab) Eculizumab är en monoklonal antikropp som hämmar det sönderfall av röda blodkroppar som PNH orsakar. Effekten blir att behovet av blodtransfusioner minskar och att risken för tromboser reduceras markant. Eculizumab kan även ha en positiv effekt på PNH-relaterade komplikationer såsom pulmonell hypertension och nedsatt njurfunktion. Det har visats att behandling med eculizumab vid svår PNH leder till en förbättrad livskvalitet, och det finns indikationer på att behandlingen ger en förlängd överlevnad. Allvarliga biverkningar finns beskrivna men är sällsynta, vanligast är infusionsrelaterad huvudvärk och en ökad känslighet för meningokockinfektion. Eftersom PNH är en mycket sällsynt sjukdom är befintliga effekt- och säkerhetsdata baserade på ett begränsat kliniskt underlag. Inför godkännandet var 195 patienter behandlade inom ramen för kliniska prövningar. Den godkända indikationen för Soliris är ”… behandling av patienter med Paroxysmal nokturn hemoglobinuri (PNH). Data som visar den kliniska nyttan av Soliris vid behandling av patienter med PNH är begränsade till patienter som tidigare har genomgått transfusioner.” När eculizumab godkändes ställde den europeiska läkemedelsmyndigheten (EMA) krav på att behandlingens effekt och säkerhet skulle övervakas i ett internationellt register. Företaget Alexion Pharma Nordics AB inrättade därför 2007 det internationella PNH-registret som är upplagt som en global, observationell icke-interventionsstudie. Registret leds av en oberoende vetenskaplig kommitté och är finansierat av Alexion Pharma Nordics AB. Sverige anslöt sig till registret 2010. Den årliga kostnaden för behandling med eculizumab har beräknats till 3,4 miljoner kronor per patient. 5.6.5. Svenska PNH-gruppen Under 2010 tog svenska hematologer initiativ att bilda en svensk PNH-grupp med målet att självständigt och fristående från företaget, utarbeta rekommendationer för behandling av PNH. Det fanns en enighet om behovet av att förbättra omhändertagandet av patienter med PNH och att få en likartad nationell bedömning och uppföljning. PNH-gruppen som består av sex representanter, en från varje sjukvårdsregion, var tidigt införstådd med att de kommande riktlinjerna måste förenas med en noggrann motivering av vilka patienter som är lämpliga att behandla. Efter nio månaders arbete presenterades de första nationella rekommendationerna för diagnostik, behandling och uppföljning av PNH (maj 2011). Enligt riktlinjerna ska varje patient bedömas av en PNH-kunnig hematolog i den egna regionen. Därutöver ska en värdering av indikationen göras av PNH-gruppen samt registrering av patienten (förutsatt samtycke) i det internationella PNH-registret. Efter behandlingsstart registreras utvalda variabler var 6:e månad i registret av läkare och patient. Arbetet bedrivs med begränsade resurser inom befintlig verksamhet och med ideella inslag. 5.6.6. Ordnat införande av eculizumab PNH-gruppens riktlinjer har spridits inom läkarkåren och har nu en bred förankring i berörda delar av professionen. Behandling bör ske i enlighet med rekommendationerna och varje fall bedöms av PNH-gruppen innan beslut tas att starta behandling med eculizumab. Behandlade patienter ska registreras i PNH-registret enligt gällande regelverk. 5.6.7. Uppföljning Källa för uppföljning är data som registrerats i PNH-registret. Den svenska registerhållaren gör årliga sammanställningar av effekt och säkerhet vid behandling med eculizumab. Dessutom följs bedömda patienters förlopp upp av gruppen. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 31 (75) 5.6.8. Praktiskt utfall juni 2013 I april 2013 är 40 svenska patienter inkluderade i registret. Av dessa är 20 behandlade med eculizumab med medelåldern 36 år vid inklusion. Ett okänt antal av obehandlade patienter är inte med i registret. PNH-gruppen har totalt bedömt 17 patienter för eventuell behandling med eculizumab, varav 13 under 2012. Av de sistnämnda fick två patienter avslag och för åtta patienter tillstyrktes behandling, varav två under begränsad tid. Resterande tre patienter gällde omprövning av pågående behandling, vilket tillstyrktes i samtliga fall. I Figur 10 presenteras försäljningsstatistik för eculizumab i relation till PNH gruppens arbete, Enligt det internationella registret var i mars 2013 totalt 2 000 patienter behandlade i 24 länder. PNH-gruppen har på grund av bristande resurser inte gjort någon strukturerad sammanställning av effekt och säkerhet för behandlade patienter. Figur 10. Tidslinje för godkännandeprocesser för eculizumab (Soliris) i relation till PNH-gruppen och ordnat införande samt försäljningsstatistik av eculizumab i Sverige i definierad dygnsdos (DDD) per 1 000 invånare och kvartal. (Källa: Concise, Apotekens Service AB) 5.6.9. Framtid Projektet pågår tillsvidare, inget slutdatum föreligger. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 32 (75) 5.6.10. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet • PNH-gruppen har med sitt arbete visat på en effektiv modell för prioritering av patienter som ska behandlas med eculizumab och säkerställt att behandling sker med en genomtänkt motivering. Modellen bidrar till att behandling blir möjlig trots mycket höga kostnader för ett enskilt landsting. • Modellen har tagits fram med mycket begränsade resurser med inslag av ideella insatser. Ett arbetssätt som kräver korta beslutsvägar och inarbetade arbetsmetoder. • Den konsensus som beskrivs under gruppens arbete tolkas som det viktigaste bidraget till det snabba resultatet. • Riktlinjerna har på ett välfungerande sätt förankrats i klinisk vardag. • Modellen tolkas som bäst lämpad för begränsad introduktion/mindre uppföljningsprogram vid komplexa behandlingssituationer och med få inblandade förskrivare. Svagheter med projektet • Gruppens begränsade resurser med inslag av ideella insatser gör modellen sårbar, särskilt om uthållig uppföljning över tid krävs. • Eftersom PNH-registret är företagsstyrt finns begränsningar för den svenska registerhållaren att göra analyser. Utvecklingsmöjligheter • Resurser behöver säkras för fortsatt uppföljning. 5.7. Ordnat införande och strukturerad uppföljning av Votubia – ett förmånsbegränsat särläkemedel 5.7.1. Varför ordnat införande? Votubia (everolimus) är ett så kallat särläkemedel med förmånsbegränsning, för vilket uppföljning med kompletterande data krävs av Tandvårds- och läkemedelsförmånsverket (TLV). Utifrån detta krav planerade företaget att sätta upp en registerstudie som bas för uppföljning och ordnat införande av everolimus. Sammanfattningen nedan baseras på följande referenser (6-8). 5.7.2. Aktuell sjukdom Tuberös skleros (TSC) karaktäriseras av tumörliknande förändringar i hjärnan och andra organ. I hjärnan kan olika typer av förändringar och ojämna förhårdnader uppkomma. Subependymalt jättecellsastrocytom (SEGA) är en förhårdnad som uppträder i främre delen av hjärnans vätskefyllda hålrum, främst hos barn och unga. Tumören i sig är i regel godartad men kan orsaka olika neurologiska symptom såsom hydrocefalus (vattenskalle), epilepsi och autism. Vid hydrocefalus ökar trycket i hjärnan och operation kan vara nödvändigt. Hittills har kirurgi varit den enda behandlingen, även i de fall då tumören är lokaliserad på ett sätt som gör operation svår. I Sverige finns idag cirka 300 personer med SEGA som är förknippat med TSC. Uppskattningsvis har 10 % av dessa patienter växande symptomatisk SEGA vilket kan ge upphov till hydrocefalus. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 33 (75) 5.7.3. Aktuellt läkemedel Votubia (everolimus) godkändes hösten 2011 av den europeiska läkemedelsmyndigheten (EMA). Indikationen är SEGA associerat med TSC hos vuxna och barn från 3 års ålder där terapeutisk intervention krävs men där kirurgi är olämpligt. Det rör sig om uppskattningsvis två tredjedelar av patienter med växande symptomatisk SEGA, cirka 20 personer i Sverige. Kliniska studier visar att everolimus minskar tumörstorleken med 30 % eller mer hos 75 % av patienterna. Everolimus har beviljats ett villkorligt godkännande av EMA, trots att resultaten från fas III-studier saknades. Detta på grund av ett stort medicinskt behov av behandlingar för denna patientgrupp. Everolimus ingår sedan 2012 i läkemedelsförmånen med en begränsning som kräver uppföljning till TLV (se Figur 11). Förmånsbegränsningen innebär krav på hälsoekonomisk analys som inkluderar data från en fas II- och en fas III-studie och även från användning av everolimus i klinisk praxis, vilket ska redovisas till TLV senast den 1 juni 2015. Behandling med everolimus (5 mg per dag) kostar knappt 900 kronor per dag. I svåra fall med SEGA blir operationskostnaderna mycket höga och enligt TLV kan den totala kostnaden för behandling med everolimus bli lägre än för operation. Två ekonomiska analyser är gjorda av företaget. Den ena tyder på att everolimus är kostnadsbesparande och den andra skattar kostnaden (per kvalitetsjusterat levnadsår) till 500 000–850 000 kronor. Kostnaderna kan bli lägre för operation i enskilda fall. Särläkemedel är en grupp läkemedel där såväl läkemedelsindustri som sjukvård har behov av uppföljning och intentionen var att starta ett register som en icke-interventionsstudie. Trots detta var det i detta specifika fall svårt att starta ett register för strukturerad uppföljning, eftersom det inte fanns någon utsedd huvudprövare kontrakterad. Figur 11. Tidslinje för ordnat införande av Votubia i relation till godkännandeprocessen. I samarbete med företaget Health Solutions har verktyget RealQ utvecklats för registerstudien och är färdigutvecklat med avseende på variabler kring status, läkemedelsuppföljning och variabler inkluderade i TLV:s uppföljningskrav. RealQ är ett webbaserat verktyg som kan användas för insamling av patientdata och som kliniskt beslutsstöd. Utvecklingsarbetet av RealQ har tagit sex månader. Det som dock saknas är synpunkter på RealQ från behandlande läkare. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 34 (75) 5.7.4. Framtid En vetenskaplig studierapport i form av en fall-studie planeras av en grupp barnneurologer. För den vetenskapliga studierapporten har gruppen i dagsläget identifierat patienter inom indikationen som kan inkluderas i fallstudien och man planerar att kontakta andra läkare i landet som behandlar patienter inom aktuell indikation. Varje patient kommer att beskrivas för sig gällande alla relevanta variabler; kliniska variabler, mått på livskvalitet (skattad av både läkare och patient) och relevanta hälsoekonomiska parametrar. Studien kommer att inkludera parametrar som efterfrågas av TLV för uppföljning i subventionsbeslutet för everolimus. Företaget planerar att göra en hälsoekonomisk analys utifrån publicerade resultat från fall-studien och detta kommer att tjäna som bas för uppföljningen till TLV. 5.7.5. Läkemedelsverkets sammanfattande bedömning Styrkor med projektet • Utvecklingen av verktyget RealQ har fungerat väl. Svagheter med projektet • Företaget har inte lyckats förankra projektet hos berörda kliniker och därför inte kunnat kontraktera ansvarig läkare för att starta den planerade registerstudien. • Den praktiska tillämpningen av verktyget RealQ har inte varit möjlig att utpröva i klinisk praxis. Utvecklingsmöjligheter • 5.8. Det redan utvecklade verktyget RealQ kan eventuellt användas i annan studie där tillämpningen kan prövas. Kvalitetsregister – en modell för ordnat införande och strukturerad uppföljning av läkemedel Ett fåtal kvalitetsregister har struktur och innehåll som lämpar sig för uppföljning av nya läkemedel. Här presenteras ett register inom reumatologi utförligt och ett annat register inom neurologi kommenteras kortfattat. 5.8.1. Varför ordnat införande? Svensk Reumatologis Kvalitetsregister (SRQ) är beteckningen på det kvalitetsregister som startades 1995 av Svensk Reumatologisk Förening (SRF). Initialt var målsättningen att registrera och följa upp patienter med tidig reumatoid artrit (RA). 1999 blev de första så kallade biologiska läkemedlen, som tillhörde gruppen tumörnekrosfaktor (TNF)-hämmare, tillgängliga för förskrivning. SRF och Läkemedelsverket inledde då ett samarbete grundat på en önskan från professionen att följa upp effekt och säkerhet men också kostnader för de nya läkemedlen. Uppföljningen av alla biologiska läkemedel som används vid artritsjukdomar sker nu i ARTIS (AntiReumatisk Terapi i Sverige) som utgör en läkemedelsmodul inom SRQ. Eftersom förskrivningen till en början skedde på licens kunde beviljande av denna villkoras med krav på deltagande i registret. Det ledde till att man fick en hög täckningsgrad. Eftersom preparatens långtidssäkerhet inte var känd skedde en intensifierad monitorering och biverkningsrapportering till Läkemedelsverket. De företag som marknadsförde de aktuella produkterna kunde avtala om rapportering från registret och kunde på så sätt fullgöra sina regulatoriska åtaganden. I Figur 12 presenteras utvecklingen av SRQ/ARTIS. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 35 (75) Figur 12. Tidslinjer för ordnat införande och strukturerad uppföljning av biologiska läkemedel vid reumatoid artrit (RA). 5.8.2. Aktuell sjukdom Reumatiska inflammationssjukdomar och då främst reumatoid artrit, är vanliga i Sverige med en prevalens på cirka 2 %. Sjukdomen är kronisk och leder till höga kostnader för samhället. Reumatoid artrit eller ledgångsreumatism kännetecknas av en kronisk inflammation i kroppens leder. Inflammationen ger upphov till värk och stelhet i leder och kan även drabba andra organ. Även andra artritsjukdomar som ankyloserande spondylit och psoriasisartrit följs upp i registret. 5.8.3. Tidigare behandling Reumatoid artrit behandlas med antiinflammatoriska, antireumatiska och biologiska läkemedel. Innan de biologiska läkemedlen fanns användes framför allt de antireumatiska läkemedlen som kallas för DMARD (Disease Modifying Anti Rheumatic Drugs), varav det vanligaste är metotrexat. Idag används biologiska läkemedel om patienten inte får en tillräcklig effekt av de antireumatiska läkemedlen. 5.8.4. Aktuella läkemedel Sedan introduktionen av de första biologiska läkemedlen mot reumatoid artrit, TNF-hämmarna, har ett flertal nya preparat tillkommit. Genom att påverka olika immunologiska styrmekanismer och cytokiner minskar dessa läkemedel den reumatiska inflammationen och därmed patientens symtom. De biologiska läkemedel som för närvarande förskrivs är abatacept, adalimumab, anakinra, certolizumab, etanercept, golimumab, infliximab, rituximab (se Figur 13 nedan). Till skillnad från Läkemedelsregistret kan ARTIS redovisa behandling per indikation och preparat. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 36 (75) Figur 13. Fördelning av indikationer och preparat samt antal patienter som någonsin behandlats. (Källa: SRQ/ARTIS) Förklaring förkortningar indikationer: AS = ankyloserande spondylit, SA = spondylartrit , PsA = psoriasisartrit, Juvenil A = juvenil artrit, RA = reumatoid artrit, PA = polyartrit Förklaring förkortningar preparat: aba = abatacept, ada = adalimumab, ana = anakinra, cer = certolizumab pegol, eta = etanercept, gol = golimumab, ifx = infliximab, rit = rituximab, toc = tocilizumab De biologiska läkemedlen har radikalt förbättrat reumatikernas liv men också ökat läkemedelskostnaderna. Kostnaden för en patients behandling kan uppgå till ca 100 000–150 000 kronor per år. 5.8.5. SRQ och ARTIS SRQ startade med patienter diagnostiserade med reumatoid artrit och idag ingår 69 diagnoser, varav de fyra vanligaste är reumatoid artrit, psoriasisartrit, spondylartrit och ankyloserande spondylit. Samtliga diagnoser inom gruppen inflammatorisk reumatisk sjukdom inkluderas i registret för att fånga alla patienter som behandlas med biologiska läkemedel. Kvalitetsregistret har en täckningsgrad på 88 % i hela landet för reumatoid artrit. SRQ är rikstäckande och har 62 anslutna enheter (sjukhus och primärvård, reumatologikliniker). SRQ leds av en styrgrupp med medlemmar som verkar kliniskt inom reumatologin och en patientrepresentant. Sedan 2003 finns en Internettjänst som låter patienten själv registrera sin hälsostatus innan läkarbesöket. Tjänsten kallas Patientens Egen Registrering (PER). SRQ ger en översikt över behandlingar och behandlingsresultat och fungerar som ett beslutsstöd för läkaren. I registret finns också en patientsäkerhetsmodul där biverkningar av läkemedel kan rapporteras och skickas till Läkemedelsverket. ARTIS ingår i kvalitetsregistret (SRQ) men har en egen vetenskaplig styrgrupp. Fokus är uppföljning av läkemedelssäkerhet. ARTIS har avtal med berörda företags internationella delar angående säkerhetsuppföljning medan de nationella marknadsbolagen har avtal med SRQ om viss annan information om sina produkter. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 37 (75) ARTIS aktiviteter omfattar löpande hantering och bedömning av biverkningsrapporter som görs av sjuksköterska och läkare. Halvårsvisa sammanställningar av biverkningar och behandlingsdata utförs av en läkemedelsepidemiolog. Registerlänkningarna som ligger till grund för de vetenskapliga studierna sker oftast årligen. Analys av berikade kvalitetsregisterdata kräver dels klinisk epidemiologisk kompetens, dels en förståelse för den kliniska kontext som gett upphov till data. Fortlöpande kommunikation med läkemedelsföretagen kräver en förståelse för både den kliniska situationen samt alla delar i säkerhetsuppföljningen. De uppföljningsdata som genererats har kunnat användas bland annat för att studera vem och hur vi behandlar med biologiska läkemedel i klinisk praxis, tumörrisker, risker för vissa infektioner, hjärtkärlhändelser och död, såväl relaterad till grundsjukdomen RA som till samsjuklighet och behandling. Inom detta område har svensk reumatologi fått en internationellt ledande ställning. 5.8.6. Ordnat införande Riktlinjer för läkemedelsbehandling och säkerhetsuppföljning finns och utarbetas av en expertgrupp inom SRF. Riktlinjearbetet för säkerhetsuppföljning bygger på data från registrets biverkningsrapportering. Återrapporteringen från registret används i arbetet med att ta fram nya riktlinjer. 5.8.7. Uppföljning I SRQ inkluderas data om medicinska resultat, patientens rapporterade funktionella förmåga och hälsorelaterade livskvalitet. Utvärderingarna utförs med standardiserade och internationellt överenskomna mått och kan jämföras över tid och mellan olika patientpopulationer. Uppföljning av behandling görs på många olika sätt, dels vid patientens registrering och dels vid det efterföljande läkarbesöket då beslutsstödet används. Utöver det har registret en rapportgenerator som söker och ger önskade datasammanställningar och kan användas för verksamhetsuppföljning, läkemedelsuppföljning och klinisk forskning. 5.8.8. Praktiskt utfall 2013 Det finns idag 923 registrerade användare, cirka 58 000 patienter ingår i registret och patientantalet ökar med 30 % per år. I ARTIS finns det totalt över 26 000 patienter som behandlas med biologiska läkemedel. Utvecklingen av förskrivningen över tid framgår av Figur 14 nedan. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 38 (75) Figur 14. Antal nyinsatta (biologiska läkemedel) för bionaiva patienter kumulativt och per år, alla indikationer inom SRQ, per juni 2013. (Källa: SRQ/ARTIS) Visar antal nyinsatta (biologiska läkemedel) patienter kumulativt för respektive år. Visar antalet nyinsatta per år. Registret har bidragit till ökad kunskap hos patient och vårdgivare och till förbättrad hälsa hos RApatienter. Registret har också bidragit till att behandling i enlighet med rekommendationer i nationella riktlinjer har getts till 90 % av RA-patienter redan vid första reumatologbesöket (sedan 2003). 5.8.9. Läkemedelsverkets sammanfattande bedömning Styrkor med modellen • Hög täckningsgrad på grund av initiala krav från Läkemedelsverket på anslutning till registret för beviljande av licens. • Acceptans för registret på kliniknivå och samverkan mellan klinik, akademi, företag och Läkemedelsverket. • Stort behov i kliniken av registret vid införandet av behandling med nya biologiska läkemedel. • Lyckad implementering av registret, kontinuerlig utbildning och interaktion med klinikerna. • Nya kunskaper av betydelse för behandling implementeras snabbt (exempelvis rökningens påverkan på behandling, utformning av nationella riktlinjer). • Registret fungerar som beslutsstöd i det direkta patientarbetet och inkluderar Patientens Egen Registrering (PER). • ARTIS startades redan 1999 och har därmed över tid hunnit utvecklas till en väl fungerande modul för läkemedelsuppföljning inom kvalitetsregister. • ARTIS innehåller information om såväl receptförskrivna läkemedel som klinikläkemedel. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 39 (75) Svagheter med modellen • Inledningsvis svårigheter att inkludera och få acceptans för registret på kliniknivå. • Initiala problem med att harmonisera regionala och nationella behov och önskemål. • Vid introduktion av flera nya diagnoser har datakvaliteten för dessa blivit sämre jämfört med RA. 5.8.10. Kvalitetsregistret för multipel skleros Ett annat kvalitetsregister som har en väl strukturerad läkemedelsuppföljning är Svenska MSregistret (multipel skleros). Det är en del av Svenska Neurologi-register där flera neurologiska sjukdomar följs upp. I MS-registret följs på nationell nivå de nya terapierna vid MS upp. På samma sätt som SRQ/ARTIS har man en direkt elektronisk rapportering av biverkningar till Läkemedelsverket. Registret genererar inte bara kunskap om långsiktig effekt och biverkningar, utan också material för studier av ärftlighet av MS i sig och genetiska studier av effekter och bieffekter av de nya terapierna, genom att DNA och plasma sparas i biobank över tid. De långsiktiga resultaten av denna uppföljning börjar nu kunna publiceras (9). Modellen för ”postmarketing surveillance” via MS-registret, webbaserat och kombinerat med biobankning av plasma/DNA, har kommit att betraktas som ”golden standard” för läkemedelsuppföljning också internationellt. Bland annat har biobanksmaterialet använts för genetisk analys som varit av stor betydelse för riskstratifiering inför terapi – en del av ”personalized medicine”(10). 5.9. Det nationella vaccinationsprogrammet – om införande och uppföljning 5.9.1. Bakgrund Alla barn rekommenderas vaccinationerna inom ramen för det svenska vaccinationsprogrammet. Vaccination ger de allra flesta barn skydd och förhindrar också att barnet smittar andra (11). Programmet utgörs i Sverige dels av ett allmänt vaccinationsprogram, dels av särskilda vaccinationsprogram för barn och vuxna som ingår i riskgrupper. Majoriteten av de sjukdomar som omfattas av det allmänna vaccinationsprogrammet är anmälningspliktiga och rapporteras till landstingens smittskyddsläkare och till Smittskyddsinstitutet (SMI). Smittskyddslagen anger att landstingen, kommunerna eller andra huvudmän med ansvar för elevhälsa har ett ansvar att programmet genomförs och erbjuds alla barn. Huvudmännen bär kostnaderna för genomförandet av vaccinationerna. Vaccinationerna som erbjuds den enskilde är kostnadsfria. 5.9.2. Vaccinationsprogram De flesta länder har nationella vaccinationsprogram men utformningen kan variera beroende på sjukdomsförekomst och hur sjukdomsbördan bedöms, samt på ekonomiska och praktiska möjligheter att genomföra vaccinationer. Målsättningen är antingen att utrota (polio), eliminera (difteri, stelkramp, mässling, påssjuka och röda hund) eller kontrollera de sjukdomar man vaccinerar mot (till exempel kikhosta, Haemophilus influenzae typ b, pneumokocker och HPV). Programmet i Sverige börjar med den första dosen när barnet är 3 månader och fortsätter upp till skolans årskurs 8–9 när barnet är 14–16 år. Sjukdomarnas förekomst och spridningssätt, tillsammans med beräknad effekt av vaccination, avgör vilken strategi som fungerar bäst, dvs. om det ska erbjudas alla barn eller riktas till utvalda grupper. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 40 (75) För närvarande ingår vaccination mot tio sjukdomar i den allmänna delen av vaccinationsprogrammet för barn. Dessa sjukdomar är polio, difteri, stelkramp, kikhosta, Haemophilus influenzae typ b (Hib), mässling, påssjuka, röda hund (MPR) och pneumokocker. Vaccination mot infektion med humant papillomvirus (HPV) erbjuds numera också flickor födda 1999 eller senare. Vilka sjukdomar som ska omfattas av nationella vaccinationsprogram beslutas av regeringen och finns reglerade i smittskyddsförordningen. Programmets innehåll avseende bland annat ålder, doser och intervall regleras i en föreskrift från Socialstyrelsen (12). Socialstyrelsen har även sedan tidigare gett ut rekommendationer avseende bland annat vaccination mot hepatit B, tuberkulos, influensa eller pneumokockinfektion till barn eller andra grupper med ökad risk. Dessa rekommendationer är inte bindande, då de inte är författningsreglerade. Hur landstingen och kommunerna väljer att genomföra dessa kan därför variera något. Sjukvårdshuvudmannen (landstinget eller kommunen) väljer vilket/vilka vaccin man vill upphandla. De flesta vacciner som ingår i det svenska barnvaccinationsprogrammet ges som kombinationsvacciner, dvs. vaccin mot flera sjukdomar ges i en och samma spruta. De senaste åren har flera nya vacciner introducerats. Dessa kännetecknas av att de inte, såsom tidigare vacciner, är avsedda att bekämpa utbredda, svåra barn- och folksjukdomar som exempelvis mässling, smittkoppor och polio. Utmärkande för de nya vaccinerna är istället att de motverkar endera svåra sjukdomar med få fall eller sjukdomar som sällan är svåra, men som drabbar många. Det innebär att de nya vaccinerna inte med samma självklarhet kan införas i allmänna vaccinationsprogram på samma sätt som de äldre. De nya vaccinerna är också väsentligt dyrare än de äldre. 5.9.3. Ansvarsfördelning mellan berörda myndigheter Socialstyrelsen har ett samordningsansvar i arbetet med att förebygga och hantera smittsamma sjukdomar (13). Ansvaret för bedömningen av och beslut om ändringar i det nationella vaccinationsprogrammet har tidigare legat på Socialstyrelsen. Arbetet har styrts genom interna riktlinjer. Från och med 1 januari 2013 är det istället regeringen som fattar beslut om vilka sjukdomar som ska omfattas av det nationella vaccinationsprogrammet efter rekommendation från Socialstyrelsen. Bakgrunden till nyordningen finns beskriven i regeringens proposition om ”Ny ordning för nationella vaccinationsprogram” (14). Där framgår att man bland annat vill att tydligare krav ställs på kunskapsunderlaget som föregår beslut om nya sjukdomar som ska omfattas av det nationella vaccinationsprogrammet. Man anger också att arbetet med att bedöma om en sjukdom bör omfattas av det nationella vaccinationsprogrammet bör genomföras i en strukturerad ordning som är öppen och tydlig. Socialstyrelsen har därför under 2013 fått i uppdrag av regeringen att ta fram en modell som beskriver arbetsprocessen vid framtagande av underlag till regeringen inför beslut om nationella vaccinationsprogram. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 41 (75) Inom ramen för Socialstyrelsens samordningsansvar ingår också att följa utvecklingen inom vaccinområdet och årligen (1 oktober) lämna en lägesrapport om det nationella vaccinationsprogrammet till regeringen. Lägesrapporten ska omfatta en uppföljning av nuvarande program, pågående utvecklingen av nya vacciner och vilken planering som myndigheten har i fråga om att bedöma vacciner. 5.9.4. Uppföljning av vaccinationsprogrammen Socialstyrelsen, Smittskyddsinstitutet och Läkemedelsverket ansvarar för olika delar kopplat till det nationella vaccinationsprogrammet, vilket understryker behovet av myndighetssamverkan kring dessa frågor. Samverkansmöten om det nationella vaccinationsprogrammet sker löpande i Socialstyrelsens regi. Smittskyddsinstitutet sammanställer och analyserar statistik över sjukdomsförekomst (epidemiologisk övervakning) och vaccinationstäckning, och genomför också återkommande immunitetsstudier genom att mäta antikroppsnivåer mot smittämnen hos ett urval av befolkningen. I tillägg genomförs mikrobiologisk epidemiologi. Dessa aktiviteter ger viktig information om behovet av eventuella ändringar i det nationella vaccinationsprogrammet. Läkemedelsverket gör, tillsammans med andra läkemedelsmyndigheter inom EU, säkerhetsbedömningar av de läkemedel, inklusive vaccin, som godkänts för försäljning. Den ansvarige tillverkaren är ålagd att kontinuerligt redovisa all tillgänglig säkerhetsinformation, bland annat i form av så kallade periodiska säkerhetsrapporter. Underlaget värderas av läkemedelsmyndigheterna inom EU vilket resulterar i en kontinuerlig bedömning av produktens nytta-riskförhållande. Som en del av säkerhetsuppföljningen nationellt tar Läkemedelsverket emot och bedömer inkomna rapporter om misstänkta biverkningar från sjukvården, allmänheten och från farmaceuter. En ny lag om register över nationella vaccinationsprogram trädde ikraft den 1 januari 2013. Smittskyddsinstitutet är huvudansvarig för att utveckla och förvalta det nya hälsodataregistret för vaccinationer. Inledningsvis ska alla vaccinationer i det allmänna vaccinationsprogrammet för barn rapporteras in i Vaccinationsregistret. Det innebär att vårdgivarna ska registrera alla vaccinationer som ges inom ramen för programmen. Tidigare var inte rapporteringen till SMI obligatorisk samtidigt som uppgifterna registrerades på olika sätt i olika delar av landet. Med en obligatorisk inrapportering till ett hälsodataregister förenklas datainsamling på nationell nivå och möjliggör • en heltäckande och kvalitetssäkrad nationell övervakning av vaccinationstäckning, skyddseffekt, vaccinsvikt och biverkningar • snabbare återkoppling och åtgärder i områden med låg vaccinationstäckning • högkvalitativ epidemiologisk forskning • deltaganden i internationella samarbeten och erfarenhetsutbyten. Data från det nya vaccinationsregistret kan bidra till ett bättre beslutsunderlag för optimering av det nationella vaccinationsprogrammet och vaccinationsschemat. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 42 (75) 5.9.5. Förslag till införandemodell av nya vacciner på nationell nivå Inte minst för att upprätthålla förtroendet för de nationella vaccinationsprogrammen föreslår Socialstyrelsen inom ramen för sitt pågående regeringsuppdrag en tydlig och transparent process där berörda myndigheter, landsting, kommuner och andra utförare är delaktiga i processen med möjlighet till påverkan. Modellen bygger på att ett vetenskapligt underlag tas fram utgående från kriterierna i smittskyddsförordningen 7§, följt av en helhetsbedömning gentemot smittskyddslagens kriterier i 3e§. Kriterierna i 7§ smittskyddsförordningen är: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. sjukdomsbördan i samhället, i hälso- och sjukvården och för enskilda individer, vaccinationens förväntade påverkan på sjukdomsbördan och på sjukdomens epidemiologi, det antal doser som bedöms krävas för att uppnå önskad effekt, de målgrupper som ska erbjudas vaccination, vaccinets säkerhet, vaccinationens påverkan på verksamhet i landsting, kommuner och hos privata vårdgivare, vaccinets lämplighet att kombinera med övriga vacciner i de nationella vaccinationsprogrammen, allmänhetens möjlighet att acceptera vaccinet och dess påverkan på attityder till vaccinationer generellt, vilka andra tillgängliga, förebyggande åtgärder eller behandlingar som kan vidtas eller ges som alternativ till vaccination i ett nationellt vaccinationsprogram, vaccinationens samhällsekonomiska effekter och dess kostnader och intäkter i staten, kommunerna och landstingen, möjligheterna till uppföljning av vaccinationens effekter i de avseende som anges i 1–10 samt statens beräknade kostnader för sådan uppföljning, behovet av informationsinsatser i förhållande till allmänheten och vårdgivare och kostnaden för dessa insatser, samt medicinetiska och humanitära överväganden. Kriterierna i 3e§ smittskyddslagen är: En smittsam sjukdom ska omfattas av ett nationellt vaccinationsprogram, om vaccination med det vaccin mot sjukdomen som avses i 3d§ kan förväntas 1. 2. 3. effektivt förhindra spridning av smittsamma sjukdomar i befolkningen, vara samhällsekonomiskt kostnadseffektivt, och vara hållbart från etiska och humanitära utgångspunkter. En expertgrupp föreslås ta fram ett kunskapsunderlag för respektive sjukdom som belyser de 13 kriterierna som sedan bedöms av en grupp sakkunniga. Därefter förankras och inhämtas råd från ett nybildat så kallat Vaccinationsråd knutet till Socialstyrelsen, bestående av myndighets- och landstingsrepresentanter samt representanter för smittskyddsläkarna, barnhälsovården och elevhälsan. Råd inhämtas också från Socialstyrelsens råd för etiska frågor och i tillämpliga fall Socialstyrelsens vetenskapliga råd. Det samlade underlaget utgör grund för Socialstyrelsens rekommendation till regeringen om ändringar i det nationella vaccinationsprogrammet (se Figur 15). Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 43 (75) Figur 15. Förslag till arbetsprocess för att ta fram kunskapsunderlag inför rekommendation och beslut om ändringar i det nationella vaccinationsprogrammet. (Källa: Socialstyrelsen, 2013) Ovanstående förslag på modell är för närvarande på remiss men ska lämnas in till regeringen senast den 1 november 2013. Det som är utmärkande för ordnat införande av nya vaccinationer i det nationella vaccinationsprogrammet är att vaccinationen erbjuds av staten till friska individer (främst barn). Detta ställer särskilda krav på kunskapsunderlaget som ligger till grund för införandet. Det föreslagna arbetssättet innebär att en omfattande prövning görs innan en ändring i vaccinationsprogrammet kan rekommenderas på nationell nivå. 5.9.6. Framtid Uppföljning och utvärdering av insatta åtgärder är viktiga för preventionsarbetet, inte minst för att säkerställa att man på bästa sätt använder tillgängliga resurser inom området. Uppföljningen av det nationella vaccinationsprogrammet bör därför ges större vikt (15). Smittskyddsinstitutet har i regleringsbrevet för budgetåret 2013 fått i uppdrag att till den 30 november 2013 ”utföra en översyn av myndighetens verksamhet avseende uppföljning av vacciner. Smittskyddsinstitutet ska i uppdraget beakta hur vaccinuppföljning används som underlag för en analys av hur vaccinationstäckningen kan upprätthållas och förbättras samt för utredningen av misstänkta biverkningar. Smittskyddsinstitutet ska också se över verksamheten utifrån vilka behov som finns nationellt och i förhållande till det nationella barnvaccinationsprogrammet”. SMI:s rapport till regeringen om vaccinuppföljning är för närvarande på remiss. Socialstyrelsen har dessutom under år 2013 fått i uppdrag av regeringen att till den 1 november 2014, i samverkan med SMI ”fastslå omfattningen av uppföljningen av de vacciner som ges mot de sjukdomar som omfattas av det nationella vaccinationsprogrammet samt uppskatta kostnaderna för denna uppföljning”. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 44 (75) 5.9.7. Slutsatser Styrkor med förslaget • En öppen och transparent process med syfte att förankra eventuella förslag om ändringar i vaccinationsprogrammet hos berörda aktörer. • Tydliga kriterier i regelverket som styr smittskyddsarbetet för bedömningen inför rekommendation om ändringar i vaccinationsprogrammet. • Ett gediget och genomarbetat kunskapsunderlag som har bedömts i flera steg och tas fram före beslut. Svagheter med förslaget • Systemet är väl reglerat i lag, förordning och föreskrifter. En reglering som kräver att beslut tas på riksdags- och regeringsnivå om ändringar ska genomföras, vilket i sig innebär risk för en långdragen och resurskrävande procedur. • Risk för svårigheter att rekrytera nödvändig expertis. • Risk för trovärdighetsproblem vid bristande överensstämmelse mellan beslut/ rekommendationer på nationell respektive landstingsnivå. • I nuläget finns ingen uttalad möjlighet att på ett enkelt sätt ta vara på erfarenheter från enskilda landsting som redan infört regional programvaccination inför beslut på nationell nivå. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 45 (75) 6. Internationell utblick – exempel från andra europeiska länder Projektet bedömde det som värdefullt att göra en kartläggning av internationella erfarenheter inom området ordnat införande strukturerad uppföljning, i facklitteratur oftast benämnt ”managed introduction”. Ett uppdrag gavs till professor Lars L. Gustafson och Brian Godman, Karolinska Institutet. Brian Godman är aktiv inom den så kallade Piperska gruppen, ett europeiskt nätverk som driver frågor kring ordnat införande. Den fullständiga, engelskspråkiga rapporten finns som Bilaga II. Avsnittet nedan är projektgruppens sammanfattning av Godmans beskrivning och slutsatser. 6.1. Bakgrund Brian Godmans rapport beskriver inledningsvis faktorer som drivit på utvecklingen av olika modeller för ordnat införande och strukturerad uppföljning. Kostnaderna för läkemedel anges som en viktig faktor. De har ökat under 2000-talet och utgör nu en stor andel av öppen vård. Godman gör bedömningen att kostnaderna förväntas öka genom fortsatt nyregistrering av läkemedel med högre pris (”premium priced)” vilket blir en stor utmaning vad gäller att tillhandahålla en jämlik och omfattande hälso- och sjukvård i Europa. Förskrivning av generika istället för originalpreparat anges ha frigjort väsentliga resurser i Sverige. Detta kommer inte att vara tillräckligt för kostnadskontroll i framtiden med hänsyn till en förväntat hög andel nyregistrerade ”premium priced” biologiska läkemedel samt ett ökat antal ansökningar om särläkemedelsstatus (med tillhörande höga priser för nyutvecklade läkemedel). Rapporten framhåller att ett ordnat införande av läkemedel bygger på aktiviteter inför, vid och efter lansering. En nyligen publicerad översiktsartikel angående internationella erfarenheter redovisar mycket av den information som återfinns i Godmans rapport (16). 6.2. Europeiska exempel – ett urval från rapporten Rapporten belyser riskdelningssystem (”risk-sharing”) mellan läkemedelsföretag och sjukvårdsfinansiärer för att minska budgetpåverkan i sjukvården för nya och befintliga läkemedel (Skottland). Vidare belyses registeruppföljning för kostnadsdrivande nya biologiska läkemedel (Italien). Rapporten beskriver också rutinmässig uppföljning av rabatterad förskrivning för kostnadskontroll (Frankrike). Rapporten framhåller planering före lansering av nya läkemedel och exemplifierar med insatser i landstingen i Östergötland och Stockholms län. 6.3. Rapportens förslag för Sverige Rapporten förespråkar aktiviteter i Sverige som delas upp i faserna inför, vid och efter lansering på nationell och regional nivå och som inkluderar redan pågående aktiviteter i samordning med nya initiativ. Vidare föreslås en beskattning på läkemedelsföretagens marknadsföringsaktiviteter för finansiering av strukturerad uppföljning. Inför lansering • Ökad och tidig samordning mellan nationella och regionala aktörer i hälso- och sjukvården vad gäller prognostisering och budgetpåverkansanalyser framhålls som viktigt. • TLV:s kritiska granskning tillsammans med huvudmännens ifrågasättande av det underlag som åberopas för ”premium price” för nya produkter. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 46 (75) • Utveckling av det nationella samarbetet för riktlinjer för nya läkemedel som är terapiområdesöverskridande, då ett och samma läkemedel kan användas av olika discipliner för behandling av olika sjukdomsområden. • Förorda utveckling av gemensamma terapiområdesöverskridande kvalitetsindikatorer och patientregister. Vid lansering • Underlag för budgetering angående totalkostnader och kostnader per kvalitetsjusterade levnadsår ska finnas. • Underlag för ersättning för kostnader även för läkemedel som används exklusivt på sjukhus ska finnas. • Utnyttja de kunskaper och erfarenheter som gjorts i andra länder vad gäller riskdelning. • Renodling av nyckelkomponenter som avses följas som kvalitetsindikatorer med hjälp av register. Efter lansering • Rutinmässig övervakning av följsamhet till subventionsbegränsad förskrivning framhålls. • Omgående inleda användning, mätning och registrering av relevanta kvalitetsindikatorer. • Förnyad utvärdering av det hälsoekonomiska värdet av nya läkemedel i praktiken genomförs rutinmässigt. • Användning av register framför allt när frågor kvarstår om nya läkemedels effektivitet och säkerhet. • Förbättrad utformning och förvaltning av ovanstående i övergången mellan sluten och primärvård. • Rapporten framhåller vikten av tidsaspekterna och av en sammanhängande kedja från prognostisering och budgetplanering till implementering och genomförande av uppföljning för utvärdering av prissättningsmodeller. 6.4. Diskussion och prioritering av förslagen i rapporten Vid genomgången av rapporten har en övergripande värdering gjorts av vad som bör kunna tillämpas och vad som inte är realistiskt ur ett svenskt perspektiv. De förslag som bör kunna tillämpas är den prognostisering med hjälp av horizon scanning som redan pågår, samordning mellan olika aktörer samt utveckling av terapiområdesöverskridande nationella riktlinjer och vårdprogram. Åtgärder som förordas i rapporten, som arbete med indikatorer för uppföljning, pågår redan och en satsning har gjorts på kvalitetsregister nationellt. Förslaget om att övergången från sluten vård till öppen vård behöver samordnas med avseende på uppföljning är tänkvärt ur flera aspekter vad gäller system för administration, register och uppföljning då detta idag sker åtskiljt. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 47 (75) Förslag som förefaller mindre realistiska ur ett svenskt perspektiv, utan föregående politiska beslut respektive avtal, är de resursomfördelningar med hjälp av beskattning på läkemedelsföretagens marknadsföringsaktiviteter respektive ett rutinmässigt anlitande av akademiska forskare som framförs i rapporten. Förslagen om riskdelningssystem på nationell nivå kräver samordning och behöver en förankringsprocess och avtal med hänsyn tagen till förutsättningar med regionalt självstyre i Sverige. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 48 (75) 7. Möjlighet till uppföljning av följsamhet I och med att projektets uppdrag utvidgades (april 2013) uppdrogs åt stiftelsen NEPI (Nätverket för Läkemedelsepidemiologi) att ta fram ett underlag kring vilka möjligheter som finns för uppföljning av följsamhet till riktlinjer och rekommendationer och hur dessa skulle kunna förbättras. Den fullständiga rapporten bifogas som Bilaga III. I bilagan presenteras ett antal detaljerade förslag till åtgärder i avsnittet ”Övergripande slutsatser”. Avsnittet nedan är en förkortad version av sammanfattningen i rapporten. 7.1. Begreppet följsamhet Begreppet följsamhet används här för att beskriva ett agerande i förhållande till rekommendationer eller riktlinjer, vilket kan beskrivas i form av ett mått eller en måluppfyllelse. Grundläggande för tankarna kring kvalitetsarbete är att de som är berörda, till exempel läkarna vid en viss vårdenhet, själva beskriver och fastställer kort- och långsiktiga mål för ett förbättringsarbete. Vid ekonomisk styrning och central uppföljning av verksamhetens innehåll fastställs ofta ett målvärde centralt. Detta är två helt skilda situationer med olika möjligheter att förbättra vården och risker för snedvridning av verksamhetens kvalitet. Kvalitetsindikatorer som är avsedda för eget kvalitetsarbete är ofta inriktade på att stimulera självreflektion och möjligheter till förbättring, är specifika och detaljerade, kräver inte omfattande validering och beskriver kvalitet i en kontinuerlig skala. Det är därför sällan lämpligt eller ens möjligt att använda en indikator utvecklad för eget kvalitetsarbete i extern styrning och uppföljning. 7.2. Källor för datafångst Data kan fångas antingen genom aggregerade volymdata, till exempel försäljningsstatistik för läkemedel, eller genom individrelaterade data från exempelvis vårddatalager eller hälsodataregister. Läkemedelsregistret har lett till ny kunskap om hur läkemedel används i öppen vård. Detta har inneburit en möjlighet till snabb utveckling av mått som beskriver hur receptförskrivna läkemedel används. Information i Läkemedelsregistret har också bidragit till ett stort antal publicerade analytiska studier med epidemiologisk metodik. 7.3. Uppföljning av följsamhet Det finns en rad svårigheter förknippade med uppföljning av läkemedel. För försäljningsstatistik över läkemedel rekvirerade till avdelningar och mottagningar kan användningen av läkemedlen bara hänföras till verksamhet och inte till vilket landsting som patienten är folkbokförd i, patientens kön eller ålder. Detta är särskilt problematiskt vid uppföljning av läkemedel vanliga vid utomlänsvård, framför allt högspecialiserad regionsjukvård. Det innebär särskilda svårigheter när • samma läkemedel kan distribueras såväl via receptförskrivning som på rekvisition till avdelningar, eller när • ett eller flera läkemedel i en läkemedelsgrupp kan distribueras på annat sätt än huvudparten. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 49 (75) Över tid har fokus på läkemedelskommittéernas rekommendationer förändrats, dels på grund av förändringar i läkemedelsmarknaden och dels på grund av nya uppdrag. Successivt har uppföljning kompletterats med avgränsningar av måtten till patientkarakteristika som kön eller ålder hos behandlade. Generellt kan sägas att dessa mått är känsliga för vald enhet vilket innebär att eventuella målvärden är svåra att sätta. Sjukvårdshuvudmännen har sedan tidigare möjlighet att arbeta med individdata kring läkemedelsordination i öppen (receptförskrivning) respektive sluten vård i de fall de har haft en sammanhållen patientjournal och/eller ett vårddatalager dit ordinerade läkemedel kunnat föras från journal på individnivå. Sedan den 1 juli 2010 får varje sjukvårdshuvudman månadsvis rådatafiler med individbaserad information över apoteksexpeditioner med krypterat personnummer från Apotekens Service AB. Sjukvårdshuvudmännen har även tillgång till krypteringsnyckel för envägskryptering. Det innebär att det för varje enskild sjukvårdshuvudman är möjligt att koppla krypterad information på individnivå från lokalt vårddatalager med uppgifter om receptförskrivna läkemedel expedierade på recept. 7.4. Befintlig uppföljning av följsamhet Tandvårds- och läkemedelsförmånsverket (TLV) rapporterade i april 2013 resultatet av ett samarbete med landstingen kring efterlevnad av subventionsbegränsningar. TLV har i sin genomgång av följsamhet till begränsningar av förmånen utvecklat ett strukturerat arbetssätt anpassat till TLV:s behov för att belysa en specifik fråga – hur behandlingsordningen ser ut innan ett nytt läkemedel sätts in. Möjligheterna är dock begränsade till källan – Läkemedelsregistret – som saknar koppling till till exempel diagnoser eller laboratorievärden. Inom hälso- och sjukvården bedrivs uppföljning av läkemedelsanvändning och kvalitetsarbete kring läkemedel såväl lokalt inom verksamhet som landstingsövergripande eller i form av regional samverkan (se bilaga 1 och 2 i Bilaga III). Samverkan sker också med TLV, se ovan. En sammanställning under våren 2013 (se bilaga 3 i Bilaga III) över lokalt eller regionalt fastställda mått för uppföljning av läkemedel, visade att arbetet med kvalitetsindikatorer ökat avsevärt i volym jämfört med tidigare sammanställningar samt att måtten i många fall är likartade mellan landsting men med delvis olika avgränsningar. Indikatorerna utgår i flertalet fall från aggregerad försäljningsstatistik. Individdata från vårddatalager eller Läkemedelsregistret används i ringa utsträckning. Bedömningen är att det finns ett stort behov av att samordna arbetet mellan landsting i framtagande av mått, och kring hur dessa skall tolkas. Socialstyrelsen redovisade i samverkan med SKL i juni en samlad rapport kring läkemedelsindikatorer i Öppna jämförelser. I rapporten finns 29 sedan tidigare använda indikatorer inom framför allt sekundärprevention efter hjärt- och kärlsjukdom och stroke, antibiotikabehandling, läkemedelsbehandling vid psykisk ohälsa och vid vissa tillstånd inom rörelseorgans sjukdomar samt läkemedelsanvändningen hos äldre. I förslag till fortsatt arbete lyfts särskilt fram behovet av utvecklingsarbete för att ta fram nya indikatorer inom områden där behoven är stora; en utökad webbaserad resultatredovisning med tätare uppdatering där så är lämpligt; samt en prenumerationstjänst för vårdgivare för att ta del av uppgifter uppdelade på mindre enheter för användning inom lokalt kvalitetsarbete. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 50 (75) 7.5. Utvecklingsmöjligheter Erfarenheterna från det befintliga arbetet med individdata och kvalitetsregister visar att det finns stora möjligheter att arbeta mer offensivt, i första hand inom ramen för statistikuppgifter från Läkemedelsregistret. Exempel på sådana mått är incidenstal, behandlingsordning, dos och dosförändringar och behandlingstid. Särskilt möjligheten att specialstudera nyinsättningar (incidens) istället för samtliga användare (prevalens) är dåligt utnyttjad. Sådana mätningar innebär färre observationer och därmed mindre styrka för att särskilja enheter. Å andra sidan är incidens betydligt känsligare för förändringar i förskrivarbeteende och kan då också lättare användas för att fånga effekter av olika interventioner som till exempel utbildningsinsatser. Nyinsatt läkemedelsbehandling är även på många andra sätt intressant att studera, särskilt i jämförelse med tidigare behandling men även hur dos och förpackningsstorlek vid nyinsättning väljs. Orsak till varför ett läkemedel eller annan åtgärd ordinerats inom vården är en information som är viktig för att patient och olika vårdgivare ska kunna samverka för en säker och effektiv behandling. Att möjliggöra uppföljning av rekvisitionsläkemedel på individnivå är en av insatserna inom nationella läkemedelsstrategin. En förstudie från Centrum för eHälsa i samverkan (CeHIS) har rapporterats 15 oktober 2013. I korthet är slutsatsen från förstudien att det idag inte är möjligt att starta ett omfattande och generellt projekt för att fortlöpande samla in uppgifter om rekvisitionsläkemedel på individnivå nationellt. Inom vissa terapiområden som uppfyller de uppställda kriterierna kan det vara intressant att utreda möjligheten att påbörja pilotprojekt. För att uppgifter om läkemedel expedierade i öppen vård och dokumenterade i Nationell ordinationsdatabas (NOD) samt uppgifter om läkemedel givna på avdelningar och mottagningar ska kunna föras till Läkemedelsregistret eller annat hälsodataregister för uppföljning och forskning krävs författningsförändringar. Detta gäller även för eventuell uppgift om ordinationsorsak kopplad till dessa informationsmängder. 7.6. Kliniska beslutstöd Ett kliniskt beslutstöd (clinical decision support system) kan definieras på många sätt. Syftet med ett beslutstöd i hälso- och sjukvården är att stödja beslutsfattaren i den kliniska situationen så att de beslut som fattas blir mer ändamålsenliga. Ett beslutstöd kan sägas bestå av tre generella delar: • Icke situationsspecifik information – till exempel information om ett läkemedels egenskaper • Beslutsregler • Mjukvara/gränssnitt Beslutstödet kan sedan interagera med situationsspecifik information, till exempel information om patienten, för att ge bästa möjliga underlag för att fatta ett beslut. Beslutstöd har potential att användas för att lösa flera olika situationer inom olika terapiområden men kan också vara ett direkt hjälpmedel för att identifiera patienter i en vårdsituation för kliniska prövningar eller för bedömning kring eventuell användning av ett nytt läkemedel inom ramen för ett ordnat införande. Ytterligare en fördel är att ett beslutstöd genom automatiserade standardanteckningar i journalen kan säkerställa att informationen om besluten är strukturerad och möjlig att följa upp över tid. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 51 (75) 8. Samhällsekonomisk analys av pilotprojekten Medical Management Centrum (MMC) vid Karolinska Institutet (KI) ombads av projektet att genomföra en samhällsekonomiskt inriktad utvärdering av fem av pilotprojekten som ingår i delprojekt 6.2. Utvärderingsstudien bestod av två delmoment: i) utveckling av en samhällsekonomisk bedömningsmodell av ordnat införande och strukturerad uppföljning av nya läkemedel i samarbete med projektledningen och ii) fallstudier av de fem pilotprojektens arbete med ordnat införande och strukturerad uppföljning. Dessutom skulle en prövning av bedömningsmodellen ingå, i den utsträckning data fanns tillgängliga inom pilotprojekten. Rapporten i sin helhet finns bifogad som Bilaga IV. 8.1. Bakgrund Samhällsekonomiska analyser av ordnat införande och strukturerad uppföljning av nya läkemedel finns inte rapporterade i litteraturen. I sin mest fullständiga form skulle en sådan vara en kostnadsintäktsanalys som beaktar genererad hälsovinst samt alla direkta och indirekta kostnader. Effekterna av ordnat införande skulle beräknas utifrån de merkostnader det medfört jämfört med den ökade hälsovinst en ökad täckningsgrad och behandling på korrekt indikation skulle innebära. Styrgruppen för delprojekt 6.2 ansåg att en sådan analys inte är ändamålsenlig givet att kostnads-effektanalyser av nya läkemedel föreligger som underlag för registrering och beslut om införande i läkemedelsförmånen. Forskargruppen vid KI har därför tagit fram en bedömningsmodell som är inriktad på att enbart beakta merkostnaderna av ordnat införande och strukturerad uppföljning relativt den förbättrade läkemedelseffekt på populationsnivå som ordnat införande möjliggör eller lett till. Som utgångspunkt för modellen granskades de kostnads-effektanalyser gällande de aktuella läkemedlen som publicerats i beslut från TLV. Därefter preciserades kostnads- och effektposter för ordnat införande och strukturerad uppföljning enligt följande: • Ordnat införande: kostnader för utbildning och information samt kostnader för anpassningsåtgärder på vårdenhet • Strukturerad uppföljning: kostnader för insamling av data över läkemedelsanvändning, bearbetning och analys av uppföljningsdata och återföring av analysresultat • Kostnadsbesparing vid minskad behandling på fel indikation • Effektvinst till följd av högre täckningsgrad (högre andel behandling på rätt indikation) Baserat på material framtaget inom delprojekt 6.2, kompletterat med dokumentanalys och aktörsintervjuer, gjordes kronologiska fallbeskrivningar av de utvalda pilotprojekten. Datainsamling och analys har vägletts av Pettigrews och Whipps (1993) modell för strategisk förändringsledning. Enligt den fästs uppmärksamhet vid fyra dimensioner av skeendena – förändringens innehåll (det planerade införandet och uppföljningen av nytt läkemedel), förändringsprocessen (hur förändringen genomförts i praktiken), kontexten (de föränderliga förhållanden under vilka förändringen genomförts) och utfall. Utfall bedömdes dels i form av aktörernas bedömning av måluppfyllelse samt kostnader och nytta av arbetet i den utsträckning uppgifter fanns tillgängliga. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 52 (75) 8.2. Resultat Fallbeskrivningarna visar att merparten av delprojekten ännu är pågående, några i linje med uppställda mål och intentioner, andra med viss fördröjning eller avvikelse. PNH-gruppen uppger att man nått huvudmålet – att säkerställa tillgången på eculizumab för PNH-patienter. Företrädare för kvalitetsregistret Auricula påpekar att registret vidareutvecklats för att innefatta också de nya preparaten, vilket motsvarat intentionerna i delprojektet 6.2. Samtliga pilotprojekt uppger att man etablerat system och processer som stöd för ordnat införande och strukturerad uppföljning – ”… arbetet har fungerat bra, … vi har en väletablerad arbetsgång.” Det kunde uttryckas som att struktur- och processmål uppnåtts i samtliga pilotprojekt. Inget av pilotprojekten har nått så långt i sitt arbete att data om klinisk nytta eller merkostnader förknippade med de nya läkemedlen kunnat uppskattas. För behandling med antikoagulantia gäller dock att Sverige kan uppvisa hög kvalitet i behandlingen med warfarin, och de samhällsekonomiska vinsterna av att övergå till de nya preparaten uppges vara försumbara. För tilläggsbehandling med telaprevir vid kronisk hepatit C varierar visserligen täckningsgraden mellan landstingen, men landstingens ”väntelistor” uppfattas vara träffsäkra (dvs. man har identifierat de patienter där behandlingen är indicerad). PNH-gruppen har bedömt i stort sett alla fall och tillämpat en strikt tolkning av indikationerna. Slutsatsen är att pilotprojekten bidragit till en hög precision i aktuell läkemedelsbehandling. Uppskattningarna om täckningsgrad (att samtliga patienter som fyller behandlingskriterierna faktiskt erhåller behandling) är däremot osäkra. Delvis beror detta på att de nya preparaten är komplement till existerande behandling, och att behovet inte upplevts som stort (detta gäller särskilt nya antikoagulantia). Uppföljningen av behandling med de nya preparaten har skett under relativt kort tid, varför patienternas antal är lågt och möjligheterna att bedöma det kliniska mervärdet små. Det innefattar också det särskilda bidrag som ordnat införande och strukturerad uppföljning kan ge. 8.3. Diskussion Ordnat införande har i de aktuella fallen i huvudsak byggts upp kring sjukvårdshuvudmännens existerande läkemedelsorganisation och HTA-enheter. Informations- och utbildningsinsatserna har långt kunnat utnyttja läkemedelsorganisationernas och vårdenheternas befintliga internutbildningar. Merkostnaderna för ordnat införande bedöms av sagespersonerna därför vara små. Pilotprojekten redovisar erfarenheter av strukturerad uppföljning i mycket begränsad omfattning. De internationella exempel som kan identifieras är i huvudsak ”post-marketing surveillance”-studier som läkemedelsföretagen utför på basen av myndighetskrav. I Sverige finns relevant erfarenhet inom reumatologin: forskare med anknytning till Svensk Reumatologis Kvalitetsregister samt forskningsprogrammet ARTIS har under ett antal år genomfört säkerhetsuppföljning av biologiska läkemedel och också ställt resultaten till de aktuella läkemedelsföretagens förfogande. Det är ett exempel på hur en existerande infrastruktur av register som upprätthålls nationellt av myndigheter och inom ramen för den nationella kvalitetsregistersatsningen kan utnyttjas för strukturerad uppföljning av användningen av nya läkemedel. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 53 (75) Ordnat införande och strukturerad uppföljning av nya läkemedel inom de studerade pilotprojekten har som ovan anförts påverkats positivt av en existerande infrastruktur, både i form av en etablerad läkemedels- eller HTA-organisation och register (främst kvalitets- och forskningsregister) som används för uppföljning. Utmaningarna handlar i huvudsak om svårigheter att nå ut till behandlande enheter – framför allt för att trygga följsamhet mot riktlinjer och behandlingsrekommendationer och skapa ett tillräckligt intresse för uppföljning och det merarbete registrering innebär. Detta har betydelse särskilt för täckningsgrad. Övriga försvårande omständigheter utgörs av att arbets- och projektgrupper i de flesta fall arbetar ”i tjänsten” eller ”ideellt” (dvs. genom att utnyttja fritid) och att projekten replierat på ”gratisresurser” som tillhandahållits av arbetsgivare eller specialistföreningar. 8.4. Sammanfattning från Läkemedelsverket I den av MMC:s framtagna modell för samhällsekonomisk bedömning av ordnat införande beaktas merkostnaderna för ordnat införande och strukturerad uppföljning i relation till förbättrad läkemedelseffekt. På grund av pilotprojektens status och utvecklingsnivå vid tillfället för granskning, har inga uppgifter om nytta och merkostnader kunnat uppskattas. Givet det begränsade antal behandlade och den begränsade uppföljningen inom pilotprojekten kan inte heller det kliniska mervärdet bedömas. Befintliga regionala infrastrukturer har enligt författarna medfört endast små merkostnader vid ordnat införande. Man bedömer att i fallet med införande av NOAK är de samhällsekonomiska vinsterna försumbara. I bilaga 3 i rapporten från MMC ges en utförlig beskrivning av organisation och resursbehov för en avancerad säkerhetsuppföljning inom ramen för kvalitetsregister. Där framgår att betydande resurser krävs för denna typ av uppföljning. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 54 (75) 9. Metodologiska aspekter på insamling och analys av uppföljningsdata Styrgruppen för delprojektet 6.2 bedömde det som värdefullt att belysa metodologiska aspekter på val av uppföljning och utvärdering. Under det senaste året har metodhandböcker publicerats av Stockholm läns landsting och SBU samt nyligen även en artikelserie i Läkartidningen (17–19). Här redogörs övergripande för uppföljning och utvärdering av läkemedel som på ett flexibelt sätt måste anpassas till aktuell produkt, terapiområde och frågeställningar. Utvärdering av observationella data erbjuder en del svårigheter jämfört med randomiserade, kontrollerade studier vilket belyses i detta avsnitt. 9.1. Ordnat införande Den ordnade införandeprocessen ska innehålla standardiserade aktiviteter som identifierar och prioriterar på vilken nivå uppföljning ska ske av frågor som ska besvaras. Uppföljningsaktiviteter ska vara bestämda inför det nya läkemedlets lansering och ordnade införande. Frågeställningen avgör nivå för och omfattning av insamling av data och dess utvärdering. 9.2. Strukturerad uppföljning Uppföljning och utvärdering måste anpassas till den eller de frågeställningar som i tidigare process har identifierats och prioriterats. Metodologi för datainsamling, bearbetning och utvärdering måste väljas med hänsyn till frågeställningar och till ämnesberoende faktorer. En utvecklad frågeställning som behöver besvaras ska vara identifierad inför lanseringen. Anpassning till frågeställningen är essentiell och protokollet för aktuell uppföljning måste vara individuellt anpassat för denna. 9.3. Vilka frågor kan ställas och besvaras? Frågor som man behöver ha besvarade styr vad som behöver göras och på vilken nivå uppföljningen ska ske och därmed vilka resurser som ska allokeras. Följande exempel kräver olika typer av uppföljningar: Hur används läkemedlet – följs riktlinjer, rekommendationer och myndighetsbeslut? Vad är nyttan i praktiken vad gäller läkemedlets effektivitet, dess säkerhet och möjliga biverkningar samt effekter på patienternas livskvalitet? Vilka är kostnaderna ur budget- respektive hälsoekonomiskt perspektiv? För vilken aktör och på vilken nivå i samhället är frågan av intresse – patient, vårdgivare, klinik, landsting, region, nationellt eller i förekommande fall Europanivå? Hur snabbt behöver vi svaren? Med dessa exempel och ur en prioriteringssynpunkt är det inte givet att man vill veta alla dessa saker vid ett och samma tillfälle och inte heller i samma omfattning för alla nya läkemedel. Det avgörande är frågeställningen som identifierats och som behöver besvaras för aktuellt läkemedel. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 55 (75) Figur 16. Nyckelfrågor som bör beaktas inför planering av beslutat ordnat införande och strukturerad uppföljning. 9.4. Hur kan man göra? Utgångspunkten är alltid vilka frågeställningar som ska besvaras (se Figur 16). Bearbetning av data från en klinisk miljö är inte oproblematiskt ur praktisk och vetenskaplig synvinkel. Det är inte enbart en fråga om ansvarsfördelning. Tolkningar och slutsatser kräver ämnes- och metodkunskaper. I sammanhanget finns begränsade kunskaper om ett nytt läkemedel vid godkännandet och det bör identifieras vad som ytterligare behövs. Här spelar läkemedelsmyndigheter en central roll. I samband med godkännandet kan villkor ha lagts, så kallat Post Authorisation Commitment (PAC) vilka är myndighetskrav med EMA och Läkemedelsverket som avnämare. På motsvarande sätt kan TLV begära in data för att besluta att ett läkemedel ska ingå i förmånen. Rapporteringsskyldigheten ligger här hos innehavaren av marknadsföringstillståndet för läkemedlet. 9.5. Vad styr läkemedelsbehandling och uppföljning i praktiken? Nationella och lokala riktlinjer, rekommendationer och vårdprogram samt förmånsbeslut styr valet och genomförandet av behandlingen. I det individuella fallet tas hänsyn till en mängd faktorer som avgör det slutliga valet av behandling. Beslutet om behandling för den enskilde tas åtskilt från ett beslut om uppföljning, som inkluderar den enskildes data. Till skillnad från en randomiserad studie där behandlingen i förväg beskrivs i ett protokoll och slumpvis fördelas till berörda patienter, så finns det i den klinisk praktiska uppföljningen olika typer av skevheter (bias) och förväxlingsfaktorer (confounding) som måste beaktas vid utvärderingar. Sådana är relaterade till såväl läkemedelsbehandlingen som till sjukdomen och dess utfall vilket kräver ämneskunskap för att kunna beaktas. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 56 (75) Vidare finns mer allmängiltiga faktorer att beakta som jämlikhetsaspekter, kön, ålder, etnicitet och socioekonomiska faktorer samt regionala och geografiska skillnader. 9.6. Datainsamling och kvalitet Datainsamling från klinisk praxis innehåller utmaningar. Vilken typ av data behövs för uppföljning och utvärdering av det nya läkemedlet? Frågan är avgörande för om existerande datakällor som journaler eller register från exempelvis Socialstyrelsen, Statistiska Centralbyrån eller nationella kvalitetsregister kan användas eller om data måste inhämtas särskilt, exempelvis genom en prospektiv datainsamling i sjukvården. Datas struktur och format är olika i olika datakällor och deras tillgänglighet är omgärdad av olika regelverk. Vidare kan kvalitet eller validitet och precision skilja. Det kan föreligga skevhet vad gäller tillgång till information mellan olika sjukdomsområden. Felklassificering kan föreligga. Därför bör de data som ska användas kvalitetssäkras systematiskt och spårbarhet ska synliggöras i processen. De faktorer som anges i ovanstående stycke måste tas omhand i den senare analysen men data för dem måste samlas in prospektivt från start av läkemedelsbehandlingen. Nyttan av strukturerad, databasrelaterad journalföring, standardiserad nomenklatur och formatering för nationell harmonisering och syntes framstår som klara och nödvändiga aspekter att lösa för effektiv uppföljning. Bra tekniska lösningar ersätter dock inte behovet av professionell ämnes- och metodkunskap som idag är fragmenterad och ofta kan återfinnas relaterad till de nationella kvalitetsregistrens arbete. 9.7. Bearbetning och analys Designen av uppföljningen och analysen avgörs utifrån frågeställningen. Till skillnad från en klinisk prövning där behandlingen för patienten avgörs i förväg i ett protokoll så förskrivs behandling i klinisk praxis i samråd med patienten med beaktande av dennes enskilda karakteristik och behandlingsriktlinjer. Här är observationell uppföljning det enda rimliga alternativet och olika studiedesigner är mer eller mindre ändamålsenliga. Vid analyser av klinisk praxis måste man ta hänsyn till om skattningar av samband påverkas av bristande precision eller av systematiska fel som leder till under- eller överskattning av samband, eller att förväxlingsfaktorer stör sambandsmätningen och bedömningen. För att kunna optimera uppföljningen krävs såväl ämneskunskap som metodkunskap för att avgöra ändamålsenlighet och göra bedömningar av svagheter och styrkor i analysen. Förväxlingsfaktorer varierar mellan olika sjukdomsområden och behandlingsmöjligheter och med sjukdomars aktivitet och symptom över tid. Tolkning, bedömning och slutsatser av uppföljningen ska ske utifrån de metodologiska utmaningar som hör samman med hur frågeställningen har angripits och är avgörande för vilka slutsatser som kan dras av studien. 9.8. Rapportering och avnämare Avnämare för rapporter beror på de uppställda frågeställningarna. Läkemedelssäkerhet är av intresse för Läkemedelsverket och EMA. Hälsoekonomiska aspekter berör TLV. Det vill säga såväl nationella och europeiska myndighetsperspektiv behöver anläggas. Vidare så berör frågor av budgetkaraktär intressenter på nationell, regional, läns- eller kliniknivå samt olika intresseorganisationer. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 57 (75) Ytterligare intressenter är förskrivare som är intresserade av effekt- och säkerhetsfrågor samt riktlinjerelaterade frågor. Vid rapportering kan så kallad rapporteringsbias uppstå vid urvalet av resultat till de olika rapporterna med avseende på avnämarna. Vidare kan rapporteringsbias uppstå som en följd av skillnader i transparens respektive publik tillgång till handlingar. 9.9. Värdering av rapporter och åtgärder En fråga som bedömts nödvändig att följa upp är en fråga vars svar påverkar fortsatt användning, förmånsbeslut och budgetplanering. Svaren på frågan utgör grunden för den värdering som görs och bedömning av vilka följder det får samt beslut om åtgärder. Läkemedelsverkets unika roll i sammanhanget är perspektiven ur såväl europeisk som nationell myndighetsutövning för godkännandeprocessen och säkerhetsuppföljningen. Vidare ger Läkemedelsverket nationell och central rådgivning till läkemedelsindustri, förutom arbetet med utredningar inför godkännanden och granskande myndighetsutövning efter godkännandet ur ett läkemedels livscykelperspektiv. Exempelvis utgör den lagstadgade biverkningsrapporteringen, som nu kan ske elektroniskt, en viktig del av detta. Hälsoekonomiska analyser och grunden för subventionering av läkemedel bedöms av TLV som har modeller för detta. Budgetpåverkansanalys belyses i SLL:s handbok och omfattar olika typer av hälsoekonomiska utvärderingar som kostnadsminimeringsanalys, kostnads-effektanalys, kostnadsnyttoanalys och kostnads-intäktsanalys. Dessa bör kunna vara generaliserbara men kan behöva anpassas till lokala förutsättningar. 9.10. Nivå och omfattning av strukturerad uppföljning Nivågruppering, från rutinmässig och basal till avancerad och mer detaljerad uppföljning, bestäms av de frågeställningar och den angelägenhetsgrad som bedömts föreligga. Krypterad information med individdata om apoteksexpeditioner finns tillgänglig redan idag. Med idag tillgänglig teknik bör registerdata kunna länkas för en basal, rutinmässig uppföljning av samband mellan exponering för ett visst läkemedel och utfall i befintliga register vid Socialstyrelsen. Utvidgning genom länkning av befintliga kvalitetsregister till hälso- och läkemedelsregister för att erhålla mer specifik sjukdomsinformation kan göras för jämförelser inom aktuellt sjukdomsområde eller flera sådana genom kombinationer av sjukdomsspecifika kvalitetsregister. Exempel utgör de nationella kvalitetsregistren för reumatiska sjukdomar, diabetes och hjärtsjukdomar. Mer avancerad bearbetning kräver inhämtande av data från fler källor, som extraktion ur befintliga datajournaler med eller utan komplettering av nyinhämtning av specifik information liknande klinisk prövning. Detaljeringsgraden ger stora behov av arbetsinsatser och torde endast bli aktuellt för prioriterade läkemedel. Kombinationer av ovanstående nivåer kan behövas med hänsyn till multipla frågeställningar i förekommande fall. Övergripande slutsatser om nuvarande och framtida möjliga processer och tidsaspekter för dessa, återspeglas i rapporten om uppföljning av följsamhet (se kapitel 7 och Bilaga III). Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 58 (75) På samtliga nivåer bör patientdata som avspeglar ålder, kön, socioekonomisk status och bostadsort ingå för att möjliggöra analys av och korrigeringar för dessa faktorer, vilka i sig kan ha inverkan på det utfall som följs upp. Utöver ovanstående principiella, stegvisa angreppssätt så kan med hänsyn taget till en sjukdoms relativa ovanlighet flernationsansatser behöva göras. En typisk sådan situation är säkerhetsperspektivet för läkemedel som hanteras på EU-nivå. Prioriteringsgrunder för val av nivå, från basal till en mer avancerad, samt lokal, regional eller nationell ansats torde inbegripa allvarliga säkerhetsfrågor som önskas belysas. Vidare kan höga kostnader för behandlingen i relation till förväntade effekter och i relation till patientgruppens storlek också utgöra grund för prioritering till uppföljning. Därtill kan samhällskostnaderna öka när ny läkemedelsbehandling som påverkar behovet av personal och utrustning introduceras, exempelvis injektionsläkemedel som ersätter laserbehandling vid ögonsjukdomar. 9.11. Datakällor Socialstyrelsen ansvarar för ett antal hälsodataregister, bland annat: Läkemedelsregistret som innehåller uppgifter om läkemedel som hämtats ut mot recept på apotek; Patientregistret som innehåller diagnoser och åtgärdskoder för alla avslutade vårdtillfällen i sluten vård och specialiserad öppen vård; Cancerregistret som har information om klinisk och morfologisk diagnos, diagnosdatum samt tumörutbredning; Dödsorsaksregistret, omfattar alla avlidna personer som vid tidpunkten för dödsfallet var folkbokförda i Sverige; samt medicinska Födelseregistret, som innehåller uppgifter om själva graviditeterna, förlossningarna och om de nyfödda barnen. Registren baseras på personnummer och kan länkas till varandra och andra externa register som exempelvis register hos Statistiska centralbyrån, där socioekonomiska data kan erhållas inom ramen för forskning. De flesta cancerläkemedel administreras på sjukhus och ofta beställs de på rekvisition. Därmed återfinns de inte i Läkemedelsregistret. Utredning angående uppföljning görs inom den nationella cancerstrategin. Extraktion av data ur journalsystem har utretts och genomförts i SLL inom ramen för Innovisprojektet där fortsatt redovisning bör kunna ligga till grund för vidareutveckling till rutinmässig extraktion av data på systematiskt sätt. Likaså belyses dessa aspekter separat i kapitel 7 vad gäller sjukvårdshuvudmannens patientuppgifter. Nationella vaccinationsregistret är ett hälsodataregister hos Smittskyddsinstitutet. Obligatorisk rapportering av vaccinationer som ingår i det allmänna vaccinationsprogrammet ska ske av vårdgivare till registret. Laboratoriedata i sjukvården kvalitetssäkras lokalt men är inte generellt tillgängliga. För att kunna använda laboratoriedata för uppföljning på nationell nivå behövs en etablering av en nationell databas för laboratorieresultat. Viktigt att beakta vid länkningsstudier är de regler, lagar och föreskrifter som gäller vid forskning. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 59 (75) 10. Generella slutsatser och rekommendationer 10.1. Projektets målbild Målbilden för delprojektet 6.2 kan hämtas ur beskrivningen av ett av de centrala insatsområdena i nationella läkemedelsstrategin ”Upprätta en process för ordnat och effektivt införande samt utöka uppföljning av läkemedels användning och effekter”. I större detalj framgår målen i Läkemedelsverkets regleringsbrev formulerat som ”… med erfarenhet från pilotprojekten utvecklas mer generella slutsatser och rekommendationer för utformning av införandeprotokoll och samordnad uppföljning av nyintroducerade läkemedel”. Fokus för detta projekt har varit uppföljning. De pilotprojekt och modeller för ordnat införande och strukturerad uppföljning som beskrivs i denna rapport måste bedömas i ljuset av deras olika kontext och målsättning. Det är inte möjligt att utgående från dem presentera en generell rekommendation för införande och uppföljning som gäller för alla tänkbara situationer. Exempelvis kan introduktion och uppföljning av en avgränsad behandlingsinsats i en liten patientgrupp vara framgångsrik utan tillskott av resurser medan en större eller i klinisk praxis oprövad intervention kan kräva betydande resurstillskott och även organisatoriska förändringar. Flera av pilotprojekten har ambitiösa introduktionsprogram men har inte kommit lika långt med genomförande av strukturerad uppföljning. De studerade pilotprojekten har initierats på olika sätt av landsting, enskilt eller i samverkan, av professionsdrivna kvalitetsregister eller företag. VGR och SLL har egna ordnat införande-projekt för nya antikoagulantia, 4-länsgruppen har samverkat kring nya hepatit C-läkemedel, Auricula och RAregistret har egna uppföljningsmodeller, en företagsinitierad modell har prövats för läkemedel vid tuberös skleros och uppföljning av PNH-behandling görs i ett professions-företagsgemensamt projekt inom EU. Ett antal iakttagelser är dock gemensamma för flera av pilotprojekten och kan därför utgöra grund för förslag till åtgärder för att förbättra införande och uppföljning av nya läkemedel och andra behandlingsinsatser. Generella slutsatser diskuteras utifrån ett antal perspektiv som bör beaktas när man i detalj ska utforma optimala processer för introduktion och uppföljning, och kan ses som ett underlag för delprojekt 6.1 inom den nationella läkemedelsstrategin. En del av förslagen i denna rapport har tidigare diskuterats bland annat inom ramen för Delegationen för Samverkan inom Klinisk Forskning och dess KUR-projekt (20) men har också framförts i ”Guldgruverapporten” om kvalitetsregister (21). Om möjligheterna att förbättra införande och uppföljning av nya behandlingar inte tas tillvara finns risk för sämre patientsäkerhet, bristande jämlikhet och dålig kostnadskontroll. Förutom de negativa medicinska och ekonomiska konsekvenserna riskerar man också ett trovärdighetsproblem, inte minst internationellt, då Sverige under flera år framhållits som en idealisk miljö för registerbaserad uppföljning som stöd till klinisk forskning och innovation. 10.2. Generella slutsatser De generella slutsatser som diskuteras i detta avsnitt redovisas inte i en fördefinierad prioritetsordning, utan snarast efter den grad av tydlighet med vilken de framträtt i det insamlade underlaget. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 60 (75) 10.2.1. Klinisk förankring och professionella incitament Behovet av klinisk förankring och de problem som uppstår när den saknas blir tydliga i några av pilotprojekten. Även om orsakerna inte utretts i detalj står det klart att introduktions- och uppföljningsprojekt som inte förankrats bland ansvariga kliniker sällan blir framgångsrika. De modeller som uppvisar god klinisk förankring har en lång föregående utvecklingsperiod med god tid att skapa acceptans. Man kan beskriva det som att det krävs en viss ”mognadstid”, som kan vara flera år. Då det inte är rimligt med denna tidsfördröjning för att nå acceptans för en uppföljning av ett nytt läkemedel, måste värdet av uppföljning generellt förklaras och förankras bättre än hittills. I de fall man kunnat utarbeta uppföljningsmodellen med ett nerifrån-och-upp-perspektiv torde det ha bidragit till framgång (till exempel RA, MS, PNH). De modeller som fungerar bäst drivs i en väl avgränsad klinisk miljö, exempelvis där behandlingen sköts på sjukhus/specialistmottagningar (till exempel Auricula, RA, MS, PNH). I denna miljö finns också andra yrkeskategorier, förutom förskrivare, som kan engageras i uppföljning och bidra till att bredda förankringen. Om uppföljningen fungerar som beslutsstöd underlättar det för förskrivaren i behandlingssituationen och uppväger det extra arbetet med inmatning av information som en strukturerad uppföljning innebär (till exempel RA, MS, Auricula). Terapi som vid introduktionen uppfattas som behandlingsgenombrott av stort värde för patienterna motiverar professionen för den extra insats som inmatning av uppföljningsdata innebär (till exempel biologiska läkemedel vid RA och MS). Möjligheter att genomföra forskning med insamlade data bidrar till professionellt engagemang i uppföljningsmodellen/registret och innebär en strävan mot god datakvalitet och täckningsgrad. Erfarenheter från kvalitetsregister talar dock för att ”forskningsbara” data inte alltid utnyttjas vilket innebär att ytterligare incitament kan behövas. Möjlighet till internationellt forskningssamarbete kan vara ett sådant (22, 23). ”För hög grad av frivillighet” i vissa situationer, dvs. de som i sitt kliniska vardagsarbete förväntas bidra i uppföljningsarbete ser inte detta som en prioriterad arbetsuppgift. Det kan bero på dålig förmåga hos beställarna (huvudmän, myndigheter) att förklara nödvändigheten av att genomföra en viss typ av uppföljning och att tillföra adekvata resurser. Exempelvis är regulatoriska krav på företagen ofta legalt tvingande för fortsatt marknadsföringstillstånd eller subvention. Det är å andra sidan förståeligt att flera samtidiga uppföljningsprojekt inom samma terapiområde, med olika företag inblandade, kan komma att överbelasta en viss klinik och leda till ”registreringströtthet”. Detta talar för lösningar där kliniska enheter – resursförstärkta – ansvarar för uppföljningsdata inom sin specialitet. Data som sedan kan levereras till ett företag eller en annan avnämare för deras specifika produkt eller frågeställning. Regulatoriska myndigheter bör också undvika onödiga uppföljningskrav som riskerar att överbelasta sjukvården. Indirekta bonuseffekter kan uppkomma när man strukturerar introduktion och uppföljning av nya läkemedel. De beskrivna pilotprojekten med NOAK kan exempelvis tydliggöra att en underbehandling av förmaksflimmer föreligger och leda till att fler får behandling. Det nyligen inrättade narkolepsiregistret (inom Svenska Neurologiregister) har inneburit att inte bara barn utan också fler vuxna patienter med narkolepsi fått möjligheter till förbättrad läkemedelsbehandling och strukturerad uppföljning och därmed mer jämlik vård. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 61 (75) En av modellerna visar på en situation där obligatorisk uppföljning upplevdes som väl motiverad. Det gäller den licensförskrivning som möjliggjorde tidig introduktion av TNF-hämmare och innehöll ett tvingande krav på uppföljning för att få licensansökan godkänd. Detta gav initialt en 100 % -ig anslutning till registeruppföljning som kunde bibehållas i väsentligen samma utsträckning i ett senare frivilligt system. 10.2.2. Patientmedverkan Aktiv patientmedverkan är mycket begränsad i de flesta pilotprojekten. Ett exempel där patienterna aktivt medverkar är i RA-registrets så kallade PER-modul (Patientens Egen Registrering). Den möjliggör rapportering av upplevd hälsa antingen via Internet hemma eller på mottagningen och innebär en aktiv medverkan i behandlingen för patienten men säkrar också att upplevda symtom registreras i uppföljningen. Patienter efterfrågar i ökande utsträckning information om sin sjukdom och då kan egenrapporterade uppgifter om hälsotillståndet över tid vara av särskilt värde. 10.2.3. Personella och ekonomiska resurser Bristande tillgänglighet avseende såväl klinisk kompetens, analyskapacitet och möjlighet till återföring påtalas av informanterna i pilotprojekten eller kan utläsas ur insamlad dokumentation. Det kan medföra försenad analys och återföring men gör också uppföljningssystemet sårbart. För särläkemedel och andra områden med fåtaliga kliniska experter skulle generell kompetens avseende datainsamling och analys kunna tillhandahållas från exempelvis regionala kvalitetsregistercentra, Socialstyrelsen, universitetslandsting/regioner eller akademiska grupper för att motverka detta. Det är också viktigt att landstingens läkemedelsenheter har resurser att sammanställa uppföljningsdata såväl för egna som nationella behov. Säkrad finansiering för uppföljningen genom avtalad ersättning från företag och/eller beviljade kvalitetsregistermedel är avgörande inte minst för modellens uthållighet över tid (till exempel RA, MS). Förhållandet mellan olika uppföljningsmodellers kostnad och nytta på en övergripande nivå diskuteras i rapporten från MMC (Bilaga IV). Merkostnaden för rutinmässig uppföljning bedöms i rapporten vara marginell med hänvisning till en väl utbyggd läkemedelsorganisation i landstingen och redan etablerade register. I fallet med införandet av NOAK bedömer man att de samhällsekonomiska vinsterna är försumbara. I bilaga 3 i MMC:s rapport ges exempel på resursåtgång för uppbyggnad och drift av kvalitetsregisterbaserad säkerhetsuppföljning för nya biologiska läkemedel. För avancerad uppföljning som kräver registerlänkningar, personal med särskild kompetens för datasammanställning, analys med mera är resursåtgången betydande. Eftersom pilotprojekten i mycket begränsad utsträckning genomfört uppföljningsfasen är den slutliga relationen mellan deras kostnad/nytta inklusive möjliga immateriella vinster, i nuläget inte möjliga att avgöra. 10.2.4. Ansvar och samverkan Flera av pilotprojekten tycks haft svårt att gå från introduktion till uppföljning. Denna genomgång medger inte fördjupad analys av möjliga orsaker, men oklarheter gällande ansvar och logistik verkar föreligga. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 62 (75) Många aktörer och system är involverade i olika delar av uppföljningen så risker för oklara ansvarsförhållanden och dubbelarbete är uppenbara. Uppföljning av läkemedel i klinisk praxis är under stark utveckling, dvs. i viss mening ”ett rörligt mål” med många pågående aktiviteter som inte är samordnade i alla delar. Exempelvis arbetar man inom cancerområdet med att upprätta ett eget läkemedelregister på INCAplattformen, en IT-plattform för hantering av register inom cancervård. Det utgör ett slags metaregister baserat på data från de kvalitetsregister som ingår i INCA. En fördel kan vara att även rekvisitionsläkemedel ingår. Värdet av detta register är dock beroende av kvaliteten på läkemedelsdata i de ”under-register” som levererar data. Inom ramen för Cancerstrategin har rapporten ”Nationell samordning för strukturerat införande och uppföljning av nya cancerläkemedel” tagits fram (24). Man föreslår där att en nationell funktion för analys av läkemedelsanvändning inrättas. Denna funktion ska utnyttja befintlig kompetens vid Regionala cancercentra (RCC) och kan utgöras av en fysisk enhet vid ett RCC eller fungera som en distribuerad kompetensmodell. Utgående från ett samarbete mellan Uppsala och Umeå universitet (U-CAN) finns planer på en nationell cancerportal, framför allt med syfte att främja forskning med utnyttjande av biobanksmaterial bland annat för att värdera effekter av läkemedelsbehandling. Projekt med ordnat införande på antibiotikaområdet har initierats utan uppenbar koppling till andra nationella ansatser. Många kvalitetsregister saknar data av tillräcklig omfattning eller kvalitet vad gäller läkemedel, för att en meningsfull uppföljning ska kunna genomföras. Ännu färre har uppgifter om biverkningar eller organiserad rapportering av dessa till Läkemedelsverket (5). Den nya proceduren för införande av nya vacciner i det nationella programmet har sin styrka i transparens och en klargjord ansvarsfördelning. Modellens höga granskningsambition ger en viss tröghet varför det inte är användbart i situationer som kräver en snabb introduktion av nya vacciner, exempelvis vid en pandemi. Flera led av sakkunnigbedömning innebär ett stort behov av experter. På liknande sätt finns behov av experter för bedömning av nya läkemedel vid introduktion och uppföljning. Dessa experter ska också räcka till för riktlinjearbete, rekommendationer med mera. Detta ställer krav på hushållning och flexibel samverkan mellan alla berörda. Synergier inom uppföljningsområdet bör kunna uppnås genom att stimulera samverkan och kunskapsutbyte mellan olika initiativ som de ovan beskrivna. 10.2.5. IT-stöd och data för uppföljning Användarvänliga IT-stöd med enkla inmatningsrutiner som är anpassade till det kliniska arbetet är nödvändiga. Ett exempel är möjligheten att rapportera biverkningar elektroniskt direkt från kvalitetsregister som bidragit till en väsentligt ökad rapporteringsfrekvens. Datafångst direkt ur patientadministrativa system och journaler ger fördelar gentemot insamling från separata register. För de utvalda pilotprojekten är denna möjlighet begränsad till ett fåtal landsting/regioner. Arbete med att utveckla dataöverföring mellan kvalitetsregister och journalsystem pågår i CeHIS/SKL:s regi. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 63 (75) För rekvisitionsläkemedel är tillgången till individdata begränsad vilket försvårar möjligheten till rikstäckande uppföljning . En rapport från CeHIS, oktober 2013 (25), konstaterar att ett betydande och tidskrävande arbete krävs för att åstadkomma en nationell lösning på detta problem. Svårigheter att få tillgång till data för regulatoriskt motiverade uppföljningar har konstaterats, exempelvis i samband med Läkemedelsverkets utredning om ökad risk för narkolepsi efter vaccination med Pandemrix i samband med pandemin 2009/10. En utförlig beskrivning av möjligheterna att i Sverige genomföra de studier som betingas av olika myndighetskrav från EMA, Läkemedelsverket och TLV ges i en rapport från Centrum för farmakoepidemiologi vid Karolinska Institutet (CPE) (4). Rapporten konstaterar bland annat att mycket av den information som efterfrågas finns i befintliga register. Vissa landsting har möjlighet att extrahera uppgifter direkt ur egna vårddatalager för samkörning med läkemedelsdata. För nationella behov innebär det att denna typ av information måste inhämtas separat från varje landsting vilket utgör en mycket tids- och arbetskrävande procedur. För att följa upp effekt och säkerhet av ett visst läkemedel krävs i praktiken länkningsstudier, dvs. data om exponering (läkemedelsförskrivning) kopplas till utfall som cancer, död etc. Information om detta hämtas oftast från hälsodataregister hos Socialstyrelsen. Studier av effekt och säkerhet i klinisk praxis genomförs oftast som observationella studier. Enstaka stora landsting/regioner kan räcka till för vissa frågeställningar, men oftast krävs en nationell ansats och för särläkemedel krävs flernationella uppföljningar. I Norden finns goda möjligheter att genomföra sådana studier. Sammanfattningsvis visar rapporten från CPE att uppföljning av läkemedels effekt och säkerhet oftast kräver en nationell ansats och länkning av data från hälsodataregister och skiljer sig därmed från den uppföljning som behövs för lokalt kvalitetsarbete, följsamhetsstudier och kostnadskontroll. Det är också viktigt att studiernas utformning bidrar till att även möta de regulatoriska krav som åligger företagen. Det finns såväl logistiska som juridiska oklarheter kring ägande och utlämnande av data som krävs för olika uppföljningar. I delrapporten från NEPI (se Bilaga III) diskuteras många detaljerade förslag till åtgärder för att förbättra IT-stöd och datatillgång. Pågående utredningar om registerforskning (26, 27) bör verka för regeländringar som förbättrar förutsättningarna för strukturerad uppföljning av läkemedel och andra behandlingsinsatser. 10.2.6. Uppföljning av följsamhet I delrapporten från NEPI (se Bilaga III) framgår att för att följa förändringar i läkemedelsanvändning utnyttjar landstingen i huvudsak aggregerad försäljningsstatistik. Antibiotikaanvändning och läkemedel till äldre är de mest studerade områdena. Basuppföljning av exempelvis följsamhet till rekommendation för receptförskrivna läkemedel kan genomföras med tillräcklig kvalitet med användning av Läkemedelsregistret. Användningen av Läkemedelsregistret kan utvecklas, inte minst genom att studera mönster för nyinsättning i stället för totala antalet användare. En försöksverksamhet i Cambio COSMIC visar på möjligheterna att med ett integrerat beslutsstöd i journalsystem med strukturerade data förbättra dokumentation och beslutsunderlag vid ordnat införande och strukturerad uppföljning. Uppföljning som görs inom ramen för lokalt kvalitets- och budgetarbete behöver särskiljas från uppföljning som behöver genomföras på nationell nivå, exempelvis på grund av regulatoriska krav eller frågeställningar som kräver nationella data för att kunna besvaras. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 64 (75) För aktiviteter under införandefasen är en nationellt samordnad procedur naturlig. Grundläggande metodologi vid uppföljning bör vara gemensam, men procedurerna kan variera med hänsyn till frågeställning (se Figur 17 och Tabell II). Figur 17. Schematisk illustration av proceduren för ordnat införande (huvudsakligen horizon scanning, bedömningsrapport, förhandling/avtal, prioritering, rekommendation) respektive strukturerad uppföljning av nya läkemedel (uppdelad beroende av frågeställning). 10.3. Rekommendationer och förslag De rekommendationer och förslag som presenteras i detta avsnitt grundar sig huvudsakligen på de pilotprojekt och andra modeller som analyserats. Information från andra källor och synpunkter från styrgrupp med flera har dock också inarbetats för att fånga upp väsentliga synpunkter utanför pilotprojekten. 10.3.1. Tydligare fördelning av ansvar för uppföljning • Ansvar för uppföljning ska klargöras genom att en tydlig nivåstrukturering och fördelning av arbetsuppgifter genomförs. Den bör utgå från såväl formellt ansvar som faktisk utförarkapacitet. Vissa nationella uppdrag kan med fördel utföras av utsedda landsting/regioner, enskilt eller i samverkan, akademiska centra eller andra aktörer men resultaten ges nationell status genom att beställaren är en myndighet eller annan aktör med nationellt ansvar. För att tydliggöra ansvaret bör man skilja på beställare och utförare av uppföljningsuppdrag. En aktör kan dock i vissa situationer ha båda rollerna. • Ett råd tillsätts med uppgift att för nationella uppföljningar föreslå fördelning av ansvar mellan berörda aktörer. Gruppen säkrar bland annat koppling till befintliga EU-krav för de, oftast i central procedur godkända läkemedel, som är aktuella för ordnat införande och strukturerad uppföljning. I rådet bör de aktörer ingå som har nationellt ansvar för uppföljning av läkemedels effekt, säkerhet, kostnadseffektivitet och följsamhet till nationella riktlinjer. • En inventering genomförs som förutom landsting och regioner omfattar RCC, regionala kvalitetsregistercentra, akademiska grupper/institutioner eller myndigheter, för att identifiera aktörer med utförarkapacitet. På basen av denna kan en arbetsfördelning göras. Någon form av certifiering av utförare kan övervägas. Lämpligen ingås överenskommelser (”beredskapsavtal”) med potentiella utförare så att resurser finns avsatta när ett uppföljningsuppdrag – även med kort förvarning – blir aktuellt. För exempel se Tabell II. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 65 (75) Tabell II. Hypotetiska exempel på möjlig ansvarsfördelning vid olika uppföljningsfrågeställningar. Två huvudtyper av uppföljning föreslås, bas respektive avancerad. Frågeställning Nivå Ansvarig (för beställning och återföring) Hur är följsamheten till rekommendation A? Bas Landsting/region Får man bröstcancer av y-hämmare? Avancerad Företag, Läkemedelsverket, EMA Är z-antikroppen kostnadseffektiv vid MS? Avancerad TLV Motsvarar kostnaden för det nya z-läkemedlet landstingets prognos? Bas Landsting/region Är tb-screening inför TNFi-behandling effektiv? Avancerad Läkemedelsverket, Smittskyddsinstitutet Hur stor andel äldre patienter förskrivs ickerekommenderade sömnmedel? Bas Landsting/region Har nytta/riskbalansen för infusionslösning X förändrats? Avancerad Läkemedelsverket Finns regionala skillnader i förskrivning av ydronate? Könsfördelning? Bas Socialstyrelsen • Ansvar för återföring av resultat behöver klargöras och i första hand knytas till beställaren, dvs. den som ställt frågan bör vara den som tolkar och förmedlar svaret. Viktigt är att återkopplingen upplevs som relevant av vården, speglar en nationell samsyn och resulterar i en jämlik introduktion av en ny terapi över landet. 10.3.2. Tidig identifiering av uppföljningens frågeställning • Uppföljningsfrågeställning och förankring säkras tidigt. All planering av beslutad uppföljning inleds med att fastställa vilken frågeställning som ska besvaras (se kapitel 9). Produktspecifika frågor identifieras redan vid planerad introduktion och relateras till potentiella säkerhetsproblem, subventionsbegränsningar etc. 10.3.3. Klinisk förankring och professionella incitament • Förankring i berörda verksamheter och professioner görs tidigt och med en trovärdig och kliniskt relevant motivering för den beslutade introduktionen/uppföljningen. • Positiva professionella drivkrafter identifieras och förstärks. Exempelvis beaktas vid planering och genomförande av uppföljningsprojekt forskningsmöjligheter, att registrering av uppföljningsdata ger ett tydligt kliniskt mervärde etc. • Åtgärder vidtas för att öka kunskapen om och förståelsen för regulatoriska uppföljningskrav och hur dessa kan hanteras i klinisk praxis. Detta kan kräva en mera proaktiv ansats bland annat från myndigheter. • Kraven på vetenskaplighet i uppföljningsstudier är sådana att resultaten också av sjukvårdens professioner ses som relevant och trovärdig evidens för det kliniska arbetet och dess prioriteringar. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 66 (75) Resurser och tekniska lösningar är viktiga men identifiering av de medverkandes incitament att engagera sig och förstärkning av dessa förefaller vara en av de viktigaste framgångsfaktorerna. 10.3.4. Patientperspektivet • Framtidens patienter kommer att vara alltmer informerade, mer delaktiga i behandlingsbeslut men kommer också kunna fungera som en viktig rapportör av uppföljningsinformation. En mera individualiserad läkemedelsbehandling grundad på bioinformatiska data (”personalized medicine”) ökar betydelsen av patientmedverkan. Patientaspekter behöver i större utsträckning vägas in redan vid planering av ordnat införande och strukturerad uppföljning av nya läkemedel. 10.3.5. EU-aspekter beaktas i större utsträckning • Uppföljningskrav som genereras av regulatoriska beslut exempelvis drivna av den nya europeiska farmakovigilanslagstiftningen, beaktas vid organiseringen av nationell uppföljning av läkemedel. Befintliga strukturer och regelverk inom godkännandeproceduren, exempelvis verktyg som PASS (Post authorisation safety studies), PAES (Post authorisation efficacy studies) och ”compassionate use”, bör kunna utnyttjas tydligare inom nationellt ordnat införande och uppföljning. Läkemedelsverket och TLV bör ha särskilt ansvar för detta. • Möjligheter/behov av samverkan inom EU och särskilt Norden beaktas framför allt avseende uppföljning av särläkemedel och andra interventioner med små patientpopulationer. Uppföljningar som behöver samordnas mellan flera länder kräver längre framförhållning och planering. • Hälso- och sjukvård, regulatoriska myndigheter och industri behöver utveckla nya former för samarbete om tillämpningen av stegvisa godkännanden av nya läkemedel (”adaptive licensing”) kommer att öka som en följd av en pågående utredning av EMA. 10.3.6. Forsknings- och innovationsaspekter • Möjligheten till innovation och forskning beaktas vid val av uppföljningsmodell och ingår som ett kriterium vid beslut om strukturerad uppföljning. • Bearbetning och analys av uppföljningsdata akademiseras genom utnyttjande av befintliga kompetenscentra som Regionala cancercentra, kvalitetsregister, epidemiologiska universitetsenheter med flera. • Samverkan utvecklas mellan de enheter som ansvarar för den rutinmässiga uppföljningen i kliniken och biobanker samt forskningslaboratorier. • Rapporter med resultat från uppföljning som tas fram i landstings- eller myndighetsregi i ökande utsträckning publiceras i vetenskapliga tidskrifter och inte endast cirkuleras inom egna interna system. • Arbetet med att utveckla former för uppföljning, särskilt avseende forskningsmöjligheter, samordnas mellan olika terapiområden eller åtminstone med ett systematiskt utbyte av erfarenheter, exempelvis cancer, antibiotika, inflammationssjukdomar – vilka torde ha olika erfarenheter av uppföljning av läkemedel. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 67 (75) 10.3.7. Datatillgång och IT-stöd • Möjligheter att överföra data mellan journalsystem och kvalitetsregister utvecklas genom att pågående projekt påskyndas. • Elektronisk biverkningsrapportering från journalsystem och kvalitetsregister införs med systematisk återföring av sammanställda och tolkade resultat. • Möjligheter att inkludera för uppföljning viktiga patientrapporterade utfallsmått förbättras i såväl journalsystem som kvalitetsregister. • Åtgärder vidtas för att förbättra information om läkemedel i utvalda kvalitetsregister. • Möjligheterna att följa upp rekvisitionsläkemedel förbättras till samma nivå som receptförskrivna läkemedel. För detta krävs ändringar i gällande författningar och föreskrifter. • Uppföljningsmöjligheter för vacciner som inte ingår i det nationella vaccinationsprogrammet och därmed registreras i Vaccinationsregistret skapas, förslagsvis genom utveckling av informationssystemet Svevac. • Möjligheterna att följa upp läkemedelsbehandling i primärvården förbättras bland annat genom införande av primärvårdsdiagnoser i Patientregistret, vilket är under planering. • Precisionen i prognoserna som görs före introduktion gällande förväntad användning behöver förbättras. 10.4. Avslutande kommentar Ett antal rekommendationer och förslag har presenterats ovan. Aktiviteter pågår redan inom flera av dessa områden. Därför är det nu mest en fråga om att underlätta, påskynda och optimera sådant som redan satts igång. Insatser som klargör ansvarsfördelning och samverkan bör följaktligen prioriteras. Då kan varje aktör med sin specifika kompetens bidra till att utveckla de detaljer i processerna för införande och uppföljning av läkemedel som fortfarande saknas. Endast ett begränsat antal läkemedel kan initialt förväntas bli föremål för nationellt ordnat införande och uppföljning. Det är dock angeläget att uppföljning av redan tillgängliga läkemedel och behandlingsinsatser inte försummas. God överblick och möjligheter att jämföra olika behandlingar, gamla som nya, är en förutsättning för att kunna erbjuda medborgarna en värdebaserad, effektiv, säker och jämlik vård. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 68 (75) 11. Referenser 1. Eichler H-G et al., Nature reviews Drug Discovery, Volume 9, April 2010, p 277 – 291. 2. ”Effektivare läkemedelsanvändning”, handlingsplan från P16-gruppen, mars 2009. 3. PARENT, www.patientregistries.eu 4. Graner et al., Kartläggning av möjligheterna att genomföra läkemedelsepidemiologiska studier med befintliga data för att bemöta myndigheternas krav, CPE rapport, oktober 2011 version 1. 5. Loikas D, Läkemedel i kvalitetsregister; inventering av uppgifter om läkemedel och läkemedelsbiverkningar i Nationella kvalitetsregister och andra nationella register 2008, Rapport från SLL, 2008. 6. Power-point presentation ”Register för strukturerad uppföljning Votubia®”, Anna Ovanfors Health Economics and Pricing Manager, Novartis, Oktober 2012 7. Beslut om ansökan inom läkemedelsförmånerna för Votubia®, TLV, 27 april 2012 8. Personligt möte med Anna Ovanfors, Health Economics and Pricing Manager, Erik Lawenius, Medical Advisor, Mahsa Heidari, Produktchef, Novartis 9. Holmén et al., Multiple Sclerosis Journal, 12 January 2011, DOI:10.1177/1352458510394701 10. Olsson et al., Multiple Sclerosis Journal, 4 March 2013, DOI:10.1177/1352458513477925 11. http://www.socialstyrelsen.se/nyheter/2013april/utbrottavmasslingvisarviktenavvaccination 12. Vaccination av barn (SOSFS 2006:22) 13. Smittskyddslagen (SFS 2004:168) 14. Proposition Ny ordning för nationella vaccinationsprogram (2011/12:123) 15. Betänkande Ny ordning för nationella vaccinationsprogram (SOU 2010:39), sid. 20-22. 16. Malmström R, Godman B, Diogene E et al. Dabigatran – a case history demonstrating the need for comprehensive approaches to optimize the use of new drugs. Frontiers in Pharmacology, 14 Maj 2013, www.frontiersin.org. 17. Handbok, uppföljning nya läkemedel. Hälso- och sjukvårdsförvaltningen, Stockholms läns landsting, SLL, 2013. 18. Klinik och vetenskap, verktyg för klinisk forskning avsnitt: 2, 3, 4, 6 och 7 (ett urval av avsnitt 1-14), artikelserie i Läkartidningen 2013 nr 3 - 15. 19. Utvärdering av metoder i hälso- och sjukvården, en handbok. SBU 2012 20. Klinisk Utveckling via Register (KUR) – ett utvecklingsprogram för vård, klinisk forskning och Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 69 (75) näringslivssamverkan, december 2009. 21. Guldgruvan i hälso- och sjukvården. Översyn av de nationella kvalitetsregistren. Förslag till gemensam satsning 2011-2015. Rapport på uppdrag av Sveriges kommuner och landsting samt regeringen. Stockholm 2010. http://www.regeringen.se/content/1/c6/14/90/77/3637a603.pdf 22. Helgesson, C-F och Linus Johansson Krafve (2014 kommande) "Data transfer, values and the holding together of clinical registry networks" i “Value Practices in the Life Sciences” edited by Dussauge, Helgesson, Lee. Oxford: Oxford University Press. 23. EU-uppföljning om läkemedelseffekter i klinisk vardag, Läkemedelsverket 2011-12-23. 24. INSATSER INOM CANCERSTRATEGIN 2010–2012, Nationell samordning för strukturerat införande och uppföljning av nya cancerläkemedel, ÄNNU BÄTTRE CANCERVÅRD – DELRAPPORT 9. 25. Förstudie om uppföljning av användningen av rekvisitionsläkemedel på individnivå, Center för eHälsa i samverkan, oktober 2013 26. Förutsättningar för registerbaserad forskning, Dir. 2013:8, Kommittédirektiv från Utbildningsdepartementet, 29 januari 2013. 27. Nationell samordning av kliniska studier, Dir. 2013:64, Kommittédirektiv från Utbildningsdepartementet, 24 juni 2013. Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 70 (75) 12. Definitioner och förkortningar 12.1. Definitioner Bias skevheter Compassionate use icke godkänt läkemedel som ställs till förfogande för användning av humanitära skäl Confounding förväxlingsfaktorer Incidens nya fall av en sjukdom Prevalens andel individer i populationen med en given sjukdom Särläkemedel läkemedel som används för att behandla mycket ovanliga åkommor, och som därför har en liten försäljningsvolym 12.2. Förkortningar AK antikoagulantia ARTIS AntiReumatisk Terapi i Sverige Cambio COSMIC Ett IT-stöd för sjukvården CBL Centrum för bättre läkemedelsanvändning (verksamhetsområde inom LV) CeHIS Center för eHälsa i samverkan CPE Centrum för läkemedelsepidemiologi DDD definierad dygnsdos DMARD Disease Modifying Anti Rheumatic Drugs DVT djup ventrombos EMA European Medicines Agency EU Europeiska unionen EUnetHTA European network for Health Technology Assessment FF förmaksflimmer HCV-RNA Hepatit C-virus ribonukelinsyra HTA Health Technology Assessment INCA Informationsnätverk för cancervården InfCare Hepatit Webbaserat beslutsstöd och kvalitetsregister för den svenska hepatitvården INNOVIS Innovationer i Stockholms sjukvård INR International Normalized Ratio KI Karolinska Institutet Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 71 (75) LIF Läkemedelsindustriföreningen LOK Läkemedelskommittéernas ordförandekollegium LV Läkemedelsverket MMC Medical Management Centrum MS multipel skleros MSG Myndigheternas samverkansgrupp NEPI Nätverket för läkemedelsepidemiologi NLS Nationella läkemedelsstrategin NLT Nya läkemedelsterapier (grupp inom SKL) NOD Nationell ordinationsdatabas PAC Post authorisation commitement PARENT cross-border Patient REgistries iNiTiative (www.patientregistries.eu) PAES Post authorisation efficacy studies PASS Post authorisation safety studies P16 Regeringens arbetsgrupp för läkemedelsfrågor PNH Paroxysmal Nocturn Hemoglobinuri PPR Program och prioriteringsrådet PSI Public Sector Information RA reumatoid artrit RCC Regionalt cancercentrum SBU Statens beredning för medicinsk utvärdering SEGA Subependymalt jättecellsastrocytom SKL Sveriges Kommuner och Landsting SLEF Svensk Läkemedelsepidemiologisk Förening SLL Stockholms läns landsting SMI Smittskyddsinstitutet SRF Svensk Reumatologisk Förening SRQ Svensk Reumatologis Kvalitetsregister SSTH Svenska Sällskapet för Trombos och Hemostas Svevac Informationssystem för vaccinationer TakeCare Journalsystem TNF tumörnekrosfaktor TIA Transitorisk Ischemisk Attack Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 72 (75) TLV Tandvårds- och läkemedelsförmånsverket TSC tuberös skleros U-CAN Uppsala-Umeå Comprehensive cancer consortium VGR Västra Götalandsregionen Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 73 (75) 13. Projektets styr-, metod- och projektgrupp 13.1. Projektets styrgrupp Eva Andersén-Karlsson/ Carl-Gustaf Elinder Stockholms läns landsting (SLL) Karolina Antonov Läkemedelsindustriföreningen (LIF) Bo Claesson Sveriges Kommuner och Landsting (SKL) Thomas Davidson Statens beredning för medicinsk utvärdering (SBU) Anders Hallberg Nya Läkemedelsterapier (NLT) Synnöve Lindemalm Svenska Läkareförbundet Love Linnér Tandvårds- och läkemedelsförmånsverket (TLV) Stefan Quittenbaum/ Ellen Vinge Nätverket för Sveriges Läkemedelskommittéer (LOK) (ordf.) Marie Steen Handikappförbundens samarbetsorgan (HSO) Annika Svedberg Sveriges Apoteksförening Thomas Tegenfeldt/ Karin Tegmark-Wisell/ Gunilla Skoog Smittskyddsinstitutet (SMI) (del av projekttiden) Valt att avstå Socialstyrelsen 13.2. Projektets metodgrupp Nils Feltelius Läkemedelsverket Mikael Hoffmann Nätverket för läkemedelsepidemiologi (NEPI) Jan Liliemark Statens beredning för medicinsk utvärdering (SBU)/SKL Maarten Sengers Socialstyrelsen Björn Wettermark Stockholms läns landsting (SLL) Björn Zethelius Läkemedelsverket 13.3. Läkemedelsverkets projektgrupp Nils Feltelius (projektledare) Erica Hagblom (bitr. projektledare t o m 2013-09-30)/ Maria Szirmai (bitr. projektledare fr o m 2013-10-01) Lennart Holm Emma Mild Björn Zethelius Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 74 (75) 14. Bilagor I. Fördjupad beskrivning av pilotprojekt, Läkemedelsverket, 15 november 2013 II. Kartläggning av pågående initiativ och erfarenheter kring ordnat införande av nya läkemedel i Europa, Karolinska Institutet, november 2012 III. Följsamhet till riktlinjer och rekommendationer kring läkemedel, NEPI, oktober 2013 IV. Integrerat i infrastrukturen: Utvärdering av nationell modell för framtagande av införandeprotokoll och samordnad utvärdering av läkemedel i klinisk praxis, Medical Management Centrum, oktober 2013 Ordnat införande och strukturerad uppföljning av nya läkemedel – Läkemedelsverket november 2013 75 (75)