Aldosteron - en viktig neuroendokrin faktor Aldosteron är en
advertisement

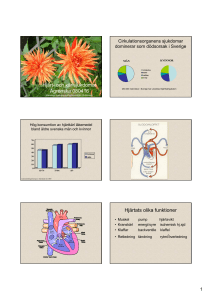
Aldosteron - en viktig neuroendokrin faktor Aldosteron är en komponent i renin-angiotensin-aldosteron-systemet (RAAS), som under senare år har kommit att tilldra sig ett allt större intresse. Bakgrunden härtill kan sägas vara dels ny kunskap om att aldosteron spelar en betydelsefull patofysiologisk roll vid en rad olika kardiovaskulära sjukdomstillstånd och dels att blockad av aldosteroneffekter i såväl experimentella som kliniska studier visats ha organskyddande inverkan på hjärta, kärl och njurar.[1-4] Aldosteron är en viktig neuroendokrin faktor och aldosteronreceptorblockad har visats öka överlevnaden samt minska sjukligheten bland svårt sjuka patienter med kronisk hjärtsvikt och bland patienter med hjärtsvikt och vänsterkammardysfunktion efter hjärtinfarkt, utöver vad som gått att erhålla med konventionell behandling[5,6] Den klassiska synen på aldosteron är att hormonet bildas i binjurebarkens zona glomerulosa vid aktivering av RAAS, under inverkan av främst angiotensin II (AII) och kalium. Sekretionen av aldosteron påverkas även akut av adrenokortikotropt hormon (ACTH). Aldosteron utövar sina effekter genom att binda sig till intracellulära mineralkortikoidreceptorer i epitelceller i distala nefron, kolon, spott- och svettkörtlar. Bindning av aldosteron till dessa receptorer utlöser en kaskad av händelser och leder till framförallt renal reabsorption av natrium och vatten i utbyte mot kalium men även magnesium, med volymexpansion och hypervolemi som följd.[7] Under flera decennier har aldosteron setts enbart som ett tryck- och volymreglerande hormon. Genom den ökade reabsorptionen av natrium och vatten, ökar intra- och extracellulär vätskevolym som i sin tur ökar hjärtminutvolym och blodtryck vilket indirekt bidrar till utvecklingen av hjärtkärlsjukdom. Vid överskott på aldosteron uppkommer hypokalemi. Det är känt att effekten av aldosteron på natrium- och vattenretention avtar med tiden och orsaken till detta s k ”escape”-fenomen tillskrivs företrädesvis ökat tryck i njurens kärlsystem. Aldosteron har emellertid visats vara involverat också i en rad andra mekanismer som verkar blodtryckshöjande. Vid aktivering av RAAS utgör enkelt uttryckt i levern bildat angiotensinogen substrat och omvandlas av renin till angiotensin I (AI). AI omvandlas i sin tur under inverkan av angiotensin converting enzyme (ACE) till angiotensin II (AII). AII är en nyckelsubstans vid neuroendokrin aktivering och har en lång rad ogynnsamma effekter på vävnader i hjärta, kärl och andra organ, bland annat genom att stimulera produktionen av aldosteron. Alltfler såväl experimentella som kliniska data visar att aldosteron och AII både tillsammans och oberoende var för sig utövar liknande skadliga effekter på det kardiovaskulära systemet.[1-4] Senare års forskning har lärt att aldosteron förutom i binjurebarken kan bildas även lokalt i andra organ. Exempel är kärlväggen, dess endotel och glatta muskelceller, [8-10] myokardium,[11] och hjärnan.[12] Det är möjligt att hormonet utövar både autokrin och parakrin påverkan lokalt i olika vävnader. Vidare har det visats att en lång rad både hormonella och icke-hormonella faktorer ut-över AII, kalium och ACTH, kan stimulera bildning och frisättning av aldosteron. Detta gäller katekolaminer, kväveoxid (NO), acetylkolin, endoteliner, prolaktin, vasopressin, prostaglandiner, m fl. Experimentellt har aldosteron visats ha blodtryckshöjande effekt genom sin förmåga att uppreglera angiotensinreceptorer (AT1), genom att minska känsligheten hos baroreceptorerna och genom att öka aktiviteten i det sympatiska nervsystemet samt genom att minska NO-produktionen i kärlendotelet. Kliniska undersökningar visar att behandling med aldosteronblockerande läkemedel effektivt sänker blodtrycket.[13-15] Aldosteron har även visats inducera skador på hjärta och kärl som vaskulär inflammation, ökad kollagenproduktion, hypertrofi och fibros, oberoende av den blodtryckshöjande effekten.[1-4] Mekanismerna bakom dessa patofysiologiska processer är inte klarlagda och en intensiv forskning pågår. De negativa effekterna av aldosteron har dock i en rad studier visats kunna motverkas av aldosteronblockad.[3,16-18] Särskilt intressant är att de experimentella fynden tycks gälla även i den kliniska situationen. Således är aldosteron ett riskhormon även hos människa och detta oberoende av effekter av AII. Ett samband föreligger t ex mellan aldosteron och renal samt kardiovaskulär morbiditet och mortalitet.[19,20]Jämfört med hypertoniker har patienter med primär hyperaldosteronism visats ha en försämrad endotelfunktion, som i sig är en prediktor för framtida kardiovaskulära komplikationer.[1] Förhöjda plasmanivåer av aldosteron har vidare kunnat relateras till försämrad arteriell elasticitet bland patienter med hypertoni. Omvänt har behandling med aldosteronreceptorblockad visats förbättra endotelberoende vasodilatation hos patienter med hjärtsvikt.[1] De kliniska erfarenheter som hittills erhållits med aldosteronreceptorblockad är övertygande och visar att kardiovaskulära sjukdomstillstånd där aldosteron spelar en patofysiologisk roll, som t ex vid hypertoni, vänsterkammarhypertrofi, nefroskleros och proteinuri, påverkas positivt av att aldosteron motverkas. Sammantaget finns en övertygande dokumentation, som visar att aldosteronreceptorblockad i monoterapi eller i kombination med andra moderna antihypertensiva medel effektivt sänker blodtrycket under långtidsbehandling,[13-15] ger regress av vänsterkammarhypertrofi[21] och minskar renalt albuminläckage.[22,23] Hjärtsvikt är ett komplext kliniskt syndrom som kan liknas vid en ond cirkel och karaktäriseras av hjärtats försämrade förmåga att pumpa blod. Bakgrunden kan vara en myokardskada som följd av akut hjärtinfarkt, inflammation, överdriven belastning orsakad av hypertoni eller klaffsjukdom, genetiska rubbningar eller idiopatisk myokarddysfunktion. Komponenter i den onda cirkeln är bl a kompensationsmekanismer i form av dilatation och utveckling av hypertrofi samt aktivering av neurohormonella system som det adrenerga nervsystemet och RAAS, i vilket aldosteron är en viktig komponent.[24] Systemen interagerar med varandra så att aktivering av ett system resulterar i ökad aktivitet även i andra system. På kort sikt kan dessa mekanismer förefalla gynnsamma för förmågan att upprätthålla tryck och volym. I det längre perspektivet är effekten dock den motsatta. Kronisk neuroendokrin aktivering leder till progressiv försämring, där både hjärtats myocyter och interstitium genomgår såväl strukturella som funktionella förändringar, s k ”remodelling”. Inlagring av kollagen ökar, vidare uppkommer proliferation av fibroblaster och nekros av myocyter, med försämrad hjärtfunktion som följd. Aldosteron har en rad ogynnsamma effekter vid hjärtsvikt och spelar en viktig patofysiologisk roll vid detta tillstånd.[24-26] Förutom att öka återresorptionen av natrium och vätska, stimulerar aldosteron sjukdomsprogressen genom att bidra till utvecklingen av hypertrofi, fibros och nekros samt genom att påskynda remodellingprocessen och verka proarytmiskt. Den senare effekten medieras sannolikt via ökad utsöndring av kalium och magnesium samt minskat återupptag av noradrenalin från synapser. I likhet med utvecklingen av fibros predisponerar detta för arytmier och plötslig hjärtdöd. ACE-hämmare är en del av standardbehandlingen vid hjärtsvikt.[24]Genom hämning av ACE-aktiviteten motverkas omvandlingen av AI till AII, men också bildandet av aldosteron. Läkemedel som hämmar effekter av AII som ACE-hämmare och AII-antagonister förmår att hålla tillbaka aldosteronnivåerna i det korta perspektivet. Under långtidsbehandling med dessa medel återgår aldosteron med tiden till de nivåer som förelåg innan behandlingen startade.[27] Förklaringen till denna aldosteron ”escape” är inte känd, men kan vara dels att AII bildas även via mekanismer som inte är beroende av ACE och dels att aldosteron bildas via mekanismer som inte är beroende av AII. I två uppmärksammade stora randomiserade dubbelblinda studier har behandling med aldosteronblockad visats ge goda kliniska effekter på patienter med hjärtsvikt. I den ena studien5 behandlades 1.663 svårt sjuka patienter med hjärtsvikt (NYHA III-IV) och dålig systolisk funktion (ejektionsfraktion <35 %) trots behandling med ACE-hämmare och loopdiuretika, med en låg dos av aldosteronreceptorblockeraren spironolakton (genomsnittsdos 26 mg/dag). På grund av det positiva resultatet avbröts studien i förtid efter 2 år. Total mortalitet var då 30 % lägre bland de patienter som behandlats aktivt (p<0.001) och behovet av sjukhusvård på grund av progredierande hjärtsvikt var 35 % lägre (p<0.001). En intressant observation var att även antalet fall av plötslig död minskade (29 %, (p=0.02). I den andra studien[6] behandlades 6.632 patienter som drabbats av akut hjärtinfarkt och hade hjärtsvikt med försämrad systolisk funktion (ejektionsfraktion <40 %), trots optimal medicinsk behandling med ACE-hämmare eller AII-antagonister, betablockerare och diuretika, med den selektiva aldosteronblockeraren Inspra, eplerenon (genomsnittsdos 43 mg/dag) eller placebo. Behandlingen startade inom två veckor efter det akuta infarktinsjuknandet. Behandlingstiden var i genomsnitt 16 månader. I denna studie minskade total mortalitet 15 % (p=0.008) bland de patienter som behandlats aktivt och behovet av sjukhusvård på grund av förvärrad hjärtsvikt var 23 % lägre (p=0.02). Även i denna undersökning minskade antalet plötsliga dödsfall bland de patienter som behandlades med aldosteronblockad (21 %, p=0.03). Sammanfattningsvis är aldosteron ett viktigt neuroendokrint riskhormon som är involverat i patofysiologin vid en rad kardiovaskulära sjukdomstillstånd. Att så är fallet bekräftas av nyvunnen kunskap från såväl experimentell som klinisk forskning kring de organskadande effekterna av aldosteron och kring värdet av att motverka dessa effekter genom aldosteronreceptorblockad. Blockad av aldosteroneffekter har visats reducera förhöjt blodtryck och att organskyddande effekt på hjärta, kärl och njurar. Aldosteronblockad har dessutom visats öka överlevnaden och minska sjukligheten bland svårt sjuka patienter med hjärtsvikt (RALES) och bland patienter med hjärtsvikt efter hjärtinfarkt, utöver vad som gått att erhålla med konventionell behandling (EPHESUS). Redan erhållna kliniska erfarenheter med aldosteronreceptorblockad talar för att denna farmakologiska princip inom en nära framtid kommer att spela en framträdande roll inom modern kardiovaskulär farmakoterapi.