DENTIFIKATIONEN AV ”CHARGE GENEN” och vad vi lärde oss
advertisement

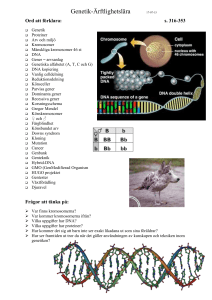
DENTIFIKATIONEN AV ”CHARGE GENEN” och vad vi lärde oss därefter. Hur började det? Trots att CHARGE syndrom oftast förekommer sporadiskt (dvs endast en person i en familj är drabbad) var forskare redan övertygade om att det orsakas av en genetisk faktor. Varför? För det första är överensstämmelsen mellan enäggstvillingar (som har exakt samma genetiska information) mycket hög. För det andra finns det flera personer med CHARGE inom samma familj. För det tredje tycks fäder till barn med CHARGE ha en högre medelålder. Det är känt att förändringar i DNA i en spermie ökar med åldern. Eftersom föräldrar oftast är friska och upprepningar inom familjen är mycket sällsynt, så är den bästa förklaringen att CHARGE orsakas av en ny genetisk avvikelse hos barnet. Den avvikelsen kan vara en microdeletion eller en skada på en enskild gen. En microdeletion betyder att det saknas en mycket liten bit av en kromosom. Detta syns inte vid en rutinkromosomstudie när man använder ett mikroskop som förstorar 1000 ggr. Men en sådan pytteliten del av en kromosom kan innehålla tiotals till hundratals gener. I CHARGE syndrom är många olika organ involverade ( ögon, öron, hjärta, mage, tarmar m.m.) och därför är en microdeletion med avsaknad av många gener mycket trolig. Åtminstone är det vad vi alltid trott. Om å andra sidan CHARGE orsakas av en enskild skadad gen måste den genen spela en nyckelroll i den tidiga fosterutvecklingen. Array CGH, en ny metod att söka microdeletioner. De senaste åren har vårt genetiska forskningslaboratorium arbetat hårt för att utveckla och förbättra en metod för att upptäcka nya microdeletioner (avsaknad av små bitar av en gen). Metoden kallas array CGH. Array är en tunn glasskiva med många små punkter av DNA ordnade i rader. CGH är en förkortning av Comparative Genomic Hybridization ( jämförande genomic hybridisering). Jämförande för att i den här metoden jämförs DNA från en vanlig person med en person med ett syndrom eller en sjukdom. Genomic innebär att all DNA som finns i en persons celler används. Hybridization innebär att DNA har en tendens att hålla fast vid sin motpart. Så om man har en liten bit, som innehåller DNA från en bestämd plats på kromosom 1, kommer DNA från exakt samma plats på kromosom 1 från en kontrollperson och den från ”patienten” att hålla sig till denna bestämda punkt på glasskivan. Vi gjorde först en glasskiva med 3600 små punkter/bitar av DNA från hela kromosomuppsättningen. Vi renade DNA från friska personer och märkte dessa med en självlysande färg (grön). Vi renade också en lika stor mängd DNA från ett barn med CHARGE och märkte det med röd färg. Om barnet med CHARGE saknar en liten bit av en kromosom så blir det mer grönt än rödmärkt DNA i den delen av kromosomen och den motsvarande punkten på glasskivan färgas grön. Alla andra punkter med lika stor mängd ”normal DNA” och ”CHARGE DNA” färgas gula (en lika stor mängd av självlysande röd och grön blir gulfärgad). Men om barnet med CHARGE har en dubblering av en liten del i kromosomen kommer den motsvarande punkten på glasskivan att färgas röd, eftersom det finns mer ”CHARGE DNA” jämfört med ”normalt DNA”. Den första microdeletionen funnen. Med vår nya teknik identifierade vi ett bortfall på kromosom 8 hos en flicka med CHARGE syndrom. Hos många andra testade patienter kunde vi inte hitta detta bortfall. Vi gav inte upp utan letade i litteraturen efter barn med CHARGE med kromosom 8 avvikelser och fann en rapport av Jane Hurst från 1991. I denna rapport hade ett engelskt barn med CHARGE syndrome och en tydlig translocation( = två små delar har bytt plats i två olika kromosomer) mellan kromosomerna 6 och 8. Man hade då endast undersökt det i mikroskop och då inte sett om någon liten del av en kromosom saknades. Vi bad Jane Hurst skicka denna patients DNA till oss och fann då nästan samma bortfall av en del av kromosomen som hos vår holländska patient. Detta bekräftade att det måste finnas en mycket betydelsefull roll i den ha delen a kromosom 8 i CHARGE syndrom. Men vad har hänt hos alla de patienter med CHARGE syndrom som inte har ett bortfall i kromosom 8? Sökandet efter gener på kromosom 8. Genom att jämföra bortfallen hos de två patienterna kunde vi definiera en kedja av DNA på 2.300.000 baspar ( ett baspar är den minsta byggstenen i DNA), som vi vid det tillfället visste skulle innehålla tio gener. Hos 17 personer med CHARGE utan microbortfallet hos kromosom 8 kunde vi sekvensera dessa tio gener. Sekvensera betyder att hela genuppsättningen är beskriven och jämförd med samma gen hos en kontrollperson. I en av generna, kallad CHD7 genen, fanns avvikelser hos de flesta av de 17 personerna. Hur vet vi att denna gen verkligen är orsak till CHARGE syndrom? Vårt DNA innehåller cirka 35.000 gener. Vid sidan av dessa nyttiga gener finns det mycket ”skräp DNA” som inte har någon funktion. Bland dessa ”skräp DNA” finns ”pseudogener”, dvs kedjor av DNA som liknar gener men som inte används av vår kropp. Genen som vi funnit kunde vara en pseudogen, och då skulle avvikelserna vara ofarliga. Det är orsaken till att vi också testade alla föräldrarna. Alla förändringarna som vi fann hittades inte hos föräldrarna. Vi kallar dem avvikelser de novo (nya). De måste ha uppstått vid sammansmältningen av ägg och spermie. Det faktum att alla avvikelser var de novo, och att genen har en förmodad funktion under den tidiga fosterutvecklingen, visar att den här genen verkligen är involverad i CHARGE syndrom. Vi presenterar med stolthet: CHD7 Varför kallas den här genen CHD7? Vi måste medge att det är ett underligt namn. Men vi har inte tillåtelse att namnge en ny gen. Vi var tvungna att fråga en internationell kommitté vad den här genen skulle heta. CHD7 betyder att det är den 7:e genen inom familjen ”chromodomain” som har upptäckts. Alltså finns det redan 6 andra mänskliga gener som liknar CHARGE genen. Vad är CHD7 genens funktion? Nu måste vi gissa lite eftersom det fortfarande återstår mycket att undersöka. Vi vet att ”chromodomain” gener är kodade för protein som har stor betydelse för att styra andra geners olika uppgifter. Våra kromosomer innehåller cirka 35.000 gener. Alla våra celler behöver inte alla dessa gener. Till exempel är vissa celler nödvändiga i hudceller (den gen som bestämmer hudfärgen), andra behövs för att anlägga sköldkörteln (den gen som bildar hormonet thyroid), osv. osv. Det finns också gener som bara behövs under den tidigaste fosterutvecklingen, sådana gener som har hand om en riktig anläggning av mycket speciella organ som hjärtat, ögat och båggångarna. Hur vet cellen vilken gen som ska vara aktiv? Vårt DNA innehåller ”regulator gener” som CDH7, som talar om det för den. Hur sker denna reglering av generna? Varje liten cell innehåller 46 kromosomer. Varje kromosom består av en mycket lång kedja av DNA. Om man drar ut en sådan kedja men allt DNA i en cell, får vi en tråd som är 2 meter lång. Hur kan den få plats i cellen? All DNA som inte behövs (som inte omvandlas till protein) är hopvikt på ett mycket speciellt sätt för att ta så liten plats som möjligt inom cellen. Det DNA som ska omvandlas är mindre hopvikt och därför tillgänglig för det ”maskineri” som läser och omvandlar DNA:t. Det är vad CHD7 gör – det gör vissa gener tillgängliga för omvandling till protein. Man kan jämföra det med att tillaga en måltid. Om du vill laga en maträtt behöver du inte alla recept i din kokbok (dina kromosomer). Så du behöver inte öppna alla sidor (dina gener) på samma gång. Men du behöver finna den rätta sidan för att laga den maträtt du planerade att göra. CHD7 är innehållsförteckningen som hjälper till att hitta denna sida. Om man inte hittar rätt sida kommer vissa maträtter fortfarande smaka ganska bra medan andra smakar mycket illa. Det beror på vad du (cellen) kan göra av det hela och således kan effekten av att ha missat en bra innehållsförteckning (CHD7) variera från person till person. Finns det redan ett test av blodet som ger svar? Ja, det finns det. Direkt efter att vi upptäckte CHD7 genen överlämnade vi beskrivningen av den här genen till vårt DNA diagnostiska laboratorium samt berättade om det för alla holländska kliniska genetiker. Så i Holland erbjuder man samma möjligheter som för andra genetiska sjukdomar där genen är känd. Vi antar att samma service ska finnas i de flesta länder snart. För länder som inte har dessa möjligheter kan laboratoriet i Nijmegen, Holland, erbjuda sådana test. Om ni och er läkare önskar detta så var snäll och be läkaren kontakta Conny van Ravenswaaij med e-mail: [email protected] Kostnaden är 650 Euro – vilket kan kännas mycket, men CHD7 är en stor gen och man måste kartlägga hela genen. Vad händer om man hittar en mutation hos ert barn? Om det har visat sig att ert barn har en CHD7 mutation som är de novo (inte finns hos båda föräldrarna) kan vi dra slutsatsen att: 1. Ert barn har med säkerhet CHARGE syndrom. Det låter kanske underligt men diagnoser är svåra att ställa. 2. Era ”friska” barn har ingen förhöjd risk att få ett barn med CHARGE. 3. Möjligheten att få ett andra barn med CHARGE är låg, 1-2%. Det beror på att CHD7 mutationen uppstod tidigare i en äggcell eller spermie. Det är möjligt att göra foster diagnostik med 100% säkerhet – men det är ju ett svårt val för föräldrarna. 4. Ditt barn med CHARGE syndrom löper en 50%-ig risk att föra vidare CHD7 genen och få ett barn med CHARGE. Även här är fosterdiagnostik möjlig. Det kan vara viktigt att här tala om att de flesta personer med CHARGE syndrom inte kan få barn och att det är bra att undersöka den möjligheten redan i puberteten för att undvika omöjliga förväntningar. Kan CHARGE syndrom botas? Nej. Vi inser att detta är en stor besvikelse för er alla. Genen har sin huvudsakliga inverkan under de första 12 veckorna i graviditeten. De organ som inte har utvecklats på ett riktigt sätt beroende på ett fel i CHD7 proteinet kan inte repareras efteråt genom genterapi. Framtida studier Forskargruppen i Nijmegen – och vi tror att andra forskargrupper vill samarbeta med oss i detta - planerar följande: 1. Hur brett är det kliniska spektrat hos CHD7? Det är redan känt att det finns en stor klinisk variation mellan barnen med CHARGE syndrom. Nu när genen som orsakar CHARGE är känd är det möjligt att studera dem, som har en mildare form. Enligt de diagnosiska kriterierna, som kan hjälpa en läkare att ställa diagnosen hos ett barn med CHARGE syndrom, ska barnet ha antingen colobom eller choanal atresi. Men vi har redan identifierat CHD7 mutationer hos flera barn som inte har dessa två särdrag. 2. Finns det ett phenotyp – genotyp förhållande? (phenotyp = gentyp + miljöpåverkan) Detta innebär att vi måste studera förhållandet mellan svårighetsgraden i mutationen i CHD7 genen och hur utvecklingen sker för barnet. Så här långt har vi redan lärt oss att syskon med en identiskt lika mutation kan uppvisa helt olika kliniska särdrag, vilket skulle innebära att en sådan relation inte existerar. Å andra sidan har vi sett personer med liten grad av ”utmärkande drag” har relativt små avvikelser i CHD7. 3. Hur påverkas puberteten hos barn som har en CHD7 mutation? Många andra frågor kommer att komma upp på vägen. Man har nu utvecklat en mus med CHARGE i England för att kunna studera CHD7 genens roll i kroppen och effekten av mutationer i denna gen. Det innebär att i framtiden kommer vi att veta mycket mer om CHARGE syndrom än vi vet idag. Till slut Ni är välkomna att kontakta oss om ni eller er läkare har några frågor. Det kommer att bli en fortsättning…. Varma hälsningar till er alla Dr Marjolijn Jongmans, klinisk genetiker under utbildning Och Dr Conny Ravenswaaij Klinisk Genetiker/ Cytogenetiker Department of Human Genetics 849 Radboud University Nijmegen Medical Centre P.O.Box 9101 6500 HB Nijmegen The Netherlands Tel: 31 24 3542151 FAX 31 24 3542151 Efter September 2006: Dept. of Medical Genetics University Medical Centre Groningen P.O.Box 30001 9700 RB Groningen Tel: 31 50 3637417 FAX: 31 50 2632950 (till svenska av Ulla Holmqvist Äng den 20 juni 2006)