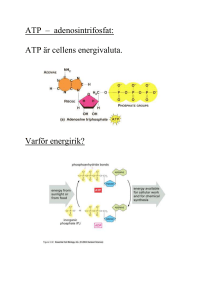
SVAR: 1.a) -1 b) A: Nej, då Val och Thr är grenade på beta
advertisement

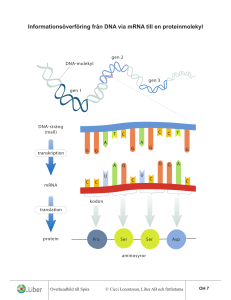
SVAR: 1.a) -1 b) A: Nej, då Val och Thr är grenade på beta-kolet, steriska problem ”får inte plats”. B: Nej, då flera plusladdade aa intill varandra, repulsion C: Ja, inga grenade intill varandra, inga med samma laddning, saknar Pro D: Nej, innehåller en Pro mitt i sekvensen, ej förenlig med helix struktur samt saknar amid-H. c) Alla icke-kovalenta bindningar bryts. Den nativa 3D-strukturen förstörs-inaktivt protein. Eventuella S-S påverkas inte. (sekundärstrukturen förstörs också) 2.a) Gelfiltreringskromatografi, separation efter storlek, störst först. Kromatogram med förslagvis A280nm på y-axeln och volym på x-axeln. Protein D kommer att eluera först. b) En reaktiv Serin i aktiva ytan. c) Kymotrypsin katalyserar klvyning av peptidbindningar C-term om stora opolära sidokedjor. Så i peptid i) kommer klvyning att ske på två ställen C-terminalt om Trp och C-terminalt om Phe. Ser-Ala-Trp, GlyLys-Phe, Thr. Peptid ii) kan inte fungera som substrat då den saknar stora opolära sidokedjor. d) Mutant 1: Ser60 mot Thr. Ser60 ytligt placerad byts mot snarlik Thr. Troligen mycket liten påverkan då båda kan vätebinda till vatten. Mutant 2: De 3 aa i aktiva ytan är: Asp, His och Ser. His fungerar som protonrelä (omväxlande bas/syra). Initialt tar His en proton från Ser som då blir en bra nukleofil. Asp håller His på plats och underlättar His roll som protonacceptor. Ser kan nu göra en nuklefil attack på karbonylkolet i substratet. Om His byts mot opolär Leu kan inte någon nukleofil skapas alls och mutanten blir troligtvis helt inaktiv. 3a) Approximationen innebär att [ES] är i det närmaste konstant under en viss tid då det fortfarande finns ett överskott på S över E då gäller: d ES dt 0 k1 E S k 2 ES k 1 ES b) kcat beskriver enzymets effektivitet och anger hur mycket substrat som omvandlas till produkt per enzymenhet och per tidsenhet c) 1 ((l*min)/mmol) v 0.45 0.4 Linjens ekvation y = 0.4062x + 0.1976 Skärning med y-axel = 0.1976 = 1/vmax Linjens lutning = 0.4062 = KM/vmax y = 0.4062x + 0.1976 0.35 0.3 0.25 Series1 0.2 Linear (Series1) 0.15 0.1 0.05 0 0 0.1 0.2 0.3 0.4 0.5 0.6 1 S (mM-1) Beräkna vmax: vmax = 1/0.1976 = 5.06 mmol/(l*min) Beräkna KM: KM = vmax * 0.4062 = 5.06 * 0.4062 = 2.05 mM e) Röd linje visar hur grafen förändras i närvaro av en nonkompetitiv inhibitor. 1 ((l*min)/mmol) v 0.45 KM påverkas inte vmax minskar med faktorn 1+[I]/KI (där KI = [E][I]/[EI]) 0.4 y = 0.4062x + 0.1976 0.35 0.3 0.25 Series1 0.2 Linear (Series1) 0.15 0.1 0.05 0 0 Linjen lutning (= KM/vmax) ökar i närvaro av inhibitorn Skärningen med y-axeln (= 1/vmax) ökar i närvaro av inhibitorn Skärningen med x-axeln (=-1/KM) förändras inte 0.1 0.2 0.3 0.4 0.5 0.6 1 S (mM-1) 4. a) o b) Oxaloacetat + GTP → Fosfoenolpyruvat + GDP + CO2 Sker i glukoneogenesen och katalyseras av Fosfoenolpyruvatkarboxykinas Fosfoenolpyruvat + ADP + H+ → Pyruvat + ATP Sker i glykolysen och katalyseras av Pyruvatkinas Fruktos 1,6-bisfosfat + H2O → Fruktos 6-fosfat + Pi Sker i glukoneogenesen och katalyseras av Fruktos-1,6-bisfosfatas Puruvat + CO2 + ATP + H2O→ Oxaloacetat + ADP + Pi + 2H+ Sker i glukoneogenesen och katalyseras av Pyruvatkarboxylas Fruktos 6-fosfat + ATP → Fruktos 1,6-bisfosfat + ADP + H+ Sker i glykolysen och katalyseras av Fosfofruktokinas c) i) AMP och Fruktos 1,6-bisfosfat aktiverar enzymer i glykolysen. Hög halt AMP visar att energinivån är låg och därför behövs glykolysen. Hög halt Fruktos 1,6-bisfosfat innebär att glykolysen är i gång (Fruktos 1,6bisfosfat bildas från reaktionen: Fruktos 6-fosfat + ATP → Fruktos 1,6-bisfosfat + ADP + H+ vilken katalyseras av Fosfofruktokinas) och att enzymer längre fram i glykolysen behöver aktiveras för att glykolysen skall fungera effektivt (Fruktos 1,6-bisfosfat aktiverar pyruvatkinas). ii) ATP och Citrat inhiberar enzymer i glykolysen (ATP inhiberar fosfofruktokinas och pyruvatkinas och Citrat inhiberar fosfofruktokinas). Hög halt ATP visar att energinivån är hög och att glykolysen inte behövs. Citrat är en metabolit i citronsyracykeln. Hög halt citrat visar att det finns gott om metaboliter och att glykolysen kan stanna av. d) I matrix av mitokondrien (1p) e) Att generera energi (ATP) via reduktion av NAD+ och FAD till NADH och FADH2 som återoxideras i andningskedjan vilket resulterar i produktion av ATP. Att förse cellen med byggstenar som kan användas för att bilda andra molekyler som aminosyror, fettsyror och nukleotider mm (1p) 5. a) Fosfatgrupperna pekar utåt och kvävebaserna pekar inåt. b) En fosfatgrupp kopplar två sockerenheter via ett syre på 3’-kolet och ett syre på 5’-kolet där 3’betyder kolatom nummer 3 i sockerenheten och 5’ betyder kolatom nummer 5 i sockerenheten. c) Om ett fel uppstår vid replikationen och inte åtgärdas kommer felet att finnas kvar hos kommande generationer av celler vilket kan resultera i permanenta fel vid syntes av proteiner. Ett fel vid transkriptionen leder till ett felaktigt mRNA (och fel vid proteinsyntesen) men eftersom mRNA till slut bryts ned (då proteinet inte längre skall syntetiseras) så blir felet inte permanent. DNA-polymeras I har s.k. exonukleasfunktion och det innebär att den kan hydrolysera bort en felaktigt inkorporerad nukleotid. d) Om RNA innehåller två efterföljande sekvenser med många G och C så kan dessa baspara med varandra och bilda en stabil hårnålsloop (G och C basparar med tre vätebindningar). Om det sedan kommer en sekvens på RNA som innehåller många U så sker en destabilisering i interaktionen mellan RNA och DNA (U och A basparar med två vätebindningar) vilket leder till att RNA:t lossar från DNA och RNA-polymeraset släpper. Ett annat sätt att avsluta transkriptionen sker genom proteinet rho som känner igen en sekvens i det nysyntetiserade transkriptet och binder till RNA:t vilket leder till att RNA-polymeraset lossnar. Processen kräver energi (hydrolys av ATP → ADP + Pi). e) De primära mRNA transkripten i eukaryoter består av exoner och introner. Exonerna innehåller den genetiska informationen som kodar för protein. Intronerna används inte som mall för proteinsyntes utan dessa klipps bort från mRNA – processen kallas för splicing. Ofta kodar exonerna för olika funktionella domäner eller subenheter i ett protein. Genom alternativ splicing kan olika varianter av mRNA bildas från en och samma kodande region på DNA – detta gör att vi kan producera betydligt fler varianter av mRNA än det antal gener vi har. Ex. en gen som innehåller fyra exoner (nummer 1, 2, 3 och 4). Mellan exonerna finns introner. När intronerna skall klippas bort från mRNA:t kan detta ske på olika (alternativa sätt) vilket innebär att en eller flera exoner också tas bort. På så vis kan olika varianter av mRNA bildas (ex. mRNA med exon 1, 2 och 4 eller mRNA med exon 1,3 och 4 osv). f) Vid start av translationen sitter en tRNA-molekyl med den växande polypeptidkedjan (eller fmet vid första translationsrundan) i P-sitet. En ny tRNA-molekyl med kopplad aminosyra binder in i A-sitet där det sker en matchning mellan kodonet på mRNA i A-sitet och antikodonet på den inkomna tRNA-molekylen. Den växande polypeptidkedjan (eller fmet) på tRNA:t som sitter i P-sitet överförs till aminosyran i A-sitet och en ny peptidbindning bildas. Därefter sker en translokering vilket innebär att den fria tRNA-molekylen i P-sitet flyttar till Esitet, tRNA som binder den växande polypeptidkedjan flyttar från A-sitet till P-sitet och mRNA matas fram motsvarande en bastriplett så ett nytt kodon exponeras i A-sitet. Den fria tRNA-molekylen lämnar E-sitet och en ny translationsrunda kan ske.