Neurobloc, INN-botulinum toxin type B
advertisement

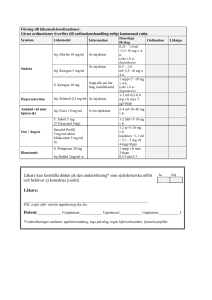
BILAGA I PRODUKTRESUMÉ 1 1. LÄKEMEDLETS NAMN NeuroBloc 5000 E/ml lösning för injektion. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 5000 E/ml Botulinum Toxin Typ B. Beträffande hjälpämnen, se avsnitt 6.1. 3. LÄKEMEDELSFORM Lösning för injektion. 4. KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer NeuroBloc är avsett för behandling av cervikal dystoni (torticollis). Se 5.1 för data om effektivitet hos patienter som svarar / ej svarar på Botulinum Toxin Typ A. 4.2 Dosering och administreringssätt Dosenheterna är specifika för NeuroBloc och kan ej bytas ut mot dem som används för att beräkna dosen för andra produkter med botulinumtoxin. NeuroBloc skall endast ges som intramuskulär injektion av en specialistläkare med god erfarenhet av att behandla cervikal dystoni och av att använda botulinumtoxiner. Dos och administeringsfrekvens anpassas efter varje patient beroende på det kliniska svaret. Initialdosen är 10 000 enheter och uppdelas på de två till fyra mest påverkade musklerna. Data från kliniska studier tyder på att effekten är dosberoende, men eftersom dessa försök inte var gjorda för en jämförelse visar de inte någon signifikant skillnad mellan 5000 E och 10 000 E. Därför kan man även tänka sig en initial dos på 5000 E men en dos på 10 000 E skulle kunna öka sannolikheten för klinisk framgång. Man måste försäkra sig om NeuroBloc inte injiceras i ett blodkärl. NeuroBloc kan spädas med 0,9 vikt/volymprocent natriumkloridlösning för injektion. Injektionerna upprepas efter behov för att bibehålla en god funktion och för att minimera smärtan. I kliniska studier var behandlingseffekten varierande. Hos de patienter som svarade på behandlingen (de som upplevde en förbättring av TWSTRS som var större än 20% över baseline) observerades följande varaktighet av effekten: minst 4 veckor (40% av patienterna); minst 8 veckor (30%); minst 12 veckor (16%); 16 veckor eller längre (14%). Vuxna (inklusive äldre personer ≥65 år) Den dos som rekommenderas vid cervikal dystoni är tillämplig på vuxna i alla åldrar, inklusive äldre människor. För patienter med reducerad muskelmassa bör dosen justeras efter varje patients behov. Barn (< 18 år) 2 NeuroBlocs säkerhet och effektivitet har inte undersökts på barn. Nedsatt lever- och njurfunktion Studier har inte utförts på patienter med nedsatt lever- och njurfunktion. De farmkologiska egenskaperna pekar dock inte på att dosen behöver justeras. 4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot något av hjälpämnena. Personer med andra kända neuromuskulära sjukdomar (t.ex. ALS eller perifer neuropati) eller kända neuromuskulära förbindelsesjukdomar (t.ex. myasthenia gravis eller Lambert-Eatons syndrom) bör inte ges NeuroBloc. 4.4 Varningar och försiktighetsmått NeuroBloc rekommenderas endast för intramuskulär administrering och bör endast injiceras av specialistläkare med erfarenhet av behandling av cervikal dystoni och av användning av botulinumtoxiner. Särskild försiktighet måste iakttas så att det inte injiceras i ett blodkärl. Efter upprepad administrering av NeuroBloc kan ett immunsvar uppstå på grund av att neutraliserande antikroppar till Botulinum Toxin Typ B bildas. Tolerans, som tros bero på att ett immunsvar utvecklats, skulle kunna inträffa i sällsynta fall. I likhet med alla injicerade läkemedel bör NeuroBloc användas med försiktighet hos patienter som har blödningsstörningar eller som behandlas med antikoagulantia. NeuroBloc innehåller humant albumin. När man tillför medicinska produkter som härrör från humant blod eller plasma kan man inte helt utesluta möjligheten av att smittsamma ämnen överförs. För att minska risken för överföring av infektioner tillämpas strikt kontroll av val av blodgivare och donationer. Dessutom innefattas virusinaktiverande procedurer i framställningsprocessen. Den initiala startdosen på 10 000 E (eller 5000 E) gäller bara NeuroBloc (Botulinum Toxin Typ B). Dessa dosenheter är specifika för NeuroBloc och är inte relevanta för beredningar av Botulinum Toxin Typ A. De rekommenderade enhetsdoserna för Botulinum Toxin Typ A är signifikant lägre än dem för NeuroBloc. Att ge Botulinum Toxin Typ A i den enhetsdos som rekommenderas för NeuroBloc kan resultera i systemisk toxicitet och få livshotande kliniska följder. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Effekten av samtidig administrering av olika serotyper av neurotoxiner med botulinum är för närvarande inte känd. I kliniska försök gavs dock NeuroBloc 16 veckor efter injektion med Botulinum Toxin Typ A. Samtidig administrering av NeuroBloc och aminoglykosider eller ämnen som interfererar med neuromuskulär transmission (t.ex. curareliknande ämnen) bör ske med stor försiktighet. 4.6 Graviditet och amning NeuroBloc har inte uppvisat embryotoxiska eller teratogena egenskaper på djur. Säker användning av Neurobloc till gravida eller ammande kvinnor har inte påvisats. Därför skall NeuroBloc generellt inte användas till gravida eller ammande kvinnor. Eftersom det saknas kliniska data om exponerade graviditeter, skall NeuroBloc endast användas under graviditet om den eventuella nyttan rättfärdigar den potentiella risken för fostret. 3 4.7 Effekter på förmågan att framföra fordon och använda maskiner Studier för att fastställa om NeuroBloc påverkar patientens förmåga att köra fordon eller använda maskiner har inte utförts. De farmakologiska egenskaperna tyder dock inte på att de skulle påverkas negativt. 4.8 Biverkningar Biverkningar kan förekomma på grund av djupa eller felaktigt placerade injektioner, eller om toxinet sprider sig utanför de injicerade musklerna. De två vanligaste biverkningar som rapporterats i kliniska försök var torr mun och dysfagi som rapporterades i en frekvens på 41% respektive 29%. Data från kliniska studier tyder på att proportionen av behandlingar som är associerade med dysfagi tenderar att öka när högre doser injiceras i sternokleidomastoidmuskeln. Smärta på injektionsstället rapporterades också, men den var inte relaterad till dosen. Biverkningar som uppträdde i alla försök är uppräknade här nedan efter organtyp och frekvens och definieras enligt följande: Mycket vanliga (>1/10); Vanliga (>1/100, <1/10); Sällsynta (>1/1000, <1/100). CNS – Mycket vanligt: torr mun; Vanligt: nackspärr (försämring från baselinen) Allmänna – Mycket vanligt: smärta på injektionsstället; Vanligt: ont i nacken Gastrointestinala – Mycket vanligt: dysfagi; Vanligt: dyspepsi Andningsorganen – Vanligt: ändrat röstläge Muskuloskeletala – Vanligt: myasteni Sinnesorganen – Vanligt: förändrad smak I likhet med Botulinum Toxin Typ A kan elektrofysiologiska darrningar, som inte associeras med klinisk svaghet eller andra elektrofysiologiska abnormiteter, upplevas i vissa avlägsna muskler. Erfarenheter efter lansering Sällsynta fall av kräkning, förstoppning, influensaliknande symptom, kraftlöshet, onormal ackomodationsförmåga och ptos. Det har förekommit sällsynta rapporter om svår dysfagi som krävde medicinsk intervention. 4.9 Överdosering Fall av överdos (vissa med tecken på systemisk toxicitet) har rapporterats. I fall av en överdos bör generella medicinska stödåtgärder sättas in. Doser på upp till 15 000 enheter har i sällsynta fall resulterat i kliniskt signifikant systemisk toxicitet hos vuxna. Hos barn (ej godkänd användning) har dock kliniskt signifikant systemisk toxicitet uppkommit vid doser som är godkända för behandlingen av vuxna patienter. Om botulism misstänks kliniskt, kan inläggning på sjukhus erfordras för monitorering av andningsfunktionen (begynnande andningssvikt). I fall av en överdos eller injektion i en muskel som normalt kompenserar för den cervikala dystonin, är det tänkbart att dystonin förvärras. I likhet med andra botulinustoxiner sker spontant tillfrisknande över en längre period. 4 5. FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: muskelavslappande medel, perifert verkande. ATC-kod: MO3A X 01 NeuroBloc är ett neuromuskulärt blockerande medel. NeuroBloc verkar genom att blockera neuromuskulär överföring, vilket sker genom en trestegsprocess: 1. 2. 3. Extracellulär bindning av toxinet till specfika mottagare på motoriska nervterminaler Internalisering och frisättning av toxinet till cytosol i nervterminalerna Hämning av frisättning av acetylkolin från nervterminalerna i den neuromuskulära förbindelsen När NeuroBloc injiceras direkt i en muskel förorsakar det en lokal paralys som gradvis upphävs med tiden. Den mekanism som gör att muskelförlamningen med tiden upphävs är okänd, men kan ha samband med det angripna proteinets intraneuronala omsättning och/eller utväxt av nya nervtrådar. Två randomiserade, multicenter, dubbelblinda, placebo-kontrollerade fas-III-studier utfördes på patienter med cervikal dystoni. Till båda studierna rekryterades vuxna patienter (≥ 18 år) som tidigare fått Botulinum Toxin Typ A. I den första studien deltog patienter som var kliniskt resistenta mot typ A toxin (A-opåverkade), bekräftat genom ett Frontalis Typ A-test. I den andra studien deltog patienter som fortsatte svara på typ A-toxin (A-responsiva). Vid rekryteringen hade alla patienter en total score på 20 eller mer enligt Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS) med minst två muskler involverade, inga nackkontraktioner eller andra anledningar till minskad rörelseomfång i nacken samt ingen annan tidigare neuromuskulär störning. TWSTRS utgörs av tre underskalor som undersöker svårighetsgrad, smärta och invaliditetsgrad. I den första studien utvaldes typ A-resistenta patienter (A-opåverkade) slumpmässigt till att få placebo eller 10 000 E av NeuroBloc och till den andra randomiserades patienter som svarade på typ A-toxin (A-responsiva) till att få placebo, 5000 E eller 10 000 E av toxinet. Studieläkemedlet injicerades vid ett och samma tillfälle i 2-4 av följande muskler: splenius capitis, sternocleidomastoideus, levator scapulae, trapezius, semispinalis capitis och scalenus. Den totala dosen delades lika mellan de valda musklerna och 1-5 injektioner per muskel gavs. Till den första studien rekryterades 77 patienter och till den andra 109. Evalueringen av patienterna pågick under 16 veckor efter injektionerna. Den primära variabeln för effektivitetsresultat i båda studierna var den totala scoren i TWSTRS (möjlig score varierar mellan 0 och 87) vid vecka 4. De andra ändpunkterna inkluderade Visual Analogue Scales (VAS) för att kvantifiera global patientbedömning av förändring och global läkarbedömning av förändring, båda från baseline till vecka 4. På dessa skalor indikerar en score på 50 ingen förändring, 0 mycket sämre och 100 mycket bättre. Resultaten av jämförelserna mellan den primära och de sekundära effektivitetsvariablerna sammanfattas i tabell 1. Analyser av TWSTRS subskalor visade signifikanta effekter beträffande svårighetsgraden av cervikal dystoni och därmed förbunden smärta och invaliditet. Preliminära analyser av dessa studier tydde på att de flesta patienter som uppvisade ett positivt svar vid fjärde veckan hade återgått till sitt baselinetillstånd 12 till 16 veckor efter sin injektion. 5 Tabell 1: Effektivitetsresultat från fas-III-studier av NeuroBloc STUDIE 1 (A-Opåverkade Patienter) Placebo 10 000 E n = 38 n = 39 Evaluering TWSTRS Totalt 51,2 Medelvärde vid Baseline 49,2 Medelvärde Vecka 4 -2,0 Ändring från Baseline P-Värde* Patient Globalt 39,5 Medelvärde Vecka 4 P-Värde* Läkare Globalt 47,9 Medelvärde Vecka 4 P-Värde* *Analys av kovarians, tvådelade tester, α = 0,05 STUDIE 2 (A-Responsiva Patienter) Placebo 5000 E 10 000 E n = 36 n = 36 n = 37 52,8 41,8 -11,1 0,0001 43,6 39,3 -4,3 46,4 37,1 -9,3 0,0115 46,9 35,2 -11,7 0,0004 60,2 0,0001 43,6 60,6 0,0010 64,6 0,0001 60,6 0,0001 52,0 65,3 0,0011 64,2 0,0038 Ytterligare en preliminär varaktighetsanalys av effekten använde sig av data från en fas-II-studie jämte de beskrivna data från fas III. Hos de patienter som svarade på behandling (de som upplevde en förbättring enligt TWSTRS som var större än 20% över baselinen) observerades följande effektduration vid doser på 5000 och 10 000 E. Tabell 2 Effektduration hos responsiva patienter Dos 5000 E 10 000 E Generellt 4 Veckor 43 38 40 Effektduration (% Responsiva Patienter) 8 Veckor 12 Veckor 22 16 34 16 30 16 16 Veckor 19 11 14 I öppna studier gavs doser på upp till 15 000 E till patienter med intervaller på minst 12 veckor. Andelen patienter som svarade på dessa injektioner var ungefär densamma som i de kontrollerade huvudstudierna. En fas IV-studie genomfördes för att demonstrera att NeuroBloc inte är underlägset Botulinum Toxin typ A hos patienter med cervikal dystoni som aldrig tidigare hade erhållit någon produkt med botulinumtoxin. En preliminär analys genomfördes på de totalt 111 deltagande botulinumnaiva patienterna (56 i NeuroBloc-gruppen) efter en enstaka injektion av NeuroBloc 10 000 enheter eller Botulinum Toxin typ A 150 enheter i två av fyra i förväg utvalda muskler. Baslinjebedömningarna, som innefattade smärtbedömning utförd av patient och prövare med TWSTRS och VAS, upprepades 4, 8 och 12 veckor efter behandlingen. Effekterna av de båda behandlingarna var väsentligen de samma vid varje tidpunkt fram till 12 veckor efter behandling (tabell 3). Analysen visade att det inte föreligger några kliniskt relevanta skillnader mellan dessa två behandlingar. En primär analys av medlets icke-underlägsenhet gav resultatet ”ej bevisad” (90 % konfidensintervall för skillnaden –2,66; 4,01 jämfört med en övre gräns på <4,00), emellertid tyder en känslighetsanalys av robustheten och den bekräftande analysen av ITT-populationen (90 % konfidensintervall för skillnaden –3,4; 3,2 respektive –3,23; 2,98) på att det inte föreligger någon kliniskt relevant skillnad mellan de båda medlen. 6 Tabell 3: Sammanfattning av TWSTRS – total poäng för alla besök: Behandling 1 (PP-populationen) Besök Dag 0 Vecka 4 Vecka 8 Vecka 12 5.2 Statistiska parametrar n: medel (SD) n: medel (SD) n: medel (SD) n: medel (SD) NeuroBloc 41: 44,9 (11,3) 41: 33,2 (10,8) 37: 33,5 (11,9) 32: 39,7 (12,5) Behandling Botulinum Toxin typ A 48: 45,3 (10,8) 48: 32,8 (11,0) 47: 32,5 (13,0) 43: 39,7 (16,3) Farmakokinetiska uppgifter NeuroBloc som injiceras intramuskulärt åstadkommer lokal muskelsvaghet genom kemisk denervering. Efter lokal intramuskulär injektion av NeuroBloc observerades allvarliga biverkningar, som kan ha berott på systemeffekter av Botulinum Toxin Typ B, i 12 % av biverkningsfallen rapporterade efter lansering (inklusive följande biverkningar: muntorrhet, dysfagi och onormal ackomodationsförmåga). Några farmakokinetiska studier eller studier av absorption, distribution, metabolism och utsöndring har dock inte utförts. 5.3 Prekliniska säkerhetsuppgifter Farmakologiska studier med en engångsdos på cynomolgus-apor visade inga andra effekter än den förväntade dosrelaterade förlamningen av injicerade muskler utom en viss toxindiffusion vid höga doser som gav liknande effekter i närliggande, icke injicerade muskler. Toxikologiska studier med en intramuskulär engångsdos har utförts på cynomolgus-apor. Den systemiska “No Observed Effect Level” (NOEL) visades vara 960 E/kg. Den dos som ledde till död var 2400 E/kg. På grund av produktens natur har några djurstudier inte utförts för att fastställa NeuroBlocs karcinogena effekter. Standardtester för att undersöka mutageniciteten hos NeuroBloc har inte utförts. Utvecklingsstudier på råttor och kaniner har inte visat några tecken på fostermissbildningar eller förändrad fertilitet. I utvecklingsstudierna var dosnivån för råttor utan observerade biverkningar (NOAEL, No Observed Adverse Effect Dose Level) 1 000 enheter/kg/dag för effekter på modern och 3 000 enheter/kg/dag för effekter på fostret. För kaniner var NOAEL 0,1 enhet/kg/dag för effekter på modern och 0,3 enheter/kg/dag för effekter på fostret. I fertilitetsstudier var NOAEL 300 enheter/kg/dag för generell toxicitet både hos hannar och honor och 1 000 enheter/kg/dag för fertilitet och reproduktionsförmåga. 6. FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Dinatriumsuccinat, natriumklorid, humant serumalbumin, natriumkaprylat, natriumacetyltryptofanat, saltsyra, vatten för injektion. 6.2 Blandbarhet Då blandbarhetsstudier saknas skall NeuroBloc inte blandas med andra läkemedel. 6.3 Hållbarhet 7 2 år. 6.4 Särskilda förvaringsanvisningar Förvaras vid 2 °C – 8 °C. Får ej frysas. Förvaras i ytterkartongen för att skyddas mot ljus. Ampullerna kan förvaras i upp till 8 timmar i rumstemperatur. 6.5 Förpackningstyp och innehåll NeuroBloc levereras i 3,5 ml glasampuller av typ I, med kisellegerade 13 mm grå proppar av butylgummi som utanpå har en 13 mm aluminiumkapsyl med skåra. Kartong med engångsampull innehållande 0,5 ml, 1,0 ml eller 2,0 ml lösning. Lösningen är klar och färglös till ljust gul. 6.6 Anvisningar för användning och hantering, samt destruktion Lösningen i ampullerna är klar att använda. NeuroBloc kan spädas med 0,9 vikt/volymprocent natriumkloridlösning för injektion. Omskakas ej. Dekontaminera ev. överbliven lösning med 10% kaustisk lösning eller natriumhypokloritlösning (klorblekmedel för hushåll – 2 ml (0,5%): 1 liter vatten). Använd gummihandskar och sug upp vätskan med lämplig trasa. Lägg det uppsugna toxinet i en autoklaveringspåse, förslut den och behandla som medicinskt riskavfall i enlighet med lokala föreskrifter. På grund av NeuroBlocs speciella karaktär måste använda ampuller, nålar och sprutor behandlas som medicinskt riskavfall i enlighet med lokala föreskrifter. 7. INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Elan Pharma International Ltd., WIL House, Shannon Business Park, Shannon, County Clare, Irland. 8. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING EU/1/00/166/001 – 2500 E EU/1/00/166/002 – 5000 U EU/1/00/166/003 – 10 000 E 9. DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE 22 Januari 2001 10. DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 8 BILAGA II A. TILLVERKARE AV DET AKTIVA INNEHÅLLSÄMNET OCH INNEHAVARE AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS B. VILLKOR FÖR GODKÄNNANDE FÖR FÖRSÄLJNING 9 A. TILLVERKARE AV DET AKTIVA INNEHÅLLSÄMNET OCH INNEHAVARE AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS Namn och adress till tillverkare av aktivt innehållsämne av biologiskt ursprung Solstice Neurosciences Inc 701 Gateway Blvd, South San Francisco California 94080 USA Namn och adress till tillverkare som ansvarar för frisläppande av tillverkningssats PDMS Almac House 20 Seagoe Industrial Estate, Craigavon BT63 5QD Storbritannien B. VILLKOR FÖR GODKÄNNANDE FÖR FÖRSÄLJNING • VILLKOR ELLER BEGRÄNSNINGAR AVSEENDE FÖRORDNANDE OCH ANVÄNDNING SOM ÅLAGTS INNEHAVAREN AV GODKÄNNANDET FÖR FÖRSÄLJNING Läkemedel som med begränsningar lämnas ut mot recept (Se bilaga I: Produktresumén 4.2). • ÖVRIGA VILLKOR Innehavaren av godkännandet för försäljning skall underrätta Europeiska kommissionen om marknadsföringsplanerna för detta läkemedel som godkänts genom detta beslut. 10 BILAGA III MÄRKNING OCH BIPACKSEDEL 11 A. MÄRKNING 12 UPPGIFTER SOM SKALL FINNAS PÅ YTTRE FÖRPACKNINGEN ELLER, DÄR SÅDAN SAKNAS, DIREKT PÅ LÄKEMEDELSFÖRPACKNINGEN 0,5 ml flaska 1. LÄKEMEDLETS NAMN NeuroBloc 5000 E/ml Lösning för injektion. Botulinum Toxin Typ B. 2. DEKLARATION AV AKTIVT(A) INNEHÅLLS (N) Deklaration: 5000 E/ml Botulinum Toxin Typ B (2500 E per flaska) 3. FÖRTECKNING ÖVER HJÄLPÄMNEN Dinatriumsuccinat, natriumklorid, humant serumalbumin, natriumkaprylat, natriumacetyltryptofanat, saltsyra och vatten för injektion. 4. LÄKEMEDELSFORM OCH FÖRPACKNINGSSTORLEK Lösning för injektion. 1 x 0,5 ml flaska, 2500 E 5. ADMINISTRERINGSSÄTT OCH OM DET ÄR NÖDVÄNDIGT ADMINISTRERINGSVÄG Intramuskulärt Läs bipacksedeln före användning. 6. SÄRSKILD VARNING OM ATT LÄKEMEDLET MÅSTE FÖRVARAS OÅTKOMLIGT FÖR BARN FÖRVARAS UTOM SYN- OCH RÄCKHÅLL FÖR BARN 7. ÖVRIGA SÄRSKILDA VARNINGAR, OM DET ÄR NÖDVÄNDIGT Omskakas ej. 8. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 13 9. SÄRSKILDA FÖRVARINGSANVISNINGAR Förvaras vid 2 °C - + 8 °C (i kylskåp). Får ej frysas. Förvaras i ytterkartongen- ljuskänsligt. 10. SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL OCH AVFALL I FÖREKOMMANDE FALL Läs bipacksedeln för särskilda anvisningar beträffande hantering och kassering. 11. INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING (NAMN OCH ADRESS) Innehavare av godkännande för försäljning: Elan Pharma International Ltd. WIL House Shannon Business Park Shannon, County Clare Irland 12. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING EU/1/00/166/001 13. TILLVERKARENS NUMMER PÅ TILLVERKNINGSSATS SATS NR: 14. ALLMÄN KLASSIFICERING FÖR FÖRSKRIVNING Receptbelagt läkemedel. 15. BRUKSANVISNING [Ej relevant.] 14 UPPGIFTER SOM SKALL FINNAS PÅ INRE LÄKEMEDELSFÖRPACKNINGEN 0,5 ml flaska 1. LÄKEMEDLETS NAMN OCH OM DET ÄR NÖDVÄNDIGT ADMINISTRERINGSVÄG NeuroBloc 2. ADMINISTRERINGSSÄTT i.m. 3. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 4. NUMMER PÅ TILLVERKNINGSSATS SATS NR: 5. MÄNGDANGIVELSE UTTRYCKT I VIKT, VOLYM ELLER PER ENHET 2500 E 15 UPPGIFTER SOM SKALL FINNAS PÅ YTTRE FÖRPACKNINGEN ELLER DÄR SÅDAN SAKNAS, DIREKT PÅ LÄKEMEDELSFÖRPACKNINGEN 1,0 ml flaska 1. LÄKEMEDLETS NAMN NeuroBloc 5000 E/ml Lösning för injektion. Botulinum Toxin Typ B. 2. DEKLARATION AV AKTIVT(A) INNEHÅLLSÄMNE(N)) Deklaration: 5000 E/ml Botulinum Toxin Typ B (5000 E per flaska) 3. FÖRTECKNING ÖVER HJÄLPÄMNEN Dinatriumsuccinat, natriumklorid, humant serumalbumin, natriumkaprylat, natriumacetyltryptofanat, saltsyra och vatten för injektion. 4. LÄKEMEDELSFORM OCH FÖRPACKNINGSSTORLEK Lösning för injektion 1 x 1,0 ml flaska, 5000 E 5. ADMINISTRERINGSSÄTT OCH OM DET ÄR NÖDVÄNDIGT ADMINISTRERINGSVÄG Intramuskulärt Läs bipacksedeln före användning. 6. SÄRSKILD VARNING OM ATT LÄKEMEDLET MÅSTE FÖRVARAS OÅTKOMLIGT FÖR BARN FÖRVARAS UTOM SYN- OCH RÄCKHÅLL FÖR BARN 7. ÖVRIGA SÄRSKILDA VARNINGAR, OM DET ÄR NÖDVÄNDIGT Omskakas ej. 8. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 16 9. SÄRSKILDA FÖRVARINGSANVISNINGAR Förvaras vid 2 °C - + 8 °C( i kylskåp). Får ej frysas. Förvara i ytterkartongen - ljuskänsligt. 10. SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL OCH AVFALL I FÖREKOMMANDE FALL Läs bipacksedeln för särskilda anvisningar beträffande hantering och kassering. 11. INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING (NAMN OCH ADRESS) Innehavare av godkännande för försäljning: Elan Pharma International Ltd. WIL House Shannon Business Park Shannon, County Clare Irland 12. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING EU/1/00/166/002 13. TILLVERKARENS NUMMER PÅ TILLVERKNINGSSATS SATS NR: 14. ALLMÄN KLASSIFICERING FÖR FÖRSKRIVNING Receptbelagt läkemedel. 15. BRUKSANVISNING [Ej relevant.] 17 UPPGIFTER SOM SKALL FINNAS PÅ INRE LÄKEMEDELSFÖRPACKNINGEN 1,0 ml flaska 1. LÄKEMEDLETS NAMN OCH OM DET ÄR NÖDVÄNDIGT ADMINISTRERINGSVÄG NeuroBloc 2. ADMINISTRERINGSSÄTT i.m. 3. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 4. NUMMER PÅ TILLVERKNINGSSATS SATS NR: 5. MÄNGDANGIVELSE UTTRYCKT I VIKT, VOLYM ELLER PER ENHET 5000 E 18 UPPGIFTER SOM SKALL FINNAS PÅ YTTRE FÖRPACKNINGEN ELLER, DÄR SÅDAN SAKNAS, DIREKT PÅ LÄKEMEDELSFÖRPACKNINGEN 2,0 ml flaska 1. LÄKEMEDLETS NAMN NeuroBloc 5000 E/ml Lösning för injektion. Botulinum Toxin Typ B. 2. DEKLARATION AV AKTIVT(A) INNEHÅLLSÄMNE(N)) Deklaration: 5000 E/ml Botulinum Toxin Typ B (10 000 E per flaska) 3. FÖRTECKNING ÖVER HJÄLPÄMNEN Dinatriumsuccinat, natriumklorid, humant serumalbumin, natriumkaprylat, natriumacetyltryptofanat, saltsyra och vatten för injektion. 4. LÄKEMEDELSFORM OCH FÖRPACKNINGSSTORLEK Lösning för injektion 1 x 2,0 ml flaska, 10 000 E 5. ADMINISTRERINGSSÄTT OCH OM DET ÄR NÖDVÄNDIGT ADMINISTRERINGSVÄG Intramuskulärt Läs bipacksedeln före användning. 6. SÄRSKILD VARNING OM ATT LÄKEMEDLET MÅSTE FÖRVARAS OÅTKOMLIGT FÖR BARN FÖRVARAS UTOM SYN- OCH RÄCKHÅLL FÖR BARN 7. ÖVRIGA SÄRSKILDA VARNINGAR, OM DET ÄR NÖDVÄNDIGT Omskakas ej. 8. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 19 9. SÄRSKILDA FÖRVARINGSANVISNINGAR Förvaras vid 2 °C - + 8 °C (i kylskåp). Förvara i ytterkartongen - ljuskänsligt. 10. SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL OCH AVFALL I FÖREKOMMANDE FALL Läs bipacksedeln för särskilda anvisningar beträffande hantering och kassering. 11. INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING (NAMN OCH ADRESS) Innehavare av godkännande för försäljning: Elan Pharma International Ltd. WIL House Shannon Business Park Shannon, County Clare Irland 12. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING EU/1/00/166/003 13. TILLVERKARENS NUMMER PÅ TILLVERKNINGSSATS SATS NR: 14. ALLMÄN KLASSIFICERING FÖR FÖRSKRIVNING Receptbelagt läkemedel. 15. BRUKSANVISNING [Ej relevant.] 20 UPPGIFTER SOM SKALL FINNAS PÅ INRE LÄKEMEDELSFÖRPACKNINGEN 2,0 ml flaska 1. LÄKEMEDLETS NAMN OCH OM DET ÄR NÖDVÄNDIGTADMINISTRERINGSVÄG NeuroBloc 2. ADMINISTRERINGSSÄTT i.m. 3. UTGÅNGSDATUM UTG.DAT: MM-ÅÅÅÅ 4. NUMMER PÅ TILLVERKNINGSSATS SATS NR: 5. MÄNGDANGIVELSE UTTRYCKT I VIKT, VOLYM ELLER PER ENHET 10 000 E 21 B. BIPACKSEDEL 22 BIPACKSEDEL Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Spara denna bipacksedel, du kan behöva läsa om den. Om du har ytterligare frågor vänd dig till din läkare eller farmaceut. Detta läkemedel har ordinerats åt dig personligen. Du bör inte ge det vidare till andra. Det kan skada dem, även om de uppvisar symtom som liknar dina. I den här bipacksedeln finner du information om: 1. Vad är NeuroBloc och vad används det för? 2. Innan du tar NeuroBloc 3. Hur du tar NeuroBloc 4. Eventuella biverkningar 5. Förvaring av NeuroBloc NeuroBloc 5000 E/ml lösning för injektion. Den aktiva substansen i NeuroBloc är Botulinum Toxin Typ B. De andra innehållsämnena är dinatriumsuccinat, natriumklorid, humant serumalbumin, natriumkaprylat, natriumacetyltryptofanat, saltsyra och vatten för injektion. Innehavaren av godkännande för försäljning är: Elan Pharma International Ltd. WIL House Shannon Business Park Shannon, County Clare Irland. Tillverkaren är: PDMS Almac House 20 Seagoe Industrial Estate Craigavon BT63 5QD Storbritannien 1. VAD ÄR NEUROBLOC OCH VAD ANVÄNDS DET FÖR? NeuroBloc är ett toxin som framställts av bakterier som kallas Clostridium botulinum. Det är en klar och färglös till ljust gul lösning som levereras i en glasflaska som innehåller 0,5 ml (2500 enheter), 1,0 ml (5000 enheter) eller 2,0 ml (10 000 enheter) lösning för injektion. NeuroBloc minskar frisättningen av den “kemiska budbäraren”acetylkolin, som består av nerver och säger åt dina muskler att dra ihop sig. Om nerver förhindras att frisätta denna budbärare kan onormala muskelsammandragningar minskas eller helt stoppas. NeuroBloc används för att behandla cervikal dystoni (nackspärr). Om du lider av cervikal dystoni har du sammandragningar i nackens och/eller skuldrornas muskler som du inte kan kontrollera. 2. INNAN DU TAR NEUROBLOC 23 Tala om för din läkare: om du är överkänslig mot något av innehållsämnena i den här medicinen om du har en neuromuskulär sjukdom, särskilt sådan som orsakar muskelsvaghet om du är gravid eller ammar eftersom du inte bör få NeuroBloc i dessa fall. Tala också om för din läkare: om du lider av en blödarsjukdom, t.ex. hemofili när du tar medicin av typ warfarin för att förhindra proppbildning Du ska normalt inte få NeuroBloc om du är under 18 år gammal, eftersom det inte har prövats på denna grupp av patienter. Graviditet och amning: I regel ska du inte ta NeuroBloc om du är gravid eller ammar. Körförmåga och användning av maskiner: NeuroBloc bör inte påverka körförmåga eller användning av maskiner. Om du känner dig trött eller har tappat känseln någonstans måste du vara försiktig när du kör bil eller använder maskiner. Viktig information om något av innehållsämnena i NeuroBloc: NeuroBloc innehåller en mycket liten mängd albumin som kommer från människoblod. Det är ytterst osannolikt att detta skulle kunna överföra någon infektion, men det kan inte helt uteslutas. Användning av andra läkemedel: Tala om för din läkare om du tar antibiotika mot infektion. Om du ska genomgå en operation bör du tala om för läkaren om du har fått NeuroBloc eftersom det kan påverka de eventuella mediciner du får före narkos. Tala också om för din läkare eller farmaceut om du tar eller nyligen tagit andra läkemedel, även receptfria sådana. 3. HUR DU TAR NEUROBLOC Din läkare avgör hur mycket NeuroBloc du ska få. Dosen är oftast 10 000 enheter, men den kan vara högre eller lägre, beroende på vad din läkare beslutar och ditt svar på eventuella tidigare injektioner med NeuroBloc. Om du upplever att effekten av NeuroBloc är för stark eller för svag vänd dig till din läkare. NeuroBloc kommer att injiceras i dina nack- och/eller skuldermuskler, beroende på vilka muskler som orsakar problemet. Din läkare bedömer i vilka muskler han eller hon ska spruta in NeuroBloc och kanske injicerar en del av dosen på olika ställen i musklerna. NeuroBlocs effekter avklingar vanligen efter cirka 12 till 16 veckor. Din läkare bedömer när du behöver en ny injektion och hur mycket du ska få. Du kan fortsätta få injektioner med NeuroBloc så länge som det lindrar dina symtom. När du har fått ett antal injektioner kan det hända att din kropp producerar antikroppar, som kan göra behandlingen mindre effektiv. Din läkare känner till detta och kommer att söka efter tecken på detta. Om du får mer NeuroBloc än du behöver, kan det hända att de muskler som inte blivit injicerade känns svaga. Om detta händer måste du tala om det för din läkare. Berätta också snarast för läkaren om du känner, att du har svårt att andas. Om han eller hon inte är tillgänglig bör du söka akuthjälp. Om du glömmer att besöka läkaren för att få din injektion: 24 NeuroBlocs effekter kommer gradvis att avta och de onormala muskelsammandragningarna kan komma tillbaka. 4. EVENTUELLA BIVERKNINGAR Liksom alla läkemedel kan NeuroBloc både ha oönskade och önskade effekter. Du kan känna smärta på det ställe där du fick injektionen, men den bör gå över efter några minuter. Andra biverkningar orsakas av att NeuroBloc sprider sig till vävnader i närheten av den injicerade muskeln. Det kan hända att du känner dig torr i munnen och/eller att du får svårt att svälja. I sällsynta fall, kan svårigheten att svälja bli så allvarlig att kvävning är möjlig. Om du får svårt att svälja eller problem med andningen måste du söka läkarhjälp omedelbart. Du kanske känner en eller flera av följande biverkningar efter att ha fått din injektion. svaghet, värk eller muskelstelhet runt om i kroppen ont i nacken magbesvär förändringar i smaken på vad du äter och dricker förändringar i hur din röst låter. I sällsynta fall kan du få: kräkningar förstoppning influensaliknande symptom dimsyn nedhängande övre ögonlock kraftlöshet och energiförlust Det är också möjligt att nackspärren (huvudvridningen som du inte kan kontrollera) kan bli värre efter att du har fått din injektion. Om du känner dig osäker på någonting, kontakta din läkare. Om du observerar en eller flera biverkningar som inte nämns i den här bipacksedeln, tala om det för din läkare eller farmaceut. 5. FÖRVARING AV NEUROBLOC Förvaras utom syn- och räckhåll för barn. Förvaras vid 2 °C-8 °C (i kylskåp). Får ej frysas. Förvara ampullen i ytterkartongen för att skydda den mot ljus. NeuroBloc kan förvaras i upp till 8 timmar i rumstemperatur. Använd inte detta läkemedel efter utgångsdatumet på kartongen. Denna bipacksedel godkändes senast den 25 ------------------------------------------------------------------------------------------------------------------------ANVISNINGAR FÖR ANVÄNDNING, HANTERING OCH KASSERING Lösningen i flaskorna är klar att använda. NeuroBloc kan spädas med 0,9 vikt/volymprocent natriumkloridlösning för injektion. Omskakas ej. Dekontaminera ev. överbliven lösning med 10% kaustisk lösning eller natriumhypokloritlösning (klorblekmedel för hushåll – 2 ml (0,5%): 1 liter vatten). Använd gummihandskar och sug upp vätskan med lämplig trasa. Lägg det uppsugna toxinet i en autoklaveringspåse, förslut den och behandla som medicinskt riskavfall i enlighet med lokala föreskrifter. På grund av NeuroBlocs speciella egenskaper måste flaskor, nålar och sprutor behandlas som medicinskt riskavfall i enlighet med sjukhusets regler och föreskrifter 26