Allmän och inledande biokemi
advertisement

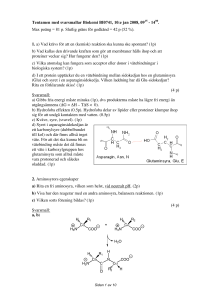
Sluttentamen med svarsmallar Bke2/KE0003, 31:e Oktober 2001, 0900 - 1600. Max poäng = 123 p. Preliminär gräns för godkänd = 65 p (53 %). 1. Tre viktiga grupper av biomolekyler är polymerer. Ange vilka (3p) Ange för var och en av dessa vilken slags monomer de är uppbyggda av (3p), och deras huvudsakliga användning(ar) i cellen (1.5p). Ange också för varje polymer om den är en viktig energikälla i födan (1.5p). (9 p) Svarsmall: Polymer Monomer Användning Energikälla Poäng 0.5p om det understrukna nämns. Om det saknas men andra viktiga funktioner nämns ges 0.25p Energilagring (0.5p) eller struktur, Kolhydr MonoJa (0.5p) 3 at (1p) sackarider märkning etc (0.25p) (1p) Protein Aminosyror Enzym-katalys (0.5p) eller Ja (0.5p) 3 (1p) (1p) Struktur, reglering, signalering etc. (0.25p) Nej (0.5p) 3 Nuklein- Nukleotider Information (0.5p) (0.5p) syror (0.5p) 2. Den hydrofoba effekten är av central betydelse för hur levande organismer ser ut och fungerar. För framförallt två komponenter som celler har är den hydrofoba effekten drivande kraft för deras stabilisering och funktion. Vilka? (2p) Beskriv och förklara kortfattat! (2p) (4 p) Svarsmall: 1) Biologiska membran (1p) (t.ex. cellmembran) bildas genom att fosfolipider packas samman med de hydrofoba delarna mot varandra så att ett dubbelmembran bildas. De polära huvudgrupperna på lipiderna ligger ut mot omgivningen (i kontakt med vatten) (1p). (Svaret kan lämpligtvis ges i en figur). 2) Proteiner (1p) antar en kompakt tredimensionell form därför att hydrofoba sidokedjor packas mot varandra i en hydrofob kärna där de undgår kontakt med vatten (1p). 3. Vid en jämförelse av ett antal myoglobinsekvenser finner du ett antal konserverade aminosyror, bl.a. sekvensen X-P-G-Y, där X är aminosyra med polär sidokedja och Y är en aminosyra med sur sidokedja. a) Vad drar du för slutsats av detta? (1p) b) Rita tetrapeptiden ovan med huvudkedja (1p) och sidokedjor (1p för varje) markera peptidplan (1p) samt fritt roterbara bindingar i huvudkedjan (phi & psi) (1p). Anta att pH = 7.0 och ange rätt laddningar (1p). (Totalt 8p) c) En av aminosyrorna ovan återfinns endast sällan i alfa-helixstruktur. Vilken? (1p) Beskriv med en skiss alfa-helixstrukturen (2p) och förklara varför denna sidokedja sällan åtefinns (1p). (Totalt 4p) (13 p) Svarsmall: a) Alla myoglobinmolekylerna har en böj på detta ställe (1p). b) 8p för korrekt figur (1p för varje korrekt sidokedja, 1p för korrekt huvudkedja, 1p för korrekta peptidplan, 1p för korrekta phi/psi-vinklar, 1p för korrekta laddningar hos sidokedjor och terminaler) c) Prolin (P) (1p). Alfahelix är en högervriden spiral med 3.6 aminosyror/varv (1p). Stabiliseras av vätebindingar mellan C=O på aminosyra n och NH på aminosyra n+4 (1p). Prolin saknar väte på peptidkvävet som därför inte kan delta i vätebinding (1p). 4. Hemoglobin (Hb) används för transport av syre från lungor till vävnad och av koldioxid från vävnad till lungor. Myoglobin (Mb) används för att lagra syre i vävnaderna. a) Beskriv kooperativ bindning av syre till hemoglobin. (5p) b) Binder myoglobin syre kooperativt? (0.5p) Varför/varför inte? (0.5p) c) Beskriv en heterotrop alloster effekt hos hemoglobin (2p). Ge ett exempel på en heterotrop alloster effekt inom metabolismen (1p). d) Cytokrom c innehåller samma prostetiska grupp som hemoglobin. Varför kan cytokrom c ändå inte binda syre? (1p) (10 p) Svarsmall: a) Hemoglobin består av fyra (nästan likadana) subenheter. Varje subenhet kan ha en av två (huvud)konformationer, en som binder syre starkt och en som binder syre svagt (1p). De två konformationerna skiljer sig bl.a. genom att järnatomen ligger olika i förhållande till hemegruppen och i kontaktytan mellan subenheterna (1p). Endast subenheter med lika konformation passar ihop och kan bilda en stabil hemoglobintetramer (T <==> R) (1p). När syre binder till en subenhet stabiliseras den starkt bindande konformationen (1p). Det gör att hela tetrameren tenderar att övergå till denna konformation och binding av ytterligare syremolekyler underlättas (1p). b) Myoglobin binder inte syre kooperativt (0.5p) eftersom molekylen består av en enda subenhet och det alltså bara finns ett syre-bindingsställe per Mb. (0.5p) c) 2p för endera av följande exempel: Bohreffekten = sur miljö. (1p) H+ och CO2 "sköljer ut" O2 från Hb genom att binda till olika ställen runtom molekylen (i närheten av kontaktytorna mellan subenheter) och stabilisera deoxyHb (1p). eller: 2,3-BPG (2,3-bisfosfoglycerat) (1p) binder i hålrummet i mitten av deoxyHbtetrameren och stabiliserar den så att mer syre kan avges till musklerna. 2,3-BPG kan inte binda till oxyHb för där är hålrummet för litet. (I syrefattig miljö ökas produktionen av 2,3-BPG så att mer av det syre som tas upp kommer till användning). (1p). Inom metabolismen förekommer heterotrop alloster effekt ofta vid reglering av nyckelenzymer, t.ex. regleras det glykolytiska enzymet fosfofruktokinas på detta vis av bl.a. AMP, ADP, citrat och fruktos-2,6-bisfosfat. (1p) d) I cytokrom c finns ingen plats ledig för syrebinding efter som heme-järnet har en extra ligand (metionin) (1p) 5. Proteinrening och analys. a) Beskriv principen för jonbyteskromatografi. (1p) b) Ange två principiellt olika metoder för att uppskatta storleken på ett protein (metoder som inte kräver stora och dyra apparater)och hur de fungerar. (4p) (5 p) Svarsmall: a) Jonbyteskromatografi innebär att laddade molekyler (eller laddade grupper på en stor molekyl) binds till substituenter med motsatt laddning på en stationär fas (t.ex. porösa gelkulor) och följer då inte med flödet genom kolonnen. För att få dem att lossna ökar man jonstyrkan, t.ex. genom att tillsätta ökande mängd salt. Ett protein med hög nettoladdning binds starkare och kräver mera salt för att trängas ut (1p). b) Gelfiltrering (1p). Proteinlösningen får flöda genom en kolonn packad med ett poröst material (t.ex. porösa gelkulor). Proteiner utanför gelkulorna följer med vätskeflödet, men beroende på storlek kan de diffundera in i porerna och inne i porerna följer de inte med flödet. Små molekyler kan tränga längre in och ockupera större volym i gelkulorna. Därför stannar de längre tid i den sk. stationära fasen, dvs de följer inte med flödet lika stor del av tiden. Sålunda kommer små molekyler att färdas långsammare än stora. (1p) Gelelektrofores (1p). Proteiner appliceras i en gel med lösning av lämpligt pH och när man applicerar ett elektriskt fält kommer laddade proteiner att röra sig mot elektroden med motsatt laddning. Proteinerna bromsas av gelpolymerens nätverk. Små proteiner tar sig lättare igenom maskorna i nätverket och vandrar sålunda fortare än stora proteiner. (1p) 6. Kinetik. Tänk dig tre hypotetiska b-galaktosidas-enzymer A, B, C, som förutom laktos (mjölksocker, Gal-b1->4-Glu) också kan hydrolysera cellobios (Glu-b1->4-Glu). Enzymerna följer Michaelis-Menten-ekvationen och har följande kinetiska parametrar för dessa substrat: Enzym A B C Km, laktos (mM) 100 10 0.1 kcat, laktos (s-1) 100 10 1 Km, cellobios (mM) 500 50 1 kcat, cellobios (s-1) 10 10 2 a) Vilket enzym skulle du välja för att få snabbast hydrolys av laktos i vassle? (1p) Varför? (1p) Anta att laktoskoncentrationen är minst 100 mM b) Om du istället vill ha enzymet i en tablett för att i tarmen effektivt eliminera även små mängder laktos, anta 0.1 mM, vilket väljer du då (dvs.vilket enzym ger högst initial reaktionshastighet vid 0.1 mM koncentration av laktos)? (1p) Varför? (1p) c) Det vore också önskvärt om enzymet kunde eliminera eventuell cellobios som kan finnas i maten (bildas när cellulaser hydrolyserar cellulosa). Vilket enzym ger snabbast initial hydrolys av cellobios om koncentrationen är densamma som för laktos dvs. 0.1 mM? (1p) Hydrolyseras cellobios eller laktos snabbast av detta enzym? (1p) Koncentrationen är 0.1 mM för båda. (6 p) Svarsmall: a) Enzym A (1p) är snabbast på vassle. När substratkoncentrationen är relativt hög i förhållande till Km så är det enzymet med högst kcat som vinner. (1p) b) Enzym C (1p) är snabbast vid 0.1 mM laktos. När substratkoncentrationen är låg i förhållande till Km så är det enzymet med högst kcat/Km som vinner. Lägre kcat hos enzym C kompenseras av lägre Km så att kcat/Km blir högre än för de andra enzymerna (104 M-1*s-1 för C, 103 M-1*s-1 för A och B). Det hjälper inte att A och B har högre kcat eftersom så få enzymmolekyler binder substrat vid 0.1 mM. kcat/Km används här för att avgöra enzymets effektivitet. (1p) c) Enzym C (1p) är snabbast av enzymerna på cellobios vid 0.1 mM koncentration. Laktos hydrolyseras snabbare än cellobios (1p), trots att enzymet har lägre kcat för laktos. Återigen är det kcat/Km som avgör. Kvoten är högre för laktos än cellobios (1*104 respektive 2*103 M-1*s-1). kcat/Km används här för att avgöra enzymets specificitet. 7. Enzymkatalys a) Att enzymer är så effektiva katalysatorer beror främst på att de är utformade för att binda reagerande ämnen på ett speciellt sätt. Aktiva ytan är formad för att åstadkomma två viktiga effekter som snabbar upp kemiska reaktioner. Vilka är dessa effekter? (2p) Varför gör de att reaktionen går fortare? (2p) b) Serinproteaser som trypsin, chymotrypsin, och elastas har likartade aktiva ytor och använder samma mekanism för att klyva polypeptidkedjor. Vilka tre sidokedjor förekommer alltid hos serinproteaser? (1p) Reaktiva grupper i aktiva ytan hos enzymer kan delta direkt i kemisk reaktion med substratet vilket kallas kemisk katalys. Nämn de två typer av kemisk katalys man brukar urskilja (2p), vad de innibär (2p) och ge för varje ett exempel från serinproteaser dvs. vilken grupp som är involverad och hur. (2p) (11 p) Svarsmall: a) Närhetseffekten (1p) gör att reaktiva grupper kommer nära varandra, och i rätt orientering, vilket ökar sannolikheten för reaktion (1p). Stabilisering av övergångstillståndet ("transition state") (1p) minskar aktiveringsenergin (1p). b) Alla serinproteaser har en s.k. katalytisk triad bestående av Asp - His - Ser (1p). Syra-bas-katalys (1p) innebär att protoner ges till eller tas från substratet (1p). Hos serinproteaser tar His upp en proton från serin så att den blir en negativt laddad nukleofil (1p). Kovalent katalys (1p) innebär att en reaktiv grupp på enzymet reagerar direkt med substratet och bildar en kovalent binding till en del av eller hela substratet (1p), ett s.k. kovalent reaktionsintermediat där en del av eller hela substratet sedan överförs till ett annat substrat. Hos serinproteaser attackerar den aktiverade serinen karbonylkolet i peptidbindingen som skall klyvas och bildar ett tetraediskt intermediat (1p). 8. Enzymatiska processer är reglerade för att de ska ske vid rätt tid och på rätt plats. Regleringen sker i allmänhet genom att på olika sätt påverka aktiviteten för enzym som katalyserar metaboliskt irreversibla steg. Ibland regleras ett enzym av en produkt längre fram i en metabolisk reaktionskedja (feedback); ibland kan produkten av ett tidigare steg fungera som regulator (feed forward). Förutom att det reglerande ämnet kan fungera som en kompetitiv inhibitor finns också andra sätt att påverka ett enzyms aktivitet. Namnge (3p) och beskriv kortfattat (3p) tre sådana mekanismer för att reglera ett enzym. (6 p) Svarsmall: Alloster reglering. (1p) Den reglerande molekylen binder på särskild regulatorisk plats i enzymet och påverkar aktiviteten genom konformationsförändringar i aktiva ytan. Oftast oligomera proteiner. (1p) Fosforylering. (1p) Genom att sätta på (kinaser) och plocka bort (fosfataser) fosfatgrupper kan enzymets aktivitet påverkas. (1p) Proteolytisk aktivering. (1p) En propeptid klyvs bort för aktivera enzymet. Irreversibel. (1p) 9. Som idrottsman/kvinna har du fått rådet att öka din konsumtion av a) karnitin b) kreatinfosfat och c) coenzym Q10 (ubiquinone). Förklara vilken roll dessa substanser har i den intermediära metabolismen (3p) samt vilka fysiologiska effekter som du eventuellt kan förvänta dej efter konsumtion av dessa ämnen (3p). (6 p) Svarsmall: a) Karnitin är den substans som möjliggör transport av fettsyror från cytosolen till mitokondrierna (1p). En ökad transport skulle medföra en ökad fettförbränning (ökad muskeluthållighet) (1p). b) Kreatinfosfat: används av musklerna för att tillgodose energibehovet (behovet av ATP) vid kraftig ansträngning (exempelvis sprinterlopp) genom reaktionen: ADP + kreatinfosfat ® ATP + kreatin. (1p) Detta kan medföra att den lagrade energin i form av kreatinfosfat kan utnyttjas vid ex.vis sprinterlopp, snabbare (1p). c) Q10: Detta coenzym återfinns i cellernas membran speciellt mycket återfinns i mitokondriens innermembran. Där transporterar Q10 elektroner mellan enzymkomplex i andningskedjan (1p). Förutom att bidra till en högre utnyttjandegrad av näringssubstrat fungerar Q10 även som antioxidant (1p). 10. Du har fått arbete på ett biokemiskt utvecklingsföretag som arbetar med att ta fram sk. bioaktiva fodersubstanser. En av de ”hetaste” substanserna för tillfället utgörs av det anticarcinogena ämnet genistein (återfinns i bl.a. Soja) vilket inhiberar tyrosinkinas. Men misstanke finns att genistein även inhiberar andningskedjan. Din uppgift blir att ta reda på, om och var, denna substans inhiberar andningskedjan. Beskriv kortfattat hur du går tillväga. Till ditt förfogande har du den utrustning som ni använt under era laborationer i biokemi. (7 p) Svarsmall: Utrustning: syrgaselektrod med förstärkare och skrivare. (1p) Mitokondrier, tre olika substrat som lämnar sina elektroner vid de tre olika komplexen (Glutamat, succinat, ask/TMPD) samt ADP (eller ATP + glukos + hexokinas) och syremättad buffert. (2p) Utförande: Till glaskärlet tillsätts buffert, mitokondrier, substrat (glutamat) ADP. Syreförbrukningen registreras. Tillsätt genistein, registrera syrgasförbrukningen. Om syreförbrukningen avtar inhiberar genistein andingskedjan. (2p) Men var? Tillsätt ett substrat som lämnar sina elektroner vid complex 2 (succinat). Upprepa med askorbat/tmpd för även det sista komplexet. (2p) 11. Aspartataminotransferase har den högsta enzymaktiviteten av alla transaminaser i levern hos människa och däggdjur. Förklara varför? (2 p) Svarsmall: I ureacykeln överförs den andra aminogruppen från aspartat som genereras genom att glutamat transamineras till oxalacetat, en reaktion som katalyseras av aspartataminotransaminas. Detta medför att ca 50% av alla aminogrupper som utsöndras som urea måste passera igenom aspartataminotransferas-reaktionen. (2p) 12. Vid ett sprinterlopp (100 m) åtgår ca 1 liter syre under loppet (ca 20 gånger mer än i vila). Efter loppet fortsätter löparen att ha en förhöjd andningsfrekvens och förbrukar ytterligare ca 4 liter syre. a) Varför ökar syrebehovet så drastiskt under loppet? (1p) b) Varför kvarstår ett syrgasbehov efter att loppet har avslutats? (3p) (4 p) Svarsmall: a) Ökad muskelaktivitet ökar ATP-andvändnigen vilket resulterar i en ökad syrekonsumtion. (1p) b) Vid ett sprinterlopp ökar mjölksyrakoncentrationen i musklerna. Mjölksyran transporteras till levern där den konverteras tillbaka till glukos ( via glukoneogenes) och vidare transport tillbaka till muskeln(Cori cykeln). Denna process kräver ATP (6st per glukosmolekyl) vilket medför en förhöjd syrekonsumtion även efter loppet. (3p) 13. De flesta djur lägger upp ett reservföråd av energi i form av fett. Hur mycket mer energi i form av ATP-ekvivalenter erhålls då en mol steraninsyra (C18:0) oxideras jämfört med en mol glukos. OBS! Endast den energi som erhålls i citronsyracykeln och via oxidativ fosforylering skall redovisas (inga tidigare steg). I citronsyracykeln genereras 3 NADH, 1 FADH2 och en GTP per varv. (4 p) Svarsmall: Vid förbränning av 1 mol glukos erhålls 2 mol acetyl CoA Vid förbränning av sterarinsyra erhålls 9 mol acetyl CoA 3 NADH= 3x2.5= 7.5 ATP 1 FADH2= 1x1.5 =1.5 ATP 1 GTP =1x1= 1 ATP Summa :10 ATP per acetyl CoA 1 mol Glukos = 20 ATP 1 mol stearinsyra = 90 ATP Dvs.4.5 gånger mer energi erhålls (4 p) 14. Merparten av allt lagrat glykogen återfinns i skelettmuskeln. Trots detta används inte muskelgykogen till att balansera blodglukosnivån. Vad används istället (1p)och varför utnyttjas inte muskelgykogen (2p)? (3 p) Svarsmall: I muskeln saknas enzymet glukos6-fosfatas (1p) vilket medför att glukosgruppen inte kan spjälkas bort och därmed exportera ut glukos ut ur cellen (1p). I levern däremot finns ovanstående enzym och därmed regleras blodglukosnivån huvudsakligen genom att leverglykogen (1p) bryts ned till glukos som transporteras ut i blodet. 15. Du har ombetts att inkomma med en ansökan till en tjänst som biokemist till ett av EU:s kontor i Bryssel I ansökan ombeds Ni att kortfattat beskriva, i ord och bild de huvudsakliga metaboliska vägarna som är involverade när stora mängder av kolhydrater från födan omhändertas i levern. Endast de viktigaste stegen skall anges. OBS! Max. 1 sida. (Om mer utrymme används läses ej ansökan, eventuellt bara första sidan som då ger en ofullständig beskrivning. Därför erhålls poäng endast på första sidan). (10 p) Svarsmall: Kolhydrater från födan bryts ned till enklare sockermolekyler i tarmen där de absorberas och transporteras via portalvenen till levern. Merparten av allt glukos transporteras vidare ut till de perifera organen. Överskott på glukos leder till glykogenupplagring Levern utnyttjar glukos som energi där det oxideras i glykolysen, Citronsyracykel och ATP utvinns vid den Oxidativ fosforyleringen. Överskott av kolhydrater medför att fettsyror syntetiseras för dessa reduktiva processer behövs även NADPH som erhålls från pentosfosfat shunten och när citrat transporteras ut från mitokondrien och därefter bildar oxalacetat och acetyl-CoA .(malat enzymet, malat- pyruvat) Glukos Glykogen Glukos 6-p Ribos 5-p NADPH ePyruvat Acetyl-CoA Oxalacetat Acetyl-CoA Citrat Oxalacetat e- Citrat ee- ADP Ox. fosforylering ATP Fettsyror 16. Fotosyntes. I varje delfråga nedan är endast ett svarsalternativ korrekt. Ange vilket. (Varje rätt svar ger 1p. Fler än ett alternativ ger 0p.) A. Ljusreaktionen förser Calvin-cykeln med: (1p) a. ljusenergi b. CO2 och ATP c. H2 O och NADPH d. ATP och NADPH e. socker och O2 B. Vilken av följande sekvenser visar det korrekta elektronflödet under fotosyntesen? a. NADPH ® O2 ® CO2 b. H2 O ® NADPH ® Calvin-cykeln c. NADPH ® klorofyll ® Calvin-cykeln d. H2 O ® fotosystem I ® fotosystem II e. NADPH ® eletrontransportkedjan ® O2 C. Samarbete mellan två fotosystem i kloroplasten är nödvändigt för: a. ATP syntes b. reduktion av NADP+ c. cyklisk fotofosforylering d. oxidation av reaktionscentret i fotosystem I e. bildning av proton-gradient D. Mekanistiskt sett liknar fotofosforyleringen mest: a. fosforylering på substrat-nivå i glykolysen b. oxidativ fosforylering i cellandningen c. Calvin-cykeln d. kolfixering e. reduktion av NADP+ E. På vilket sett liknar de anpassningar av fotosyntesen som sker i C4 växter och CAM växter varandra? a. I båda fallen är klyvöppningarna öppna under dagen. b. Båda typer av växter syntetiserar socker utan Calvin-cykeln. c. I båda fallen används ett annat enzym än Rubisco för att katalysera första steget i kolfixeringen. d. Båda typer av växter syntetiserar huvuddelen av sitt socker i mörker. e. Varken C4 växter eller CAM växter har grana lameller (stackade membran) i kloroplasterna. F. Vilken av följande processer drivs mest direkt av ljusenergi? a. bildning av en pH-gradient genom att protoner pumpas över tylakoid-membranet b. kol-fixering i stroma c. reduktion av NADP+ d. exitering av elektroner i membranbundna klorofyllmolekyler e. ATP-syntes G. Vilket av följande påståenden skiljer korrekt mellan cyklisk och icke cyklisk fotofosforylering? a. Endast icke-cyklisk fotofosforylering producerar ATP. b. Förutom ATP, producerar icke-cyklisk fotofosforylering även O2 och NADPH. c. Endast icke-cyklisk fotofosforylering använder ljus av våglängd 700 nm. d. Kemiosmos sker endast vid icke-cyklisk fotofosforylering. e. Endast icke-cyklisk fotofosforylering kan arbeta utan fotosystem II. H. Vilket av följande påståenden skiljer korrekt mellan autotrofer och heterotrofer? a. Endast heterotrofer behöver kemiska föreningar från omgivningen. b. Cellandning sker endast i heterotrofer. c. Endast heterotrofer har mitokondrier. d. Endast autotrofer, men inte heterotrofer, kan livnära sej på oorganiska föreningar, som t.ex. CO2. e. Endast heterotrofer behöver syre för att leva. I. Vilken av följande processer kan fortfarande ske i kloroplasten i närvaro av en inhibitor som hindrar H+ från att passera genom ATP syntaset? a. socker-syntes b. bildning av proton-gradient c. fotofosforylering d. Calvin-cykeln e. oxidering av NADPH (9 p) Svarsmall: A. d B. b C. b D. b E. c F. d G. b - OBS! I tidigare svarsmall (som studenterna använde) var e) angivet som rätt alternativ H. d I. b 17. DNA a) Beskriv replikeringen av den ledande (leading strand) och eftersläpande (lagging strand) strängen av DNA i en bakterie som E. coli. Vilka enzym deltar (6p) b) Vad är ett operon (1p) och vilken fördel har arrangemanget (1p)? c) I bakterier (E. coli) sker initieringen av proteinsyntesen (translationen) vid start kodonet (AUG). AUG kodonet förekommer även inuti den proteinkodande sekvensen i mRNAt. Hur ”vet” ribosomen vilket som är det rätta start kodonet dvs var translationen skall börja? Begreppet Shine-Dalgarno sekvens skall ingå i svaret (2p). (10 p) Svarsmall: a) Den ledande strängen replikeras kontinuerligt (0.5p) och den eftersläpande strängen diskontinuerligt (0.5p) av DNA-polymeras III (1p). Primas (0.5p) tillverkar korta RNA-primers (0.5p). Luckorna i lagging strand fylls i (0.5p) av DNA-polymeras I (0.5p) och RNA-primer avlägsnas (0.5p). DNA-ligas sätter ihop bitarna (0.5p). Helikas (0.5p) behövs för att bryta vätebindingarna mellan DNA-strängarna (0.5p). (Dessutom behövs proteiner som binder till enkelsträngat DNA för att stabilisera detta, och topoisomeraser (t.ex. gyras) för att lösa upp spänningar i dubbelhelixen). b) I ett operon ligger generna för flera proteiner i en följd efter en promotor som kontrollerar dessa geners transkription (1p) oftast gener som behövs för en gememsan uppgift, t.ex. syntes eller nedbrytning av ett ämne. Genom att de kontrolleras av en och samma promotor räcker det med en signal för att slå av eller på hela operonet (1p). c) Ribosomen, den lilla subenheten, basparar med en sekvens i mRNAt (ShineDalgarno) strax uppströms om start kodonet (1p). Det är en komplemäntär sekvens i ett av ribosomens RNA som binder in till S.D (1p). Detta medför att ribosomen lokaliseras till det rätta start kodonet. 18. DNA-lab a) Du har fått en transformationsfrekvens på 2*10-6 . Om du har 12 miljoner bakterier, hur många har då tagit upp en plasmid? (1p) b) Du är doktorand på SLU. Du är dessutom intresserad av ett protein som uttrycks av genen G. Det visar sig att en grupp i Finland jobbar med detta protein, och du bestämmer dig för att inleda ett samarbete. De skickar dig en plasmid som har genen insatt enligt skissen nedan. I skissen är EcoR1, BamIII, Sac1, HindIII, Asp718 och Xho1 namn på restriktionsenzym som klipper plasmiden specifikt på markerade ställen. Du känner dig dock lite osäker på om du kan lita på ett bastubadande folkslag... Genen som uttrycker ditt protein heter genen G. Genen G är 2000 baspar stor, och plasmiden totalt 5000 baspar. Beskriv i stora drag hur du går tillväga för att kolla att det är rätt storlek på plasmid och gen du har fått. (De har skickat en för liten mängd plasmid för att du direkt ska se något på en agarosegel).(4 p) (5 p) EcoR1 BamIII Sac I Genen G HindIII Asp718 Ampicillinresistens Xho 1 Svarsmall: a) Om transformationsfrekvensen är 2*10-6 betyder det att av 1 miljon bakterier har 2 tagit upp en plasmid. Har du 12 miljoner bakterier kommer alltså 24 stycken att ha en plasmid i sig, rent statistiskt. (1p) b) Eftersom du inte har tillräckligt många plasmider måste du amplifiera antalet. Börja med att transformera in plasmiden i en bakterie (0.5 poäng). Sprid ut dem på plattor med ampicillin för att selektera fram bakterier med plasmid (0.5 poäng). För att få många kopior av bakterien med plasmid, sätt en övernattskultur (0.5 poäng). Rena fram plasmiden från övernattskulturen (0.5 poäng). Klipp plasmiden (0.5 poäng) med restriktionsenzymen Sac1 och HindIII (0.5 poäng) för att klippa ut genen G. Kör fragmenten på en agarosegel (0.5 poäng) och räkna ut storleken med hjälp av markör av känd storlek (0.5 poäng).