Delprov ”Dugga” med svarsmallar Biokemi BI0968, 8:e dec 2008, 0915 - 1200.
Max poäng = 50 p. Preliminära betygsgränser: 3 = 27p; 4 = 35p; 5 = 43p.
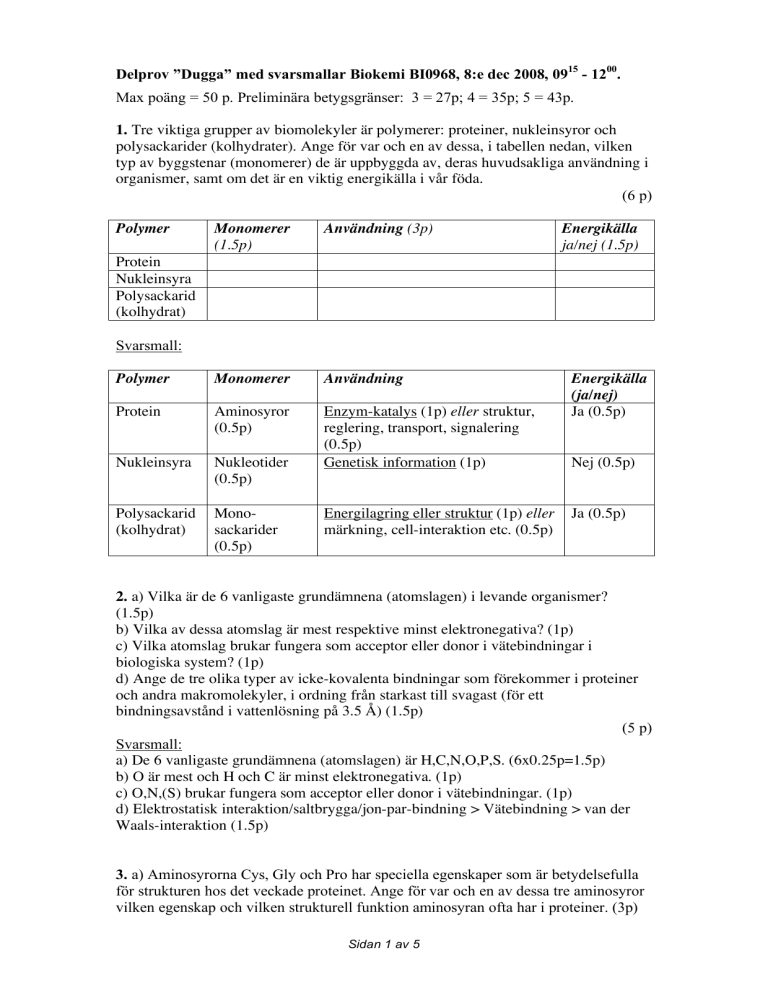
1. Tre viktiga grupper av biomolekyler är polymerer: proteiner, nukleinsyror och
polysackarider (kolhydrater). Ange för var och en av dessa, i tabellen nedan, vilken
typ av byggstenar (monomerer) de är uppbyggda av, deras huvudsakliga användning i
organismer, samt om det är en viktig energikälla i vår föda.
(6 p)
Polymer
Monomerer
(1.5p)
Användning (3p)
Polymer
Monomerer
Användning
Protein
Aminosyror
(0.5p)
Nukleinsyra
Nukleotider
(0.5p)
Enzym-katalys (1p) eller struktur,
reglering, transport, signalering
(0.5p)
Genetisk information (1p)
Polysackarid
(kolhydrat)
Monosackarider
(0.5p)
Energikälla
ja/nej (1.5p)
Protein
Nukleinsyra
Polysackarid
(kolhydrat)
Svarsmall:
Energilagring eller struktur (1p) eller
märkning, cell-interaktion etc. (0.5p)
Energikälla
(ja/nej)
Ja (0.5p)
Nej (0.5p)
Ja (0.5p)
2. a) Vilka är de 6 vanligaste grundämnena (atomslagen) i levande organismer?
(1.5p)
b) Vilka av dessa atomslag är mest respektive minst elektronegativa? (1p)
c) Vilka atomslag brukar fungera som acceptor eller donor i vätebindningar i
biologiska system? (1p)
d) Ange de tre olika typer av icke-kovalenta bindningar som förekommer i proteiner
och andra makromolekyler, i ordning från starkast till svagast (för ett
bindningsavstånd i vattenlösning på 3.5 Å) (1.5p)
(5 p)
Svarsmall:
a) De 6 vanligaste grundämnena (atomslagen) är H,C,N,O,P,S. (6x0.25p=1.5p)
b) O är mest och H och C är minst elektronegativa. (1p)
c) O,N,(S) brukar fungera som acceptor eller donor i vätebindningar. (1p)
d) Elektrostatisk interaktion/saltbrygga/jon-par-bindning > Vätebindning > van der
Waals-interaktion (1.5p)
3. a) Aminosyrorna Cys, Gly och Pro har speciella egenskaper som är betydelsefulla
för strukturen hos det veckade proteinet. Ange för var och en av dessa tre aminosyror
vilken egenskap och vilken strukturell funktion aminosyran ofta har i proteiner. (3p)
Sidan 1 av 5
b) I många enzymer hittar man i aktiva ytan histidin med viktig katalytisk funktion.
Vilka egenskaper hos histidin gör den lämplig att delta i enzymatiska reaktioner? (1p)
c) Proteiners struktur kan beskrivas i fyra nivåer, primär, sekundär, tertiär och
kvartenär. Förklara vad som avses med respektive begrepp. (4p)
(8p)
Svarsmall:
a) Cystein (Cys) kan para ihop sig och bilda disulfidbryggor (0.5p) som binder ihop
olika delar av polypeptidkedjan och stabiliserar proteinets tertiär-struktur (0.5p).
Glycin (Gly) har ingen egentlig sidokedja utan bara väte på alfa-kolet vilket ger större
vridbarhet runt alfa-kolet (phi och psi-vinklarna) (0.5p). Gly sitter ofta där det är
trångt (där större sidokedja inte får plats) eller där det behövs en kraftig böj i
huvudkedjan (0.5p).
Prolin (Pro) har en sidokedja som är kovalent bunden till peptidkvävet så att den
bildar en ringstruktur där phi-vinkeln är fixerad och inte kan rotera (0.5p). Detta ger
minskad flexibilitet och stabilisering av huvudkedjan. Prolin passar inte i alfa-helix
och hindrar dess bildning. Pro kan fungera som "helix-brytare" i änden av en helix
och förekommer ofta i böjar tillsammans med Gly (0.5p).
b) Histidin har pKa-värde omkring 6-7 och den kan gärna uppta/avge proton vid
fysiologiskt pH och delta i syra/bas-katalys (1p).
c) Primärstruktur är aminosyrasekvensen (1p). Sekundärstruktur bildas när avsnitt av
polypeptidkedjan veckar ihop sig med regelbundna vätebindingar i sekundärstrukturelementen alfa-helix, beta-sträng, beta-böj (1p). Tertiärstruktur beskriver hela
polypeptidkedjans veckning, hur sekundärstruktur-element och sidokedjor är packade
(1p). Kvartenärstruktur beskriver hur olika subenheter sitter ihop i ett oligomert
protein/proteinkomplex (1p).
4. Proteinrening
a) När man isolerar proteiner är jonbyteskromatografi en ofta använd metod. Vilka
principer bygger metoden på? (1p)
b) Proteinet Y har visat sig binda till en jonbytare med liganden DEAE (positvt laddad
ligand) vid pH 6.8. Vad säger det om Y:s isoelektrisk punkt? (1p)
c) Du har bestämt molekylvikten på Y med hjälp av gelfiltrering och funnit att den är
280.000 Dalton. Du misstänker dock att Y består av mer än en subenhet. Föreslå ett
relativt enkelt sätt att reda ut detta. (1 p)
(3 p)
Svarsmall:
a) I jonbyteskromatografi utnyttjar man förmågan hos laddade molekyler, i detta fall
proteiner, att binda reversibelt till immobiliserade laddade grupper. Beroende på
proteinets laddning vilket i sin tur beror av pH väljer man positivt eller negativt
laddade ligander. (1 p)
b) Y binder till en positiv ligand och bör sålunda ha en negativ nettoladdning vid det
aktuella pH:t . Isoelektriska punkten kan därför antas vara under (eller lika med) pH
6.8. (1 p)
c) Prova att köra en SDS-Polyakrylamidgelelektrofores (SDS-PAGE). Den bör ge
information om molekylvikt(er) på eventuella subenheter. (1 p)
5. a) Definiera och beskriv kortfattat de tre stegen i molekylärbiologins "centrala
dogma", flödet av den genetiska informationen. (3p)
Sidan 2 av 5
b) Varför kan man förutsäga ett proteins aminosyrasekvens om man känner genens
nukleotidsekvens, men ej bestämma en gens nukleotidsekvens om man känner
proteinets aminosyrasekvens? (2p)
(5 p)
Svarsmall:
a) DNA -> DNA = replikering (0.5p). DNA kopieras genom att varje kedja bildar
mall för komplementär kopiering (0.5p).
DNA -> RNA = transkription (0.5p). Vissa delar av DNA kopieras till RNA. En kedja
i DNA är mall för komplementär kopiering (0.5p).
RNA -> protein = translation (0.5p). mRNA används som mall för syntesen av protein
på ribosomen (0.5p). För varje aminosyra som inkorporeras i proteinet passas tre
baser i mRNA (kodonet) ihop med antikodonet på den tRNA-molekylen som för in
aminosyran till peptidsyntesen.
b) Varje kodon i gensekvensen svarar mot en enda aminosyra (1p), därför kan vi
förutsäga proteinets sekvens från gensekvensen. Däremot så finns det mer än ett
kodon för de flesta aminosyrorna (1p), dvs. flera alternativa sekvenser är möjliga.
6. Förklara kortfattat följande begrepp:
a) Intron (1p)
b) Restriktionsenzym (1p)
c) cDNA (1p)
(3 p)
Svarsmall:
a) Intron: Bitar av eukaryota gener som inte översätts till protein (1p) utan klyvs bort
under processning av RNA till mRNA, som sedan används som mall för
proteinsyntes.
b) Restriktionsenzymer känner igen sekvenser i dubbelsträngat DNA, och klyver båda
strängarna på ett specifikt ställe i den igenkända sekvensen. (1p)
c) cDNA: 'complementary DNA', "omvänd" DNA-kopia av ett mRNA som görs med
hjälp av enzymet omvänt transkriptas ('reverse transcriptase'). (1p)
7. Enzymet E som följer Michaelis-Menten-kinetik har Km = 40 µM (mikromolar).
Initiala reaktionshastigheten v0 är 10 µM/min (mikromolar/minut) vid en
substratkoncentration på 20 mM (millimolar) och enzymkoncentrationen [E]tot 2 nM
(nanomolar).
Vad blir den initiala hastigheten v0
a) om vi dubblar substratkoncentrationen vid samma enzymkoncentration, [S] = 40
mM (millimolar)? (1p)
b) om substratkoncentrationen [S] är 40 µM (mikromolar) vid samma
enzymkoncentration? (1p)
c) om substratkoncentrationen [S] är 10 µM (mikromolar) vid samma
enzymkoncentration? (1p)
d) om vi istället dubblar enzymkoncentrationen vid samma substratkoncentration,
([S] = 20 mM, [E]tot = 4 nM)? (1p)
e) Hur påverkar enzymets Km respektive kcat förhållandet mellan koncentrationerna av
substrat och produkt vid jämvikt? (1p)
(5p)
Sidan 3 av 5
Svarsmall:
När [S] = 20 mM gäller [S] >> Km (substratkonc är mycket större än Km),
och alltså är v0 = Vmax = 10 µM/min
a) v0 = 10 µM/min (0.5p). För varje substratkoncentration större än 20 mM gäller
fortfarande att v0 = Vmax = 10 µM/min.
b) v0 = 5 µM/min (0.5p). När [S] = Km gäller att v0 = Vmax/2 , eller 5 µM/min.
c) v0 = 2 µM/min (0.5p). Eftersom Km och Vmax är kända, kan Michaelis-Menten
ekvationen användas för att beräkna v0 vid varje substratkoncentration:
v0 = Vmax [S] / ( Km + [S] ). För [S] = 10 µM gäller:
v0 = (10 µM/min) (10 µM) / (40 µM + 10 µM) = 100/50 µM/min = 2 µM/min.
d) v0 = 20 µM/min (0.5p). Hastigheten är proportionell mot enzymkoncentrationen.
Dubbelt så hög enzymkoncentration ger dubbel hastighet.
e) Inte alls (1p). Förhållandet mellan koncentrationerna av substrat och produkt vid
jämvikt bestäms av den termodynamiska skillnaden i fri energi mellan substrat och
produkt, medan Km och kcat är uttryck för förhållanden mellan hastighetskonstanter.
8. Enzymatiska processer är reglerade för att de ska ske vid rätt tid och på rätt plats.
Genom kontroll av genuttryck, dvs hur ofta en gen läses, bestäms hur många
molekyler som ska bildas av ett visst enzym. Dessutom kan aktiviteten hos enskilda
enzymmolekyler regleras med olika mekanismer. De tre viktigaste är:
a) Allosterisk reglering; b) Protein-fosforylering; c) Proteolytisk aktivering.
Beskriv kortfattat hur de fungerar och ange för var och en om den är reversibel eller
irreversibel (1.5p för varje korrekt svar).
d) Vilka steg i en metabolisk väg brukar vara reglerade? (0.5p)
(5 p)
Svar: a) Allosterisk reglering. Den reglerande molekylen binder på särskild
regulatorisk plats i enzymet och påverkar aktiviteten genom konformationsförändringar i aktiva ytan (1p). Oftast oligomera proteiner. Reversibel (0.5p).
b) Fosforylering. Genom att sätta på (kinaser) och plocka bort (fosfataser)
fosfatgrupper kan enzymets aktivitet påverkas (1p). Reversibel (0.5p).
c) Proteolytisk aktivering. Enzymet syntetiseras som ett inaktivt proenzym (zymogen)
och blir aktivt först när en del av peptidkedjan hydrolyserats/klyvts av ett
proteas/peptidas (1p). Irreversibel (0.5p).
d) Metaboliskt irreversibla steg brukar regleras, dvs reaktioner som frigör mycket
energi. (0.5p)
9. Utan biologiska membran skulle inget liv kunna existera.
a) Rita den kemiska strukturformeln för en membranlipid. (2.5p)
b) Beskriv med en enkel skiss uppbyggnaden av ett biologiskt membran. (1p)
c) Vad kallas den drivande kraften som gör att membraner hålls ihop (och som gör att
proteiner veckar sig) (0.5p)? Hur fungerar den (1p)?
(5 p)
Svarsmall:
a) Lipidfigur: Glycerol (0.5p) med
esterbindningar (0.5p) till fettsyror (R1, R2) på
två hydroxyler (0.5p) och fosfat på den tredje
(0.5p) som i sin tur har en polär grupp bunden
(etanolamin, serin, kolin) (0.5p).
Sidan 4 av 5
b) Membranfigur: Dubbellager, hydrofila
huvuden utåt, hydrofoba svansar inåt (1p).
c) Hydrofoba effekten (0.5p). Hydrofoba delar av
t.ex. lipider eller proteiner klumpar
ihop sig med varandra för att undgå kontakt med
vatten (1p).
10. Kanaler, pumpar, lipider, membraner, signalöverföring:
a) Vad är skillnaden mellan aktiv och passiv transport av små molekyler genom lipidmembraner? (1p)
b) Ge två exempel på hur ett lösligt protein kan associera till lipidmembraner. (1p)
c) Vid hormonell kontroll och i många sinnesceller sker signalöverföring med 7TMreceptorer, G-proteiner och adenylatcyklas. Rita schematiskt hur proteinerna är
organiserade vid cellmembranet, och beskriv kortfattat hur en signal produceras av
receptor, trimert G-protein och adenylatcyklas? Hur sker signalförstärkningen i denna
kedja? Vad kallas den typen av signalförstärkning? (3p)
(5 p)
Svarsmall:
a) Aktiv transport sker över/genom ett membran mot en koncentrationsgradient
(koncentrationen m.a.p. den typ av molekyl som skall transporteras) och kräver energi
(0.5p). Passiv transport sker med en koncentrationsgradient, dvs
koncentrationsutjämnande, och utnyttjar den lagrade energin i gradienten (0.5p).
b) Exempel på mekanismer för association av protein till membran: GPI-ankare (Cterminal), palmitoylering (på cystein), farnesylering (på cystein), myrostylering (Cterminal), association till annat redan membranbundet protein (0.5p per exempel, max
1p)
c) Korrekt skiss med 7TM-receptor
integrerad i membranet, med G-protein
bunden på insidan bestående av alfa,
beta, gamma-subenheter, och
adenylatcyklas integralt i membranet
(0.5p). Aktivering av en receptor, t.ex.
genom binding av epinefrin (adrenalin)
leder till en förändring på insidan av
membranet som aktiverar G-proteinet
(0.5p). Den aktiverade receptorn
fungerar som en G-nukleotidutbytare
vilket medför att G-proteiner byter ut
GDP mot GTP (0.5p) när alfasubenheten dissocieras från betagamma-subenheterna och kan röra sig
längs membranet. Den aktiva alfasubenheten med GTP kan genom att binda till adenylatcyklas göra detta enzym aktivt
varvid cAMP bildas (0.5p). Ökad mängd cAMP sätter igång flera olika processer i
cellen, t.ex. aktiverar proteinkinas A.
Vid varje steg kan flera molekyler aktiveras vilket åstadkommer en förstärkning.
Varje receptor aktiverar flera G-proteiner, varje G-protein aktiverar flera
adenylatcyklaser osv. (0.5p). Det kallas kaskadeffekt (0.5p).
Sidan 5 av 5