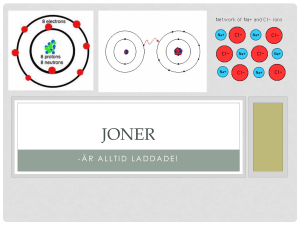
JONER
Joner är partiklar med elektrisk laddning. Både ensamma atomer och molekyler
kan bilda joner.
Från era studier i atomens uppbyggnad vet ni att atomen består av i huvudsak
tre partiklar. Protonen, neutronen och elektronen.
Det finns lika många protoner i kärnan som det finns elektroner runt kärnan.
Lika många plus som minus och atomen är oladdad.
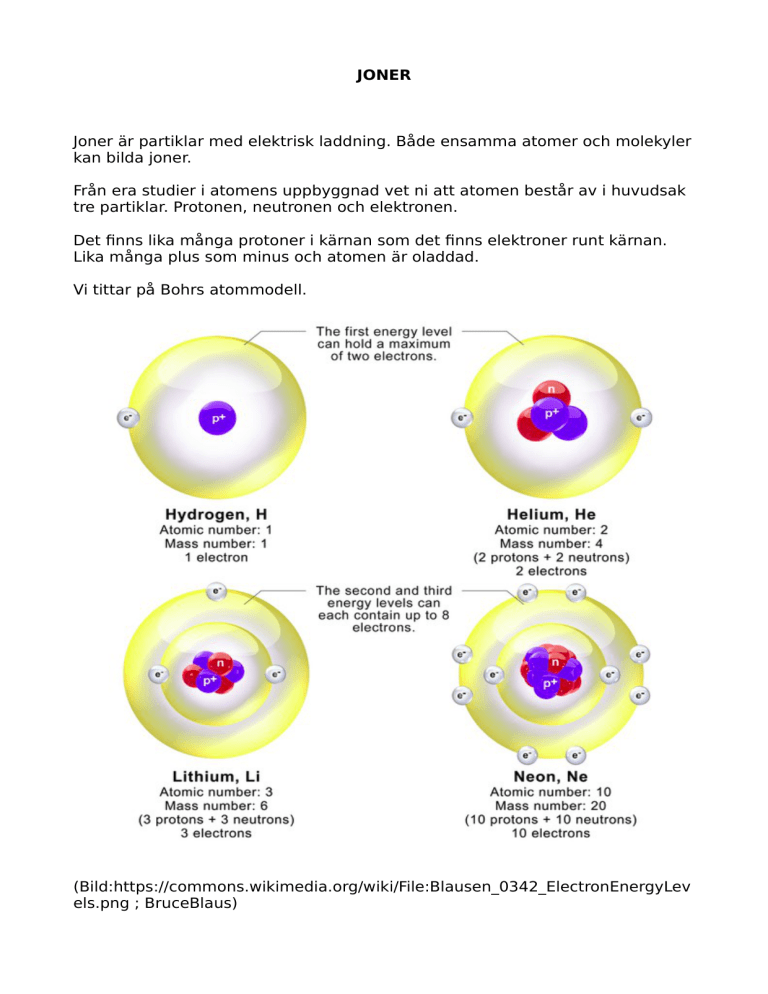
Vi tittar på Bohrs atommodell.
(Bild:https://commons.wikimedia.org/wiki/File:Blausen_0342_ElectronEnergyLev
els.png ; BruceBlaus)
Vi tittar på Ne (neon). Enligt Bohr består atomen av en kärna med elektroner
som surrar runt kärnan i flera skal. Skalen kan innehålla olika många elektroner.
Skal 1, 2 st; skal 2, 8 st. Om elektronskalen ser ut som i Ne-fallet är alla skalen
fulla och atomen har fått ädelgasstruktur. Då är den inte benägen att reagera
med andra atomer. Helium är inget undantag. Helium, atomnummer 2, har två
protoner, därför tar den upp 2 elektroner. Första skalet kan bara hålla två
elektroner, alltså blir He en ädelgas.
Litium bredvid har tre e-. Då får det plats 7 st till i skal två. Litium reagerar
gärna med vissa ämnen.
Om en atom tar upp eller avger elektroner så blir atomen laddad. Då kallas den
för jon.
Joner att bildas så att de får s.k. ädelgasstruktur. Exempelvis har natrium en
valenselektron i sitt yttersta elektronskal, så den påträffas oftast i joniserad
form med en felande elektron: Na+. På andra sidan periodiska systemet har
klor sju valenselektroner, därför har klor i joniserad form en extra elektron: Cl-.
Lägg märke till hur man betecknar joner, natronjonen (jon av natrium) Na+.
Titta nu i periodiska systemet och skriv ned jonerna för:
O, Ca, Cl, K, Mg, F, N, Li, H, Fe, Ne, Kr, Xe.
För att göra detta tittar du på hur många elektroner atomen har i yttersta
skalet och sedan lägger du till eller tar bort elektroner så att atomen får
ädelgasstruktur.
Joner behöver inte bestå av bara en atom. De kan vara en hel molekyl som är
laddad.
Till exempel NaOH, natriumhydroxid, alias kaustisk soda, som består av Na+
och OH-. Min vän råkade blanda kaustisk soda i gröten i stället för vanligt salt.
Det smakar obeskrivligt illa. Denna mängden var väldigt liten så ingen skada
var skedd, MEN prova ALDRIG. NaOH är giftigt och frätande.
OH-. Hydroxid-jonen är en väte och en syre som tillsammans har en e- för
mycket.
Som vi vet attraheras olika laddingar till varandra. Så även joner. Om vi tar
metallerna till vänster i periodiska systemet, de sk. Alkalimetallerna och för
dem samman med Halogenerna, F, Cl, Br, I, At, så bildar de föreningar, salter
med dem.
Ett av dessa NaCL använder vi för att salta maten.
(Bild: Ingvald Straume;
https://commons.wikimedia.org/wiki/File:Natriumkloridionegittermodell.png).
Det består av natronjoner och klorid joner. Jonbindningen är mycket stark. NaCl
smälter vi 801C.
Salter är mycket användbara inom medicinen och industrin.
Thermocouples (vad nu det heter på svenska) är ett rör med två eltrådar i.
Röret är även fyllt med något salt. Värmer man röret blir saltet till slut flytande
och de två trådarna får kontakt. Detta kan man använda som brandvarnare i
varma miljöer som turbinmotorer.
Uranheafluorid, ”hex” är ett extremt giftigt och reaktivt salt.
Grönt är fluor och blått uran. Det används vid anrikning av uran som sedan
behövs till vapen, och kraftverk.
Det reagerar kraftigt med vatten och bildar fluorvätesyra samt korroderar de
flesta metaller. Det är snällt mot aluminium, varför man transporterar det i
aluminiumbehållare.
I våran stad Västerås kan vi se lastbilar med ”hex” på vägarna ibland. De
transporterar detta till Westinghouse.
Labbar:
Joner i vatten. Sammansatta joner i vatten. Vattnets ledningsförmåga. Bygga
batteri av metaller och salt/syra.
Kopparsulfat. Värma, återfukta, kristallisera.
Is av H2O med NaCL och visa nedkylning. Ev. 23g NaCl med 77g is....
Salter
Vi har förstått att salter är föreningar av joner.
Praetorianerna, kejsarens livvakt.
Reliefen är gjord i marmor, kalciumkarbonat, eller kolsyrad kalk, ett i naturen
mycket vanligt salt, som förekommer som kalkspat, kalksten, krita och marmor,
samt i dolomit m m. Genom upphettning spaltas det kalciumoxid(bränd kalk)
och koldioxid. Det är också den viktigaste komponenten i skal av marina
organismer, snäckor, pärlor och äggskal m m.
Kalciumkarbonat är nästan olösligt i vatten, men löses i kolsyrehaltigt vatten
under bildning av surt kalciumkarbonat, Ca(HCO3)2, som är lättlösligt i vatten.
Genom kokning av lösningen återbildas det olösliga kalciumkarbonatet
(pannsten).
Även salmiak NH4Cl, som ingår som slemlösande komponent i hostmedicin är
ett salt.
Salter är en grupp föreningar med så skilda egenskaper att de används till att
baka kakor, göra sprängmedel, gödsla, medicinera m.m.
Den positiva jonen i en saltförening är ofta en metalljon, K+, Na+, Ca2+, Li+,
emedan den negativa ofta är från ämnensgruppen HALOGENER.
Titta i periodiska systemet och gå igenom vilka halogenerna är.
Salter kan även vara föreningar av organsika ämnen.
Repetera organiska föreningar, åk8 i regel.
T.ex om man vill framställa L-lycin, så kommer man oftast att få det som Llysin-HCl, eller azitromycin, azitromycin-Hcl.
Salter kan framställas på flera sätt.
Repetera syror och baser från åk7.
Om man blandar en syra och en bas i ”lika” mängd, så får vi ett salt, t.ex.
ammoniak och saltsyra ger salmiak. Vad ”lika” mängd är ska vi prata om.
Om man lägger en lämplig metall i saltsyra, sönderdelas metallen och vi får en
metall-klorid-lösning (aq.). (aq. Betyder acqua, från latinets ord för vatten.)
När vattnet dunstat får vi ett salt. Hade vi blandat Na med HCl, hade vi fått en
häftig reaktion och med tiden saltvatten.
Gips är också ett salt. CaSO4· 2 H2O, precis som kopparsulfat behöver gipset
vattenmolekyler för att behålla strukturen o befinna sig i fast form. Om man tar
bort vattenmolekylerna blir båda salterna ett fint pulver.
Blandar man pulvret med vatten får man gegga som sedan stelnar under
avgivande av värme.
E516 är numret vid användning i livsmedel.
Vatten, H2O, löser salter.
Vatten är ett polärt lösningsmedel. Det betyder att vattenmolekylen har två
poler ungfär som ett batteri. Syreatomen drar till sig elektronerna
väteatomerna får då en svagare positiv laddning.
(Bild: Qwerter;
https://en.wikipedia.org/wiki/Water#/media/File:3D_model_hydrogen_bonds_in_
water.svg)
Den positiva delen drar till sig den negativa jonen och tvärt om. Därför löser
vatten många salter lätt. När salt är löst i vatten får man något som kallas
elektrolyt. Blod och interstitalvätskor är elektrolyter med många olika salter.
Batterisyra (vatten) är en elektrolyt.
Labb: tillverka ett batteri.
Leder vatten ström?
När leder salt ström?