gruppövning 1
advertisement

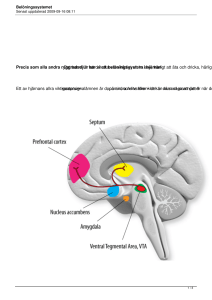
Tandläkarutbildningen T3 – Farmakologi – HT 2016 ARBETSFRÅGOR I SPECIALISERAD FARMAKOLOGI – OLIKA LÄKEMEDELSGRUPPER MED SVARSFÖRSLAG! Målsättning Avsikten är att ge tillfälle att repetera och diskutera grundläggande verkningsmekanismer, effekter, användningsområden etc. för olika läkemedelsgrupper. Förutsättning Seminariet förutsätter att Du läst på/orienterat dig om de olika grupperna av läkemedel i föreläsningsanteckningar, kompendier och lärobok. Seminariet är frivilligt. Hjälmedel Anteckningar, kompendier och lärobok. 1 Neuropsykofarmakologi Läkemedel mot Parkinsons sjukdom Parkinsons sjukdom beror på en degeneration av de nigrostriatal dopaminneuronen och behandlingen syftar till att öka den dopaminerga transmissionen. 1. Beskriv med hjälp av synapsskissen på nästa sida följande för dopamin: a. Från vilken aminosyra bildas dopamin? b. Vad händer efter syntesen i väntan på frisättning? c. Vad händer när dopaminet frisatts? d. Vad menas med autoreceptorer? Vilken funktion fyller vanligen sådana? e. Hur försvinner dopamin från synapsklyftan? f. Nämn ett enzym som bryter ner dopamin. Återupptagspump Receptor Mitokondrie 2 Svar: a. Dopamin (liksom adrenalin och noradrenalin) bildas från tyrosin. b. Dopamin lagras in i vesikler i väntan på frisättning. c. Efter frisättning kan dopaminet påverka receptorer post- och presynaptiskt. d. Med autoreceptorer menar man receptorer som sitter på det presynaptiska neuronet och reglerar syntes och frisättning av transmittor. Den vanligaste funktionen är negativ ”feed back”. e. Frisatt dopamin elimineras från synapsklyftan genom presynaptiskt återupptag (viktigast), enzymatisk nedbrytning (och bortdiffusion). f. Monoaminoxidas (MAO,) katekol-o-metyltransferas (COMT) Utökning: Syntesväg för dopamin: Tyrosin (enzym: tyrosinhydroxylas) => DOPA (enzym: DOPA- dekarboxylas) => dopamin Dopamin-receptorer: 5 olika receptorer som alla är Gproteinkopplade. Di- och D5-receptorer är positivt, medan D2-, D3och D4- receptorer är negativt, kopplade till adenylat-cyklas. D2- och D3-receptorer fungerar även som. autoreceptorer. Autoreceptorerna är lokaliserade dels på dopaminerga nervterminaler (presynaptiska autoreceptorer), dels på dopaminerga neurons soma och dendriter (somatodendritiska autoreceptorer). De presynaptiska reglerar fr.a. frisättning och syntes av DA, och de somatodendritiska reglerar fyrningsfrekvensen och därmed indirekt även frisättning och syntes. Det är de postsynaptiska D2-receptorerna som anses viktigast för den terapeutiska effekten av L-DOPA och bromokriptin vid Parkinsons sjukdom samt för neuroleptika (D2-receptor-blockare). Återupptag in i den presynaptiska terminalen är också den viktigaste mekanismen för elimineringen även av andra monoaminer (noradrenalin och serotonin). DA metaboliseras i huvudsak via två olika vägar: DA - monoaminoxidas (MAO) + aldehydehydrogenas => DOPAC (dihydroxyfenyl ättikssyra) – katekol-ometyltransferas (COMT) => HVA(homovanillinsyra) DA – COMT => 3-MT (3-metoxydopamin) – MAO + aldehydehydrogenas => HVA MAO finns i princip uteslutande intracellulärt bundet till mitokondriens yttermembran, medan COMT finns extracellulärt. 3 2. Hur kan man på olika sätt påverka dopaminerg transmission för att behandla Parkinsons sjukdom? Svar: L-dopa (levodopa) – omvandlas till dopamin efter att det har passerat blodhjärnbarriären och förstärker den dopaminerga transmissionen i striatum. Effekten av L-dopa minskar och blir mer kortvarig i takt med att fler dopaminproducerande nervceller dör. Perifert verkande dopadekarboxylashämmare, t ex benserazid och Karbidopa – ges i kombination med L-dopa, ibland i samma tablett (t ex Madopark) - minskar omvandlingen av l-dopa till dopamin och noradrenalin utanför CNS. Därigenom kan biverkningarna l-dopa begränsas. Katekol-O-metyltransferas (COMT)-hämmare, entakapon (Comtess) och tolkapon (Tasmar) – hämmar nedbrytningen av dopamin (och andra monoamaminer) Monoaminoxidas (MAO)-hämmare, Selegilin (Eldepryl) och rasagilin (Azilect), hämmar nedbrytningen av dopamin. Dopamin-receptoragonister, bromokriptin (Pravidel), kabergolin (Cabaser), ropinirol (Requip) och pramipexol (Sifrol). Dessa medel verkar i olika hög grad på D2- och D3- receptorer. Anikolinergika – vid läkemedelsutlöst Parkinsonism. Utökning: För att minska biverkningarna av L-DOPA används ofta en peifert verkande dekarboxylashämmare. Andra exempel på farmaka som påverkar dopaminerg transmission: Stimulera frisättning av dopamin: amfetamin (även noradrenalin och serotonin), metylfenidat (även effekt på NA, används vid ADHD) Blockera autoreceptorer: neuroleptika (klorpromazin, haloperidol m fl) – D2-receptor antagonister (dock blockeras även postsynaptiska D2 receptorer vilket gör att nettoeffekten blir en hämmad transmission) Hämma återupptaget av dopamin: kokain och bupropion, hämmar även noradrenalin-återupptag, Bupropion används vid rökavvänjning (Zyban) och depression (Voxra)) Neuroleptika (medel vid psykoser/schizofreni) Även vid schizofreni är en förändring av funktionen hos hjärnans dopaminsystem med all sannolikhet en viktig mekanism bakom sjukdomens uppkomst. 4 1. De psykiska symptomen vid psykoser/schizofreni anses enligt den s k dopaminhypotesen bero på rubbningar i speciellt vissa dopaminerga bansystem – vilka bansystem gäller det och hur är transmissionen rubbad? Svar: Enligt dopaminhypotesen är det förändringar i det mesolimbokortikala systemet (som kan delas upp i det mesolimbiska och mesokortikala systemen) som anses vara av störst betydelse för uppkomsten av psykossjukdomar. Hypotesen går i sin ursprungliga form ut på att det handlar om en överaktivitet i det mesolimbiska dopaminsystemet (särskilt som en som förklaring till de positiva symptomen). Idag talar man snarare om en obalans i reglering av de subkortikala och kortikala med en överaktivitet i de subkortikala och istället en underaktivitet i de kortikala. De negativa och kognitiva symptomen anses bero på minskad dopaminerg aktivitet i prefrontala kortex. Även andra signalsubstanser som glutamat, serotonin och acetylkolin är med största sannolikhet involverade. 2. Även om flera mekanismer kan bidra till den terapeutiska effekten av neuroleptika är det en receptor som är särskilt viktig – vilken receptor och hur påverkas den av neuroleptika? Svar: Dopamin D2 receptorn som blockeras av neuroleptika. Utökning: Den terapeutiska effekten anses vara kopplad till en blockad av postsynaptiska D2-receptorer. Hämningen av de presynaptiska D2receptorerna leder till en ökad frisättning av dopamin men denna ”slår inte igenom” - den helt dominerande ”sluteffekten” blir en hämning av impulstrafiken pga den postsynaptiska receptorblockaden. 3. Vilka biverkningar kan antipsykotiska läkemedel ge upphov till? Är det någon som är särskilt bra för en tandläkare att känna till? Svar: Extrapyramidala biverkningar: 1) akut dystoni (kraftiga ofrivilliga spänningar i bl a hals och nacke) 2) Parkisonism, (tremor, hypokinesi och rigiditet =”blyrörsresistens”). (Dessa biverkningar uppträder akut vid blocked av D2 receptorer i striatum och är reversibla). 3) Tardiva dyskinesier som är ofrivilliga ”ormlika” rörelser av ansikte och extremiteter. (Dessa biverkningar uppkommer efter månader/år av antipsykotisk behandling och är ofta irreversibla). Metabola biverkningar, viktuppgång, förändrade blodfetter, 5 diabetes. Störningar av menstruationscykeln, stimulerad mjölksekretion och gynekomasti pga ökad prolaktinproduktion Hypotension pga av alfa-adrenerg blockad Agranulocytos av vissa medel Leukopeni av Klozapin Antikolinerga biverkningar: Muntorrhet (viktigt för tandläkare), synstörningar mm. Antidepressiva läkemedel Antidepressiva läkemedel hör till de läkemedel som används mest i Sverige och övriga västvärlden. 1. Redogör för den s.k. monoaminhypotesen för depression – vad går den ut på och vad talar för den och vad talar emot den? Svar: Hypotesen innebär att det föreligger en funktionell brist på monoaminer, fr.a. serotonin och noradrenalin. Argument för: Läkemedel som höjer monoaminhalterna i synapsklyftan (SSRI, TCA och MAO-hämmare) har terapetisk effekt på deprimerade. Reserpin som tömer ut depåerna av monoaminer (tidigare använt mot högt blodtryck) kan framkalla depression. Argument mot: Tidslatensen för terapeutisk effekt Monoamin-receptorblockare av olika slag saknar effekt på stämningsläget 2. Vilken är de största fördelarna med selektiva serotoninåterupptagshämmare (SSRI) jämfört med tricykliska antidepressiva (TCA) som tidigare var de vanligaste antidepressiva läkemedlen? Gör det någon skillnad för dig som tandläkare om patienten använder den ena eller andra typen av läkemedel? Svar: Den största fördelen med SSRI är mindre biverkningar (de har bl a mindre uttalad antikolinerg effekt vilket innebär lägre grad av muntorrhet) och mindre toxicitet vid överdosering (TCA kan ge mycket alvarliga hjärtarrytmier). Den antidepressiva effekten av SSRI och TCA är likvärdig. 6 Patienter som använder TCA ska inte ges lokalanestetika med tillsats av adrenalin. Denna försiktighetsåtgärd behöver inte vidtas om patienten använder SSRI eftersom dessa medel inte påverkar det neuronala upptaget av adrenalin/noradrenalin i nämnvärd utsträckning. Läkemedel som påverkar kolinerg transmission Farmakologisk påverkan på kolinerg neurotransmission i det perifera och det centrala nervsystemet har en rad viktiga kliniska tillämpningar. 1. Ange minst två exempel på läkemedel/läkemedelsgrupper som verkar (har sin terapeutiska effekt) genom att öka eller minska impulsöverledningen i synapser (kontaktställen) där acetylkolin är signalsubstans. Svar: Acetylkolinesterashämmare – användes vid Alzheimers sjukdom, myastenia gravis, glaukom. Hämmare av acetylkolinfrisättning, botulinumtoxin (Botox) – användes kosmetiskt. Kompetitiva reversibla hämmare av nikotinreceptorer (ickedepolariserande blockare), t.ex. tubokurarin, pankuronium – användes för muskelavslappning vid kirurgi, kan även användas för att blockera hypersekretion av saliv. Kompetetiva reversibla muskarinreceptor-antagonister, t.ex. atropin och skopolamin – användes för att vidga pupillen, och som profylax mot rörelsesjuka samt vid spastiska kontraktionstillsfind i mag-tarm-kanalen. Ångestdämpande medel (anxiolytika – bensodiazepiner) 1.Vilken är den grundläggande verkningsmekanismen (på cellulär nivå) för bensodiazepiner? Svar: Bensodiazepiner binder till en egen bindningsplats på GABA-A-receptorkloridkanalskomplexet i cellmembranet (och faciliterar därigenom GABA:s förmåga att öppna kloridkanalen och framkalla hyperpolarisering). 2.Vilka är bensodiazepinernas huvudsakliga effekter - vad används de till? Svar: 7 Bensodiazepiner användes som ångestdämpande medel, sederande medel, sömnmedel och för att motverka kramper. 3.Vad ska du tänka på när du överväger att skriva ut en bensodiazepin som premedicinering före ett ingrepp eller när du ska använda bensodiazepin för sedering i samband med själva ingreppet? Svar: Inte till äldre. Ledsagare. Avråda från bilkörning etc. 4.Zopiklon (Imovane), Zolpidem (Stillnoct) och Zaleplon (Sonata) används alla som sömnmedel. Ange en fördel med dessa medel jämfört med bensodiazepiner. Svar: Ger mindre hang over. Ev mindre beroendeframkallande (?) Behandling och förebyggande av smärta 1. Beskriv opioidernas centrala och perifera effekter. Vilka kan utnyttjas kliniskt och vilka ger upphov till biverkningar. Svar: Centralt medierade effekter Analgesi – effekt även på den affektiva delen av smärtupplevelsen Eufori - i vissa fall dysfori. Sedering - minskad koncentrationsförmåga, minskad fysisk och psykisk prestationsförmåga. Andningsdepression pga blockering av koldioxid- driven. Svår smärta stimulerar andningen (hyperventilation) = fysiologisk antagonist till opioidernas andningsdeprimerande effekt. Hostdämpning - uttalat speciellt för kodein. Mios (knappnålsstora pupiller) pga stimulering av kärnan till N. occulomotorius - blockeras av opioidantagonister och antikolinergika - ingen toleransutveckling - diagnostiskt värde. Kräkningar och illamående – p g a stim av kemoreceptorer i area postrema - förbättras ofta spontant efter några dagars behandling kan motverkas med antiemetika/antihistamin 8 Terapeutiskt utnyttjas den analgetiska och hostdämpande (kodein) effekterna. Övriga effekter är (i vårdsammanhang) biverkningar. Perifert medierade effekter Ökad tonus och minskad peristaltik i tarmen - förstoppning är ett problem vid långtidsbehandling - ge Laktulos eller liknande - jfr loperamid (Imodium) – en perifert verkande opioid som används mot diarré. Ökad tonus i gallgångar - undvik morfin och kodein vid gallstenssmärta, petidin eller ketobemidon (Ketogan) är att föredra framför morfin. Ökad tonus i urinvägar - kan ge urinretention samt ökade besvär vid njursten (dock ej lika uttalat som vid gallsten), petidin och ketobemidon är även här att föredra framför morfin. Histaminfrisättning - kan ge urtikaria, klåda, bronkokonstriktion (Astma) och hypotension pga. perifer vasodilatation. Terapeutiskt utnyttjas den förstoppande effekten enl ovan. Övriga effekter är biverningar. 2. Kodein verkar genom att omvandlas till en metabolit som utövar den analgetiska effekten. Vilken är metaboliten? Svar: Morfin 3. Hur skiljer sig metadon från morfin. Vilka två huvudsakliga användningsområden har metadon? Svar: Metadon är mindre fettlösligt än morfin och når långsammare in i CNS samt elimineras långsammare. Metadon ger lägre grad av eufori (effekten sätter in långsammare) och ger lindrigare abstinens. Metadon används som smärtstillande medel och för avvänjning från morfin/heroin. 4. Vilken av nedanstående två typer av smärta lindras mest effektivt av opioider? Nociceptiv smärta Neuropatisk smärta 9 Svar: Nociceptiv smärta 5.Vilka läkemedelsgrupper utgör förstahandsmedel vid neuropatisk smärta i exempelvis mun och ansiktsregionen? Svar Antidepressiva läkemedel och antiepileptika. Vid trigeminusneuralgi särskilt karbamazeoin (Tegretol) 6.Vilken är verkningsmekanismen för den lokalanestetiska effekten av lidokain? Svar: Blockerar natriumkanaler. 7.När är det fel att välja lokalanestetika med tillsats av adrenalin? Svar: När patienten behandlas med TCA, har hypertyreos, är svårt hjärtsjuk, vid anestesi i ändorgan (t ex fingertipp). Läkemedelsberoende 1. Vad som menas med toleransutveckling för läkemedel? Vilka orsaker kan finnas? Svar: Med tolerans menas att den dos som krävs för att uppnå en viss grad av effekt (”styrka” på effekten) ökar då medlet används kontinueligt/upprepade gånger. Mekanismen kan vara farmakokinetisk (t ex enzyminduktion) eller farmakodynamisk (t ex nedreglering av receptorer och signalvägar som medierar effekt) 2.Vad menas med abstinens? Nämn en egenskap hos ett läkemedel som kan vara avgörande för graden av abstinens. Svar: Med abstinens menas fysiska och/eller psykiska reaktioner vid utsättning av ett läkemedel (avbruten behandling/användning). Hur snabbt läkemedlet 10 elimineras har ofta betydelse (snabb eliminering bidrar till kraftiga abstiniensbesvär) 3.Varför är heroin mer beroendeframkallande än morfin? Svar: Det är betydligt mer fettlösligt och passerar lättare genom blodhjärnbarriären och metaboliseras snabbare – mer ”kick” och kraftigare abstinens. 4. Beroendeframkallande medel (som exempelvis amfetamin, kokain, opiater och nikotin) kan framkalla en upplevelse av belöning (eufori). Vilken anses den gemensamma ”slutliga” mekanismen vara för detta? Var i hjärnan utövas effekten? Svar: Ökar dopaminfrisättningen i Nucleus Accumbens Antiinflammatoriska och immunmodulerande läkemedel – glukokortikoider, ”non-steroid antiinflammatory drugs (NSAID)” och paracetamol. 1. Redogör för mekanismerna bakom glukokortikoiders antiinflammatoriska och immunosuppressiva effekter. Svar: Antiinflammatorisk effekt: Glukokortikoiden binder till den lösliga glukokortikoidreceptorn i cytoplasma (I), receptorkomplexet translokerar in till kärnan där det interagerar med andra transkriptionsfaktorer eller direkt med DNA (promotorregionen för olika gener) och påverkar därmed gentranskription (II). Detta ger bl a sänkt uttryck av cytokiner, chemokiner och adhesionsmolekyler (III), samt av vissa enzymer (t ex sPLA2, COX-2) vilket leder till minskad syntes av vissa lågmolekylära inflammatoriska och algetiska mediatorer som prostaglandiner och leukotriener. 11 Några viktiga proteinfamiljer vars uttryck påverkas av glukokortikoider ledande till antiinflammatorisk effekt: Protein Nukleär Lågmolekylär mediator mekanism Proinflammatoriska cytokiner: IL-1, TNF, GM-CSF, IL-8 NF-B IL-3, 4, 5, 6 -GRE Adhesionsmolekyler: ICAM-1, VCAM-1, E-selektin NF-B Proinflammatoriska enzymer: INOS, Cox-2 NO, PG NF-B sPLA2 PG, LT, PAF NF-B Antiinflammatoriska proteiner: lipokortin-1 Antiinflammatoriska enzymer: ACE, NEP Vävnadsnedbrytande enzymer: Metalloproteinaser, kollagenas +GRE PG, LT, PAF +GRE neuropeptider, bradykinin AP-1 Immunosuppresiv effekt: Glukokortikoider hämmar syntes av fr a IL-1, IL2 och TNFa, men även andra cytokiner. Steroid-receptorkomplexet binder till transkriptionsproteinet AP-1 (Activator protein 1) som behöver binda till NF-AT för att transkription av IL-2-genen skall induceras. AP-1 är ej specifikt för IL-2-genen och T-celler. 2. Varför föredrar man lokal framför systemisk administrering av glukokortikoider vid t ex allergiska besvär i luftvägarna? Ange andra typer av lokal administrering som lämpar sig för glukokortikoider. Svar: För att undvika systemiska biverkningar genom att kunna minska totaldos (större andel av l-m når dit man vill ha det). Den mest begränsande biverkningen är osteoporos/tillväxthämning. Det är inte visat att lokal administrering av glukokortikoider har bättre effekt än systemisk administrering vid behandling av astma. Ibland kan lokal behandling ge upphov till biverkningar: t ex svampinfektion och heshet av inhalationssteroider. Exempel på administreringssätt: nässpray, ögondroppar, örondroppar, inhalator, salva, enterokapslar, klysma, suppositorier, lokala injektioner. 3. Behandling med NSAID kan medföra att antal olika biverkningar. Diskutera kring effekter i njure, mag-tarmkanal, uterus, 12 koagulationssystemet, kardiovaskulära systemet. Vilket COX enzym (1 eller 2) är viktigast i de olika organen/systemen? Svar: Gastrit p g a utslagning av lokalt producerade skyddande PGI2 och PGE2, som stimulerar mukusbildning och hämmar syrasekretion. Magsår är en kontraindikation för ASA-behandling. Cox 1. Blödningar. Framför allt i mag-tarmkanal, hämning av syntes av TXA2 som stimulerar till trombocytaggregering. Koagulationsrubbningar är en kontraindikation för ASA-behandling. Cox-1. Bronkkonstriktion, urtikaria och i värsta fall anafylaktoid chock. Detta p g a intolerans, dvs en icke immunologisk överkänslighet för ASA. Möjlig mekanism är att vissa personer är säskilt känsliga för en inhibition av PGE2syntes, och därmed utebliven negativ feedback-funktion på mastcellsaktivitet. Astma är en kontraindikation för ASA-behandling.. Cox-1. Njursvikt. Utslagning av lokal produktion i njurarna av PGE2 och PGI2 vilka medierar vasodilatation. Hjärtsvikt och lättare kronisk njursvikt är en kontraindikation för ASA-behandling (akut njursvikt kan uppstå). Cox-1 och Cox-2. Infertilitet/graviditetspåverkan/fosterpåverkan. ASA-behandling kan leda till utebliven ägglossning och därmed infertilitet samt uppskjutet/uteblivet förlossningsarbete (PGF2 och PGE2 kontraherar uterus). ASA-behandling kan medföra en intrauterin stängning av ductus arteriosus (som i slutskedet hålls öppen av PG) . NSAID ska inte tas i graviditetens slutskede. Cox-2. Minskat kardiovaskulärt skydd (selektiv COX 2-hämning). Vid selektiv hämning av Cox-2-medierad PGI2-syntes i aterosklerotiska/inflammerade kärl ökar risken för blodpropp i hjärna och hjärta. PGI2 har vasodilaterande och antitrombotiska egenskaper. Kardiovaskulär sjukdom är en kontraindikation för behandling med COX 2 – hämmare. 4. ASA binder både COX-1 och COX-2 irreversibelt. Trots detta får man vid behandling med en låg dos ASA en trombosprofylaktisk effekt med minskad TXA2 syntes samtidigt som PGI2 fortsätter att syntetiseras. Förklara! Svar: Trombocyter har inte någon kärna och kan inte nybilda COX-1. Detta leder till att TXA2-syntesen blir irreversibelt hämmad av ASA. COX-2 i endotelceller (som däremot har cellkärnor) tros vara största källan för PGI2. ASA hämmar COX-2 irreversibelt, men kan COX-2 nybildas i endotelcellerna och PGI2 syntesen kan fortsätta. 13 5. Beskriv mekanismerna vid intoxikation med ASA (aceylsalicylsyra) respektive paracetamol, samt principerna för farmakologisk behandling av dessa intoxikationstillstånd. Svar: ASA: Ett sekventiellt förlopp uppstår bestående av fr a CNS-effekter: 1. Först ses en stimulering av andningscentrum vilket leder till en respiratorisk alkalos som kompenseras med utsöndring av bikarbonat (ger metabolisk acidos). 2. Sedan följer andningsdepression vilket ger också en respiratorisk acidos. 3. Nollte ordningen kinetik inträder och SA ansamlas. ASA och metaboliten salicylsyra är i sig syror samt ger störning i kolhydratmetabolism som resulterar i laktatansamling. Detta förstärker den metaboliska acidosen vilken kan bli livshotande. Behandling består bl a av bikarbonatinfusion vilken ger alkalinisering av urin och en jonfälla för SA skapas (utsöndring av SA påskyndas därmed). Paracetamol: Reaktiva intermediärer bildas i levern som ger celldöd och leverskada. Behandling sker bl a med acetylcystein i.v. som kan reagera med de toxiska intermediärerna och bilda icke-celltoxiska produkter som kan utsöndras. Kardiovaskulär farmakologi 1.Vilka grupper av läkemedel används för behandling av hjärtsvikt. Svar: I första hand: ACE-hämmare / Betablockare Diuretika Även: Angiotensin II-rec antagonister Organiska nitrater (nitroglycerin) Hjärtglykosider (digitalis) 2.Redogör för profylaktisk behandling av angina pectoris (kärlkramp). Vilka effekter på hjärtat vill man uppnå? ASA i lågdos (trombosprofylax) Långverkande nitrat (kärlvidgare) Betablockerare Kalciumantagonist 14 Anfallskuperande: Nitroglycerin 3. Beskriv loop- och tiaziddiuretika med avseende på verkningsmekanism, effekter på diures (anslagstid, duration) samt effekter på elektrolytbalans. Vilka skillnader finns mellan dessa bägge typer av medel. Svar: Loop-diuretika hämmar aktiv re-absorption av Na+, K+, Cl i Henles slynga - och hindrar därmed re-absorptionen av H2O, kort anslagstid och verkningsduration Tiazider hämmar aktiv re-absorptionen av Na+, Cl- K+ och H2O-i distala tubuli och hindrar därmed re-absorptionen av H2O, längre anslagstid och verkningsduration Båda kan ge hypokalemi Antihypertensiva läkemedel framkallar blodtryckssänkning genom påverkan på olika organ. Ange i nedanstående figur i vilka organ följande läkemedel utövar sina effekter och beskriv medlens verkningsmekanismer: a. ß-lockerare b. Tiaziddiuretika c. Kalciumflödeshämmare d. ACE-hämmare Brain Heart Kidney Resistance vessels Renin/angiotensin /aldosterone 15 Svar: Betablockare – avlastning av hjärtat (neg. kronotrop och inotrop effekt) + minskar sympatikusstimulerad renin frisättning i njurarna ( Angiotensin)+ Minskar frisättning av noradrenalin från perifera sympatiska nerver + • CNS-effekter (sympatikusutflödet minskar) Tiaziddiuretika – dilatation av resistanskärl ACE-hämmare – hämmar bildningen av angiotensin II – kärlvidgning Kalciumflödes-hämmare - (”kalciumantagonister”) – hämmar öppnandet av kalciumkanaler i hjärtat och i blodkärl - då minskar den intracellulära – kalciumkoncentrationen – vasodillatation + slagkraft och frekvens minskar i hjärtat – blodtrycket sjunker Antibiotika 1.Penicilliner elimineras till allra största delen oförändrade genom utsöndring med urinen. Trots det brukar man inte behöva reducera dosen vid njurinsufficiens. Vad beror det på? Svar: De har mycket stor terapeutisk bredd. 2.Varför ska man inte (utom på mycket stränga indikationer) skriva ut tetracyklinpreparat till barn under 8 år? Svar: Tetracykliner kan inlagras i växande tänder och i skelettet. 3. Klindamycin kan ge en mycket alvarlig biverkan – vilken och vad orsakar den? Svar: Pseudomembranös kolit genom toxinpåverkan från en överväxt av Clostridium difficile i tarmen. Antikoagulantia 16 1. Jämför heparin och warfarin med avseende på: Verkningsmekanism Tid det tar för att få effekt Eventuell användbarhet under graviditet Svar: Heparin binder till den endogena koagulationshämmande substansen antitrombin och förstärker omedelbart dess effekt ungefär 1000 ggr. Warfarin hämmar den vitamin-K-beroende bildningen av koagulationsfaktorerna II (protrombin), VII, IX och X. Heparin har omedelbar effekt medan den terapeutiska effekten av warfarin utvecklas först 4-5 dagar efter att behandling startats. Heparin passerar inte över placentan och kan därför till skillnad från Warfarin användas under graviditet (svårigheten för heparin att passera biologiska membraner gör också att det inte kan ges peroralt). Andningsvägarnas farmakologi 1. Beskriv olika farmakologiska behandlingsprinciper för behandling av hosta. Svar: Hosta är en reflex som skyddar luftvägarna mot inandning av partiklar eller kemikalier. Kan också uppkomma vid inflammation i luftvägarna. Det är ett symptom som bara bör behandlas om det påverkar livsföring eller nattsömn. Generellt är den kliniska nyttan med hostmediciner dåligt dokumenterad och de är därför inte rabattberättigade. Behandling av produktiv (slem) hosta: Slemlösande medel: Acetylcystein och Bromhexidin – bryter disulfidbryggor mellan glykoprotein i mucus. Behandling av torrhosta: Central hostdämpning: Kodein, etylmorfin (Cocilliana-Etyfin) och noskapin – dämpar hostreflex, centralt verkande opiater, genom att hindra afferenta impulser från bronkialslemhinnan att nå CNS. Fördel med noskapin är att det inte är vanebildande, vilket etylmorfin är. 17 2. Beskriv likheter och olikheter för farmakologiska behandling av allergisk rinit respektive astma. Vilka medel används och vilka effekter uppnås med respektive medel? Svar: Behandling av astma: Glukokortikoider: anti-inflamatoriska (e.g. beklometason, budesonid) B2-agonister: bronkvidgande, korttidsverkande (e.g. salbutamol) och långtidsverkande (e.g. salmeterol) Leukotrienreceptorantagonist, antiinflamatoriskt och bronkrelaxerande, (montelukast) Antikolinergika: bronkrelaxerande (ipratropium) Teofyllin: bronkrelaxerande (hämmar fosfodiestras vilket leder till ökning av cAMP och cGMP intracellulärt och är dessutom kompetetiv antagonist på adenosin A1 och A2-receptorer – båda mekanismerna kan tänkas bidra till bronkdillatation). Natriumkromoglikat: mastcellstabilisering vilket ger minskad frisättning av histamin och andra mediatorer. (har fått en allt mindre betydelse vid behandling av astma hos vuxna. Medlet kan tas profylaktiskt som tillägg till kortverkande beta-2-stimulerare före ansträngning och vid allergenexponering). Anti-IgE antikroppar: antiinflammatorisk effect Behandling av allergisk rinit: Glukokortikoider: anti-inflamatoriska Natriumkromoglikat: mastcellstabilisering -agonister: avsvällande Antihistamin: minskad slemhinnesvullnad och sekretion Antikolinergika: antisekretorisk effekt. Leukotrienreceptorantagonist 18 Likheter: Antiinflammatorisk behandling med glukokortikoider, leukotrienreceptorantagonister och natriumkromoglikat. Olikheter: Sympatomimetika: 2-agonister vid astma och -agonister vid rinit. Mediatorantagonister: antihistamin vid rinit (men inte vid astma) och leukotrienantagonister: antiinflamatoriska och bronkrelaxerande vid astma, antiinflammatoriska vid rinit). Teofyllin användes endast vid astma (endast begränsad användning pga biverkningar) Antikolinergika: fr a bronkrelaxerande vid astma och antisekretoriskt vid rinit. Mag-tarmkanalens farmakologi Beskriv verkningsmekanismen för de olika läkemedel/läkemedelsgrupper som kan användas för att behandla syraberoende magsår (ventrikelulcus). Svar Protonpumpshämmare (t ex omeprazol och lansoprazol) – hämmar irreversibelt H+/K+-ATP:as i protonpumpen i parietalcellerna. Antibiotika (metronidazol, klaritomycin och amoxicillin - kombination av två av dessa ges tillsammans med protonpumpshämmare) – slår ut Helicobacter pylori hos de flesta patienter). Histamin H2-antagonister (t ex famotidin och ranitidin) – slår ut histaminets stimulerande effekt på parietalcellernas saltsyresekretion (både den basala och den stimulerade sekretionen). Antacida – syraneutraliserande basiska salter (kombinationer av aluminium-, kalcium- och magnesiumföreningar). Ger kortvarig neutralisering av ventrikelinnehållet. Sukralfat – ett icke absorberbart aluminiumsalt av sackaros som bildar en täckande gel och som ger lokal mukosaprotektion. Misiprostol – Prostaglandin, PGE1-analog som har skyddande effekt på magslemhinnan genom att ökad slemproduktionen – användes endast vid NSAID-utlöst ulcus (se ovan). 19