Självantändning med glycerol och kaliumpermanganat
advertisement

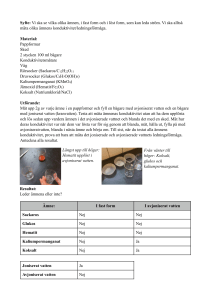
Minna Heino och Tanja Häkli Självantändning med glycerol och kaliumpermanganat Förberedande uppgifter I klassen bör skillnaden mellan exoterma och endoterma reaktioner diskuteras, t.ex. med hjälp av graf för reaktionsförloppet i en kemisk reaktion. Diskutera även hur en kemisk reaktion kan påskyndas. Material och ämnen - degel pipett urglas mortel för finfördelning av kaliumpermanganat glycerol kaliumpermanganat vatten Säkerhetsföreskrifter och avfallshantering Demonstrationen bör utföras i dragskåp på ett eldfast underlag. Det är skäl att ha ett urglas till hands för att kunna kväva elden vid behov. Använd skyddsglasögon. Kaliumpermanganat är ett oxiderande ämne och bör förvaras skilt från brandfarliga ämnen. Undvik hudkontakt med kaliumpermanganat. Resterna bör förstöras genom att spola ner dem med riklig mängd vatten Utförande (Demonstrationen går att utföra på 5-10 min.) Lägg 1-2 g kaliumpermanganat (finfördelad) i en degel (el dyl. eldfast kärl). Fukta kaliumpermanganatet med ett par droppar vatten så att det går att forma i en hög. Tillsätt 6-10 droppar glycerol på kaliumpermanganaten. Observera vad som händer. Reaktionen sätter i gång om en knapp minut. Resultat Reaktionen sätter i gång av sig själv. Kaliumpermanganaten brinner med en ljusviolett låga. Reaktionen är häftig. Diskussion Reaktionen fungerar endast om reaktanterna är färska, glycerolen får inte innehålla vatten. Eftersom reaktionen är häftig och frigör värme lämpar den sig inte som elevlaboration! För att alla skall kunna observera händelseförloppet är det lättare om klassen är liten eller det går att utföra experimentet för en del av klassen åt gången. Reaktionen är följande 14 KMnO4 (s) + 4 C3H5(OH)3 (l) 7 K2CO3 (s) + 7 Mn2O3 (s) + 5 CO2 (g) + 16 H2O (g) + värme Källa http://school.chem.umu.se/Experiment/P138