Antibiotika – bra och dålig användning
advertisement

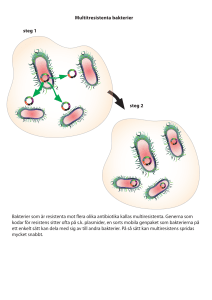
Antibiotika – bra och dålig användning Anders Franklin Avdelningen för Antibiotika, SVA 751 89 Uppsala e-post: [email protected] Bakgrund Antibiotika utövar ett selektionstryck på bakteriepopulationer, vilket ger antibiotikaresistenta bakterier bättre överlevnadsförmåga. I närvaro av antibiotika minskar känsliga bakterier i antal medan resistenta fortsätter att föröka sig. Förekomsten av antibiotikaresistens ökar. Sambandet mellan användning av antibiotika och resistensutveckling har klart visats för både djur och människobakterier. Selektion av resistenta bakterier sker när antibiotikakoncentrationen är högre än normalt känsliga bakterier klarar av. Exponering för låga doser, sådana som används i tillväxtbefrämjande syfte, innebär också risk för selektion av resistens, eftersom koncentrationerna i djurens tarmsystem ofta är tillräckliga för att vara bakteriehämmande. Antibiotikaresistens i sig själv är inte ett problem. Problemet uppstår när bakterien orsakar sjukdom som inte går att behandla. Resistens inverkar negativt på djurhälsa och produktivitet. Resistensproblem är vanliga i samband med tarm och luftvägsinfektioner hos flera djurslag. Resistens hos djurbakterier har också indirekta konsekvenser för humanhälsan. Ökad dödlighet och minskad produktivitet hos djur kan leda till försämrad tillgång till livsmedel. I Sverige råder sedan lång tid enighet om vikten av att antibiotika används på rätt sätt och bara när det är nödvändigt. Målmedvetet arbete i kombination med ett gott smittskydd är sannolikt orsaken till att resistensläget hos bakterier från djur i Sverige är jämförelsevis gott. För att förbättra möjligheten att upptäcka ökande antibiotikaresistens hos bakterier från djur startades under år 2000 ett program för kontinuerlig övervakning vid SVA. Programmet, Svensk Veterinär Antibiotika Resistens Monitorering, (SVARM), omfattar regelbunden insamling och resistensundersökning av bakterier från djur. I programmet ingår zoonos-bakterier (Salmonella spp. och Campylobacter spp.), djurpatogener (t. ex. luftvägspatogener och juverpatogener) samt s.k. indikatorbakterier (E. coli och Enterococcus spp.) från slaktade nötkreatur, svin och kycklingar. Resultaten redovisas årligen i en rapport. Antibiotika som tillväxtbefrämjare Användning av antibiotika i tillväxtbefrämjande syfte är ett utmärkt exempel på dålig användning av antibiotika. Den eventuella nyttan i form av marginellt högre tillväxt ska ställas mot risken för resistensutveckling mot medlen i fråga. Många av dessa medel är identiska med eller tillhörde antibiotikagrupper som också användes till behandling av infektioner hos både människor och djur. Den positiva eller tillväxtbefrämjande effekten orsakades troligen huvudsakligen av att de hade en bakteriehämmande effekt och verkade förebyggande mot avvänjningsdiarré hos svin och infektioner som svindysenteri eller vaktelsjuka hos kyckling. Effekten av denna användning är också mest påtaglig i anläggningar med dålig hygien. I Sverige har, som bekant, all användning av antibiotika som tillväxtbefrämjare varit förbjuden sedan 1986. Efter EU-inträdet verkade Sverige för att övriga EU skulle anpassa sig till vår lagstiftning och inte tvärtom. Mot förmodan lyckades vi till stora delar med detta. I EU förbjöds från och med 1999 sex antibiotika som tillväxtbefrämjare, nämligen alla som också användes i behandlingssyfte till djur och människor, nämligen tylosin, spiramycin, virginiamycin samt bacitracin. Olaquindox och carbadox förbjöds av toxikologiska skäl. Glykopeptiden avoparcin förbjöds redan 1997. Fyra antibiotika, flavofosfolipol, avilamycin, salinomycin och monensin är fortfarande tillåtna men föreslås av EG-Kommissionen fasas ut senast 2006. Enterokocker förekommer i tarmen hos alla djurslag inklusive människa. Enterokocker som ger infektioner hos människor är naturligt resistenta mot många antibiotika. Dessutom är förvärvad resistens vanlig. I många länder är glykopeptiden vankomycin det enda effektiva medlet. Vankomycinresistens hos både människor och djur orsakas oftast av ett genkomplex som benämns vanA. Komplexet som består av 9 gener, ger höggradig resistens mot vankomycin och besläktade medel som avoparcin. I Europa användes avoparcin i stor utsträckning som tillväxtbefrämjande medel under decennier. Efter det att genkomplexet plockats upp av enterokocker i Europas djuruppfödningsanläggningar har det spritt sig som en zoonotisk pandemi över världen. Ursprunget till detta genkomplex är med stor sannolikhet en okänd mikrobiell källa i miljön 37 Resistens mot vankomycin begränsar kraftigt möjligheten att framgångsrikt behandla enterokockinfektioner. Vankomycinresistenta enterokocker (VRE) isolerade från människa är därför anmälningspliktiga enligt smittskyddslagen. Infektion med VRE hos människa ses framförallt hos nedsatta patienter på sjukhus. Den zoonotiska spridningen antas i första hand ske via livsmedel, men studier i besättningar med hög frekvens VRE har visat att djurens skötare i hög utsträckning också är bärare. VRE förekommer sporadiskt på svenska sjukhus. I en undersökning av inte sjukhusvårdade svenskar påvisades VRE endast i 1 av 670 prover (<0.1 %). Detta står i stark kontrast till situationen i Europa, där mellan 3 och 5 % av populationen är bärare. Skillnaden förklaras troligen av att vi inte använt avoparcin sedan 1982. Med hänvisning till försiktighetsprincipen förbjöd EG-kommissionen av humanmedicinska skäl användning av avoparcin i djurfoder 1997. Livsmedel av framför allt animalt ursprung är emellertid fortfarande en smittkälla för VRE i Europa om än i minskande frekvens. Alltsedan VRE började uppträda på sjukhus i slutet av 80-talet har det stora skräckscenariot varit att vanAkomplexet skulle överföras till multiresistenta Staphylococcus aureus, mot vilka glykopeptider under lång tid har varit den enda fungerande substansen. Mikrobiologer har länge hävdat att frågan är inte om utan när denna överföring skulle ske i ”levande livet”. Dessa farhågor var också en viktig orsak till att EG-kommissionen förbjöd avoparcin. Nu har det hänt, typiskt nog utan att väcka någon större massmedial uppståndelse. I en artikel i Nature i augusti 2002 rapporteras nämligen att S. aureus med vanA genen isolerats från en patient på ett sjukhus i USA. Med stor sannolikhet har överföringen skett från VRE som fanns i patientens tarmkanal. I dagarna har ännu ett fall rapporterats från USA. Zoonotisk spridning av antibiotikaresistens Spridning av resistens från djur till människa kan ske genom direkt spridning av resistenta zoonosbakterier som Salmonella och Campylobacter eller att djurbakterier överför resistensgener till människans tarmbakterier. I båda fallen är livsmedel och direktkontakt de två viktigaste spridningsvägarna, men bakterier kan som tidigare nämnts utbyta genmaterial i alla miljöer. Överföringsmöjligheterna och mekanismerna är otaliga. Ett tidigt exempel från USA som rör spridning av en S. Newportstam från kalvar till människa väckte stor uppmärksamhet då det publicerades i New England Journal of Medicine i mitten på 80-talet. Patienterna blev svårt sjuka och även dödsfall inträffade. Smittkällan härleddes till en biffdjursfarm i South Dakota. Man kunde sedan följa smittvägarna via distribution av kött från farmen till flera stater i USA. Intressant nog stod samtliga insjuknade patienter på behandling med ampicillin eller liknande antibiotika, samma substanser som salmonellastammen var resistent mot. Det finns idag många studier som visar att patogener som t.ex. Salmonella gynnas och kan orsaka sjukdomsutbrott vid antibiotikabehandling av både människa och djur. Den ökande förekomsten av resistens mot terapeutiskt värdefulla moderna antibiotika som kinoloner och 3:e generationens cefalosporiner hos i övrigt multiresistenta zoonotiska bakterier har lett till att veterinärers rätt att använda medel ur dessa klasser till livsmedelsproducerande djur har ifrågasatts. Organisationen APUA, Alliance for Prudent Use of Antimicrobials, rekommenderar att de bara används vid tillfällen då andra antibiotika inte fungerar, och då enbart till enskilda djur. Epidemiologiska aspekter Det är viktigt att inse att varje gång man behandlar ett djur behandlar man inte bara den sjukdomsframkallande bakterien utan hela normalfloran. Resistens kan förvärvas och spridas hos normala tarmbakterier och även hos bakterier i miljön. Sådana bakterier kommer att fungera som en reservoar av resistensgener, vilken ibland refereras till som en pool av resistensgener. Såvida man inte letar specifikt efter dessa gener kommer denna reservoar att förbli obemärkt tills resistensgenerna passerar över till kliniskt relevanta bakterier. Under de senaste femtio åren har ett kraftigt selektionstryck utövats på mikrober i olika miljöer runt om i världen. En stor pool av resistensgener har skapats, vilken gynnar en vid spridning av resistensgener mellan olika ekologiska nischer som människor, djur och den yttre miljön. Antibiotikaresistens är en egenskap hos bakterier och givetvis påverkas dess epidemiologi av samma faktorer som gynnar bakteriespridning. Det innebär att faktorer som selektionstrycket, antalet djur per ytenhet, besättningsstorlek och inte minst handel och transporter av djur inverkar på spridningen. Direkt kontakt mellan djur eller djurgrupper har störst betydelse. I många fall, t.ex. penicillinresistens hos S. aureus, måste penicillinresistenta varianter redan finnas i en mjölkkobesättning för att en spridning av penicillinresistens 38 ska kunna ske, oavsett hur mycket penicillin som används i besättningen. De moderna djuruppfödningsformerna med många djur på små ytor fungerar som stora reservoarer av resistensgener. Selektionstrycket av antibiotika är ofta kraftigt, í synnerhet vid gruppmedicinering av djur. Man kan dra paralleller till daghem och intensivvårdsavdelningar på sjukhus. Grogrunden för uppkomst, utbyte och spridning av resistensgener är synnerligen gynnsam. Gruppbehandling av djur är alltid ett sämre alternativ än individuell behandling. Individuell antibiotikabehandling med injektioner ger säkrare effekt och reducerar risken för resistensutveckling avsevärt. Antibiotikarester i naturen Anrikning av antibiotika i naturen har länge setts som en potentiell miljöbomb, inte minst efter rapporter fån norska fiskodlingar där man visade att moderna kinoloner och även tetracykliner anrikades i bottenslam under lång tid utan att brytas ned och påverkade mikromiljön på olika vis. Numera har man radikalt minskat antibiotikaanvändningen i norsk fiskodling och förmodligen desarmerat denna bomb. För övrigt finns få rapporter om anrikning av antibiotika i naturen som en effekt av användning till djur eller människor. Nyligen publicerades emellertid relativt uppseendeväckande data av en schweizisk forskare i Journal of Chromatography. Enligt hans beräkningar innehåller gödsel från schweiziska farmer upp till 20 ppm sulfonamider, vilket innebär att varje hektar åker kan vara kontaminerat med ett kilo sulfonamid, tillräckligt hög för att orsaka resistensutveckling enligt författaren. EU:s bestämmelser tillåter upp till 75 g av ett visst antibiotikum per hektar. Vi tror väl kanske ändå inte att restmängder av antibiotika på åkrar och i vattendrag i samband med djuruppfödning är något större miljöproblem. De norska och schweiziska rapporterna visar dock att dessa risker inte kan negligeras. Den tveklöst största miljörisken är ändå spridningen av gödsel och urin m.m. som kontaminerar åkrar, betesmarker, vattendrag och odlade växter med resistenta bakterier. Till detta kommer inte minst tillförseln av allvarlig antibiotikaresistens orsakad av människan, illustrerad av de hög frekvens resistenta enterokocker i både kommunala avlopp och sjukhusavlopp i Sverige. Slutord Antibiotikaresistenta bakterier finns i olika nischer, som t.ex. människor, djur, växter, jord och vatten. Resistensgenerna är oftast rörliga mellan olika bakteriearter och mellan de olika nischerna, och man anser allmänt att den totala reservoaren av resistensgener fungerar som en pool varifrån behövande bakterier kan hämta nya egenskaper. Spridning av antibiotikaresistens inom och mellan de olika nischerna är en följd av okritiskt användande av antibiotika, men också av bristande smittskydd. Utöver omdömesgill användning av antibiotika gäller de allmänna principer som tillämpas vid infektionskontroll gäller även för bekämpningen av antibiotikaresistenta bakterier. Sveriges läge är gott och det beror på att vi har haft en god tradition inom båda dessa områden. Det långsiktiga övergripande målet är att bevara antibiotika som värdefulla läkemedel i framtiden. 39