Proteinstrukturer
advertisement

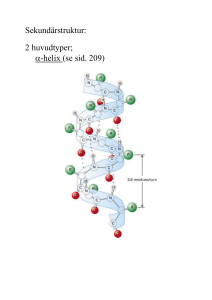
Proteinstrukturer: 4 nivåer: Primärstruktur Talar om vilka aminosyror som ingår i ett protein och i vilken ordningsföljd som dessa är ihopkopplade. Sekundärstruktur Lokala strukturer som uppkommer när vätebindningar bildas mellan olika aminosyror i polypeptidkedjan. 2 huvudtyper; -helix (se sid. 192) 3.6 aa/varv Vätebindning mellan aa1 och aa5 -struktur (se sid. 192) -parallell -antiparallell Tertiärstruktur (3D-struktur) I ett givet protein intar -helixar, -strukturer och polypeptidslingor utan sekundärstruktur bestämda platser i rymden. Flera olika intramolekylära krafter stabiliserar tertiärstrukturen: - vätebindningar - elektrostatiska krafter - hydrofobinteraktioner - kovalenta S-S-bryggor Kvartärstruktur Många proteiner består av mer än en polypeptidkedja. Kvartärstrukturen anger hur de olika polypeptidkedjorna interagerar med varandra i rymden. Denaturering: Denaturering innebär att bindningarna som håller samman sekundär-, tertiär- och kvartärstrukturen bryts. När den tredimensionella strukturen förstörs, förloras de biologiska egenskaperna. Denatureringen kan vara reversibel eller irreversibel. - Irreversibel; VÄRME pH - Reversibel; VISSA SALTER - GuHCl - (NH4)2SO4 Enzymer: ENZYM – katalytiskt aktivt protein - möjliggör många reaktioner som utanför cellen sker ytterst långsamt Varje enzym kräver olika betingelser (pH, temperatur) för att fungera optimalt. Effektiviteten hos enzymerna varierar: - Kolsyraanhydras: CO2 + H2O H+ + HCO3Effektivitet: En molekyl kolsyraanhydras omvandlar 106 CO2 per sekund. - Succinatdehydrogenas: Succinat + FAD Fumarat + FADH2 Effektivitet: En molekyl succinatdehydrogenas omvandlar 20 succinat per sekund Hur kan ett enzym få en reaktion att gå fortare? En av drivkrafterna för kemiska reaktioner är strävan mot energiminimum, d v s produkterna har lägre energiinnehåll än reaktanterna. För att starta reaktionen måste dock en viss mängd energi tillföras, AKTIVERINGSENERGIN, EA. Se sid. 223. Enzymet sänker alltså aktiveringsenergin och då går reaktionen fortare. - substratet hålls i närheten av och rätt orienterat gentemot grupper i enzymet som medverkar i katalysen Enzymer är specifika: Enzymer reagerar bara med ett ämne eller en ämnesgrupp (substrat): Substrat Ex. Ureas urea Alkoholdehydro alkoholer genas De flesta enzymnamn slutar med ändelsen –as. Substratet binds till enzymets aktiva yta som ofta är en klyfta eller ett hålrum inne i enzymet. Polypeptidkedjans ihopveckning ger en tredimensionell form som gör att endast substrat med ”rätt” struktur kan binda till enzymet och ge vissa produkter. E + S –> ES –> E + P Enzymer kan blockeras: Ämnen med en struktur som liknar substratet kan ibland binda till enzymet och blockera dess aktiva yta. Ett sådant ämne kallas INHIBITOR. Detta kan utnyttjas medicinskt: * Stafylokocker kan bekämpas med sulfapreparat: Se sid. 223. -Bakterierna behöver p-aminobensoesyra för sin tillväxt -4-aminobensensulfonamid har liknande struktur och kan blockera ett enzym som är nödvändigt för bakterietillväxten. * Personer som metanolförgiftats ges stora mängder etanol: CH3OH metanol CH3CH2OH etanol Koenzymer: Många enzymer måste för att fungera ha hjälp av koenzymer. Koenzymerna är reversibelt associerade till enzymerna till skillnad mot prostetiska grupper som är fast bundna. Vanliga koenzymer: - NAD+ (nikotinamidadenindinukleotid) Binder till dehydrogenaser, d v s enzymer som tar bort väte från ett substrat. - FAD ( flavinadenindinukleotid) Fungerar också som väteacceptor. Flera B-vitaminer är förstadier till koenzymer (NAD+, niacin; FAD, riboflavin). Prostetisk grupp Många proteiner innehåller andra kemiska grupper än aminosyror. När en sådan grupp är fast bunden och har avgörande betydelse för proteinets funktion kallas den PROSTETISK GRUPP. Ex. Hemgruppen i hemoglobin är en prostetisk grupp