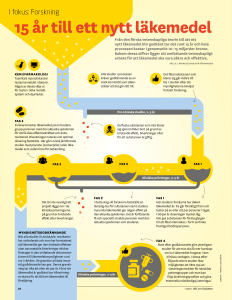
Ansökningsblankett
advertisement

Ansökan om tillstånd att ställa ett icke godkänt läkemedel till förfogande för användning av humanitära skäl (compassionate use) enligt artikel 83 i förordning 726/2004. Compassionate use programme (CUP). Ansökningsblanketten skickas elektroniskt till: [email protected] Sökandei Namn Företag (inkl. organisationsnummer) Adress Telefon/Fax E-post Kontaktperson, om annan än sökande (denna information kommer att läggas ut på Läkemedelsverkets externa webbplats vid ev. godkännande av CUP) Ansökanii 1. Läkemedlet tillhör kategorin av läkemedel som nämns i artikel 3.1 i förordning (EG) 726/2004 (dvs. läkemedel som måste gå via central godkännandeprocedur) eller 2. Läkemedlet tillhör kategorin av läkemedel som nämns i artikel 3.2 i förordningen Om JA på fråga 2, ange vilken/vilka omständigheter som gäller: a) läkemedlet innehåller en ny aktiv substans eller b) läkemedlet innebär en väsentlig terapeutisk, vetenskaplig eller teknisk innovation eller c) ett godkännande är av intresse för patienthälsan på EU-nivå SAMT 3. Klinisk(a) prövning(ar) pågår med läkemedlet Om JA, ange EudraCT-nummer eller Universal Trial Number (UTN) och/eller 4. Ansökan om godkännande för försäljning av läkemedlet har lämnats in till EMA Om JA, ange referensnummer och datum då ansökan lämnades in SAMT 5. Patientgrupp/indikation som avses att behandlas enligt artikel 83.2 i förordningeniii antingen a) kroniskt eller allvarligt försvagande/handikappande sjukdom (ange vilken) eller b) livshotande sjukdom (ange vilken) och som inte kan behandlas på ett tillfredsställande sätt med ett godkänt läkemedel 6. Substansnamn eller motsvarande beteckning på läkemedlet Klinisk(a) prövning(ar) pågår i Sverige för samma indikation som anges i CUP JA NEJ JA NEJ JA NEJ JA NEJ JA NEJ JA NEJ Dokumentation som ska bifogas Läkemedelsverket, Enheten för kliniska prövningar och licenser, Ansökningsblankett CUP, version 3, 2016-07-06 Följebrev, daterat och signerat av sökanden Program iii, iv (inkl. versionsnummer och datum), daterat och signerat av sökanden Aktuell prövarhandbok (Investigator’s Brochure, IB)v (inkl. versionsnummer och datum) Aktuell dokumentation för läkemedlet (Investigational Medicinal Product Dossier, IMPD)v (inkl. versionsnummer och datum) Tillverkningstillstånd och dokument om god tillverkningssed (GMP certifikat m.m.) Patientinformation på svenska (inkl. versionsnummer och datum) En nytta/risk-bedömningvi En försäkran om att läkemedlet kommer att tillhandahållas för patienterna enligt programmetvii Blankett för läkares rapportering av incidenter och allvarliga incidenter till tillståndsinnehavarenviii Intyg om läkemedelsförsäkring under pågående CUP Uppgift om hur läkemedlet kommer att distribueras och märkas Datum: i ii iii iv v vi vii viii Signatur: Ansökan kan lämnas av tillverkaren eller av den som ansöker om godkännande för försäljning av läkemedlet. Alternativ 1 eller 2 måste vara uppfyllt, samt alternativ 3 och/eller 4, samt alternativ 5 a eller b samt c. Den avsedda patientgruppen framgår av artikel 83.2. Det ska bifogas ett program (motsvarande studieprotokoll för klinisk prövning) för läkemedlet för användning av humanitära skäl (compassionate use programme, CUP). Programmet ska ge relevant bakgrundsinformation om läkemedlet inklusive erfarenheter från prekliniska och kliniska studier avseende effekt och säkerhet, information om vilka patienter som ska ingå i programmet, hur läkemedlet ska administreras och doseras, vilka säkerhetsdata som ska samlas från patienterna, hur och när patienterna ska följas upp i programmet samt hur eventuella biverkningar och periodiska säkerhetsrapporterska rapporteras till EudraVigilance-databasen och Läkemedelsverket (se artiklar 28.1 och 28.2 i förordning (EG)726/2004 samt artiklar 107,107a, 107b och 107c i direktiv 2001/83(EG)). IB kan ersätta IMPD med avseende på prekliniska och kliniska data. En sammanställning av resultat från kliniska prövningar på den sökta indikationen ska ligga till grund för nytta/risk-utvärderingen för den berörda patientgruppen. Kan ingå i programmet (se iv ovan) eller i IB. Sökanden ska se till att patienter som omfattas av programmet får tillgång till läkemedlet också under tiden mellan att läkemedlet godkänns och att det släpps ut på marknaden (artikel 83.8 i förordningen). Blankettmallen bör vara utformad i enlighet med blanketten för rapportering av allvarliga incidenter (serious adverse events, SAEs) i kliniska läkemedelsprövningar. Viktig information till den sökande Ansökan måste vara komplett för att Läkemedelsverket ska kunna påbörja sin bedömning. Handläggningstiden är ca 60 dagar. Läkemedelsverket ställer eventuella kompletterande frågor efter ca 30 dagars handläggningstid och frågorna ska besvaras av den sökanden inom 10 dagar. Om ansökan godkänns gäller tillståndet till dess att läkemedlet har släppts ut på den svenska marknaden (dvs. finns tillgängligt på svenska apotek). Om tillståndsinnehavaren önskar avsluta CUP av annan anledning, ska ansökan om detta inskickas till Läkemedelsverket för godkännande (handläggs inom ca 35 dagar). Exempel på sådana anledningar kan vara att det kliniska utvecklingsprogrammet har lagts ned, att företaget gjort bedömningen att nytta/risk-bedömningen har ändrats till att bli negativ eller att företaget fått kännedom om att annan tillfredsställande behandling har blivit tillgänglig på marknaden eller ytterligare andra anledningar. I det fall en annan tillfredsställande behandling har blivit tillgänglig på marknaden, kan en lösning vara att stänga inklusionen av nya patienter i pågående CUP, men tillåta redan inkluderade patienter att få fortsatt behandling inom ramen för CUP fram till dess att CUP-läkemedlet finns tillgängligt på den svenska marknaden. Blanketten ”Ansökan om Väsentlig ändring / Årsrapport / Meddelande om avslutande av compassionate use programme (CUP)” ska användas i dessa fall. Läkemedelsverket, Enheten för kliniska prövningar och licenser, Ansökningsblankett CUP, version 3, 2016-07-06