Incitament 2007-07 Inlaga.indd
advertisement

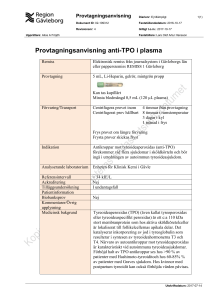
Hur HIV-1 värjer sig från neutraliserande antikroppar: IMPLIKATIONER FÖR VACCINUTVECKLING Förmågan att känna igen och binda främmande strukturer (antigen) är grunden för den adaptiva immuniteten där huvudrollsinnehavarna är våra T- och B-celler. Dessa två celltyper samverkar i kroppens ständiga arbete att kontrollera infektioner och skydda oss mot nyinfektion av mikroorganismer vi tidigare exponerats för. De flesta förebyggande vaccin vi har idag fungerar genom att stimulera kroppens B-celler att producera skyddande antikroppar. Vårt immunsystem har kapacitet att, med stor precision, producera antikroppar mot vilka främmande strukturer som helst. Men vissa virus, exempelvis HIV-1, har utvecklat avancerade mekanismer för att värja sig från antikroppar, vilket ställer höga krav på vaccinutvecklingen. Här beskriver vi fem av de viktigaste skyddsmekanismerna. CHRISTOPHER ERIKSSON DOKTORAND, AVDELNINGEN FÖR VIROLOGI, SMITTSKYDDSINSTITUTET, SOLNA, INSTITUTIONEN FÖR MIKROBIOLOGI, TUMÖR- OCH CELLBIOLOGI, KAROLINSKA INSTITUTET, STOCKHOLM [email protected] MATTIAS FORSELL DOKTORAND, AVDELNINGEN FÖR VIROLOGI, SMITTSKYDDSINSTITUTET, SOLNA, INSTITUTIONEN FÖR MIKROBIOLOGI, TUMÖR- OCH CELLBIOLOGI, KAROLINSKA INSTITUTET, STOCKHOLM, VACCINE RESEARCH CENTER, NATIONAL INSTITUTES OF HEALTH, BETHESDA, USA. [email protected] GUNILLA KARLSSON HEDESTAM DOCENT, AVDELNINGEN FÖR VIROLOGI, SMITTSKYDDSINSTITUTET, SOLNA, INSTITUTIONEN FÖR MIKROBIOLOGI, TUMÖR- OCH CELLBIOLOGI, KAROLINSKA INSTITUTET, STOCKHOLM [email protected] 4Upptäckten att skyddande immunitet kan stimuleras genom vaccination är ett av det viktigaste medicinska genombrotten som gjorts. Genom vaccination kan vi i bästa fall utveckla livslång immunitet utan att ha utsatts för en sjukdomsframkallande natur- FIGUR 1 HIV-1’s höljeprotein består av tre gp120 (blåa) och tre gp41 (bruna) molekyler som sitter ihop som en trimer. Den exponerade ytan av trimeren består till stor del av variabla strukturer (V1-V3) som gömmer CCR5-bindningsytan (ljusorange). Ytan som binder CD4 är delvis exponerad (ljusgrön). Gp41 förankrar trimeren i virusmembranet. Höjeproteinen är även täckta av sockerkedjor, vilka bildar en skyddande sköld för viruset, men har här plockats bort och illustreras istället i figur 5, del 3. lig infektion. Vaccinationer bidrar till den allmänna folkhälsan, till exempel genom barnvaccinationsprogrammet och vaccination mot den årliga influensainfektionen. Det saknas dock fortfarande vaccin mot flera livshotande virussjukdomar. Till exempel finns det, trots mycket intesiv forskning, inget skyddande vaccin mot Humant Immunbristvirus typ 1 (HIV1), en infektion som över 40 miljoner människor världen över lever med idag. Inför World AIDS Day 1 decem- ber 2007 är det därför aktuellt att summera vår kunskap runt problematiken att utveckla ett vaccin som stimulerar bildning av skyddande antikroppar mot HIV-1 och beskriva de olika mekanismerna viruset har utvecklat för att värja sig mot antikroppar. HIV-1: höljeproteiner och receptorer HIV-1 är ett retrovirus vilket innebär att det, vid infektion, omvandlar sin genetiska kod från RNA till DNA. Därefter inkorporeras virusets DNA 8 INCITAMENT 7/2007 535 FIGUR 2 HIV-1 binder först till CD4 (grön) med hjälp av gp120. Det leder till en strukturförändring som exponerar CCR5-bindningsytan (ljusorange) så att CCR5 (orange) kan binda, vilket i sin tur leder till att viruset kan fusera med cellen och inkorporera sin arvsmassa bland cellens. För att förtydliga dessa processer har V1-V3 och sockerkedjorna plockats bort från bilden. FIGUR 3 Strukturmodell av gp120 som de ser ut efter att CD4 bundit baserad på röntgenkristallografidata. De tre olika gp120 molekylerna (blå nyanser) bildar en trimer. Den yta som binder CD4 är färgad ljusgrön och den yta som binder CCR5 är färgad ljusorange. Sockerkedjor som döljer stora delar av gp120 är grå. (Bilden har gjorts med hjälp av data från Leo Kong, Vaccine Research Center, National Institutes of Health, Bethesda, MD, USA). i cellens arvsmassa vilket permanent etablerar viruset i värdcellen. Från cellkärnan kan virusets DNA sen styra cellen att aktivt producera nya viruspartiklar. Det kan också ligga passivt utan att göra någon märkbar skada och kan på så sätt gömma sig i kroppen under den infekterande personens resterande livstid. HIV-1 infekterar huvudsakligen den typ av vita blodceller, så kallade T-hjälparceller, som normalt koordinerar immunförsvaret. De flesta HIV-1-infekterade T-hjälparcellerna dör och detta är huvudorsaken till att immunbrist och AIDS utvecklas i infektionens slutskede. HIV-1 infekterar celler genom att binda till två receptorer; den primära receptorn, CD4, och den sekundära receptorn 536 INCITAMENT 7/2007 FIGUR 4 Neutraliserande antikroppar blockerar virusets förmåga att infektera nya celler, till exempel genom att stoppa viruset från att binda målcellens receptorer. CCR5. Receptorinbindningen sker stegvis och är helt och hållet beroende av virusets höljeproteiner, gp120 och gp41 (Figur 1). Varje funktionellt höljeprotein består av tre gp120 molekyler som är associerade med tre gp41 molekyler i en trimer som sitter infogat i virusmembranet. Det är de funktionella trimererna som viruset använder för att infektera sin målcell. Termen ”funktionell trimer” är en nyckelterm när man talar om skyddande antikroppar mot HIV-1 som vi återkommer till senare. När viruset hittar en målcell binder gp120 först till CD4. Detta leder till en strukturförändring varvid den del av gp120 som ska binda till CCR5 exponeras. Bindning av gp120 till CCR5 leder sedan till ytterligare en struktur- förändring i virusets höljeproteiner, denna gång i gp41, vilket resulterar i en sammanslagning mellan virusmembranet och målcellens membran, så kallad fusion (Figur 2). Efter fusionen kan den infekterade cellen börja producera nya virus. Det vi idag vet om höljeproteinens strukturförändringar vid receptorbindning har vi framförallt lärt oss genom biokemiska och funktionella studier av höljeproteinen. Stora delar av gp120 och gp41 har också strukturbestämts på atomnivå med hjälp av röntgenkristallografi och vi har nu en detaljerad bild av höljeproteinen där vi kan se vilka regioner av gp120 som binder CD4 respektive CCR5 [1, 2] (Figur 3). Denna visar också att stora delar av viruset är täckt av sockerkedjor (glykaner) som plockats upp från värdcellen. Dessa döljer ytor som annars skulle kännas igen av antikroppar. FIGUR 5 HIV-1 har flera skyddsmekanismer för att inte kännas igen av antikroppar. Antikroppar mot HIV-1 Vid en virusinfektion stimuleras oftast ett starkt antikroppssvar, så även vid HIV-1-infektion. Dessa antikroppar har flera funktioner som att blockera infektion av celler (neutraliserande antikroppar) eller att aktivera cellulära funktioner för eliminering och nedbrytning av viruspartiklar (opsonering och fagocytos). Definitionen av en neutraliserande antikropp är en antikropp som förhindrar att ett virus infekterar sin målcell. Klassiska neutraliserande antikroppar binder därför till virusets höljeprotein (inga andra virusproteiner är exponerade på virusets yta) och blockerar dess förmåga att binda till målcellen (Figur 4). Neutraliserande antikroppar bidrar till den skyddande effekten hos de flesta vaccin som finns i kliniken idag. Men en virusinfektion stimulerar också kroppen till att producera en mängd antikroppar som inte ger någon skyddande effekt. Detta är ett av de grundläggande problemen vid HIV-1 infektion. Under de dryga två årtionden som gått sedan upptäckten av HIV-1 har det visats att väldigt få antikroppar som stimuleras vid naturlig infektion är neutraliserande. Tvärtom binder de flesta antikroppar delar av gp120 eller gp41 som inte är exponerade på den ”funktionella trimeren” och de kan därför inte blockera virusinfektion (sammanfattat i [3, 4]). Vid ett fåtal tillfällen har man dock identifierat HIV-1-infekterade personer som har antikroppar som kan blockera infektion mot flera olika HIV-1 varianter [5], så kallade brett neutraliserande antikroppar. Det är bildningen av sådana antikroppar som ett HIV-1 vaccin bör kunna stimulera till för att vara effektivt. Studier har visat att brett neutraliserande antikroppar binder till regioner på gp120 eller gp41 som inte tolererar mutationer, till exempel den yta som binder till CD4 och en viss del av gp41. Brett neutraliserande antikroppar har visats kunna skydda apor mot infektion med ett HIV-1-liknande virus och detta indikerar att sådana antikroppar också skulle kunna skydda människor om de kan stimu- 8 1. GENETISK VARIABILITET: Virus muterar kontinuerligt och de virus som inte känns igen av antikroppar selekteras fram. Kroppen bildar då nya antikroppar som känner igen den muterade virusvarianten, varvid viruset muterar igen för att undkomma de nya antikropparna. 2. INSTABIL INTERAKTION MELLAN GP120 OCH GP41: gp120 faller lätt av trimeren och detta exponerar ytor (röda) som normalt är dolda på insidan av den funktionella trimeren. Antikroppar som binder dessa ytor kan inte neutralisera virusinfektion. 3. GLYKOSYLERING: En stor del av gp120 är dold av en sköld av sockerkedjor (brun). Om en yta exponeras så att en antikropp kan känna igen den muterar viruset så att skölden flyttas och döljer den nya ytan. 4. DYNAMISK STRUKTUR: Gp120 är väldigt flexibel vilket får till följd att det är svårt för immunförsvaret att producera antikroppar som binder till viruset tillräckligt hårt. 5. TILLFÄLLIGT EXPONERADE YTOR: Den konserverade CCR5-bindningsytan på gp120 (ljusorange) är dold innan CD4 binder. När viruset bundit CD4 är det för sent att neutralisera infektionen och antikroppar som binder denna yta är därför ineffektiva. INCITAMENT 7/2007 537 leras fram genom vaccination. För att förstå hur man kan utveckla ett vaccin som stimulerar brett neutraliserande antikroppar är det viktigt att känna till vilka skyddsmekanismer HIV-1 har utvecklat för att undgå antikroppsneutralisation. Fem skyddsmekanismer HIV-1 har flera olika mekanismer som skyddar dem mot neutraliserande antikroppar. Vi har valt att beskriva fem av de viktigaste mekanismerna (Figur 5). 1. GENETISK VARIABILITET Den mest välbeskrivna mekanismen som HIV-1 använder för att värja sig mot neutraliserande antikroppar är genom att kontinuerligt mutera. På gp120 finns variabla strukturer som effektivt stimulerar bildning av antikroppar. Tyvärr tolererar dessa strukturer också ovanligt många mutationer utan att bindningsförmågan till cellen förändras. Viruspopulationen kan således alltid anpassa sig och selektera fram nya varianter där antikropparna inte längre kan binda viruset. Det krävs därför nya antikroppar för varje ny variant och detta fortsätter under hela infektionen (Figur 5, del 1). 2. INSTABIL INTERAKTION MELLAN GP120 OCH GP41 En annan skyddsmekanism HIV-1 har utvecklat för att lura immunförsvaret är att låta interaktionen mellan gp41 och gp120 i virusets hölje vara instabil. Monomerer av gp120 lossnar därför lätt från viruset vilket gör att ytor som inte exponeras på den funktionella trimeren nu stimulerar bildning av antikroppar. Ett exempel på detta är antikroppar som binder till ytor som pekar inåt i trimeren (illustrerat som en röd yta i gp120 i Figur 5, del 2). Sådana antikroppar kan inte binda den funktionella trimeren på själva viruset och de har därför ingen skyddande effekt mot infektionen. 3. GLYKOSYLERING Stora delar av gp120 och gp41 är glykosylerade, dvs de bär på sockerkedjor som sitter fast i proteinen. Sockerkedjorna är producerade av den infekterade cellens eget maskineri och de kommer därför inte att 538 INCITAMENT 7/2007 kännas igen av immunförsvaret. Glykosyleringen är därför ett effektivt sätt för viruset att gömma strukturer som annars skulle stimulera antikroppsbildning. Likt de variabla strukturerna vi beskrivit tidigare ändras viruset kontinuerligt och positionerar sina sockerkedjor på olika sätt för att värja sig från igenkänning av existerande antikroppar (Figur 5, del 3). 4. DYNAMISK STRUKTUR Ett ytterligare bidrag till problemet med att stimulera bildning av neutraliserande antikroppar är att gp120 innehar en hög grad av strukturell flexibilitet och hela tiden varierar mellan många snarlika men ickeidentiska former. Troligen är även detta en skyddsmekanism som har utvecklats för att vilseleda antikroppssvaret (Figur 5, del 4). Flexibiliteten gör att antikroppar måste binda ovanligt hårt för att sitta kvar tillräckligt länge för att blockera infektion av nya celler och det är svårt för kroppen att producera sådana antikroppar. 5. TILLFÄLLIGT EXPONERADE YTOR Som vi nämnt ovan genomgår gp120 en betydlig strukturförändring när det bundits till CD4, vilken leder till att den yta på gp120 som binder CCR5 exponeras. Vid CD4 bindning stabiliseras också gp120 och ändrar form så att viruset kommer åt CCR5 (Figur 5E). Troligen har HIV-1 utvecklats att binda CD4 först och sedan exponera sin CCR5 bindande yta väldigt tillfälligt för att undvika att neutraliserande antikroppar binder ytan innan viruset har hittat sin målcell. Vaccinkoncept I februari 2003 rapporterade företaget Vaxgen Inc. att dess HIV-1 vaccinkandidat, en av de första som testats i människa, inte skyddade mot HIV-1 infektion. Vaccinet, som var baserat på monomeriskt gp120, stimulerade inte brett neutraliserande antikroppar och de kunde därför inte skydda mot alla olika HIV-1 varianter man kan exponeras mot. Med dagens kunskap kan resultatet förklaras genom de mekanismer vi just beskrivit. Nyligen avbröts också ett stort kliniskt försök som drevs av läkemedelsföretaget Merck med stöd av USA’s National Institutes of Health. Mercks vaccinkandidat var avsett att stimulera kroppens T celler men då inget skydd kunde påvisas valde man att avsluta försöket. Dessa misslyckade försök visar på svårigheten med att tillverka ett HIV-1 vaccin men det ska inte tolkas som att det är omöjligt. Framtida försök kommer troligen att fokusera på vaccinkandidater som stimulerar både antikroppar och T cellsimmunitet, där den största utmaningen ligger i att stimulera antikroppar som är brett neutraliserande. Utifrån den kunskap om viruset vi har idag bör det vara möjligt att tillverka vaccinkandidater som har de rätta egenskaperna. Ett exempel är att använda lösliga gp120-gp41 trimerer vilka är konstruerade för att härma strukturen på den funktionella trimeren. Lösliga trimerer består av tre gp120 monomerer och tre (partiella) gp41 monomerer som är stabiliserade som en trimer. Denna konstruktion minimerar exponering av ytor på insidan av trimeren och minskar risken att ickeneutraliserande antikroppar produceras. Genom att modifiera de lösliga trimererna ytterligare försöker man optimera vaccinet så att det stimulerar antikroppar mot den konserverade CD4 bindande ytan, eftersom sådana antikroppar förväntas ha bred neutraliserande aktivitet. Genom en iterativ process där olika rationella modifieringar av de lösliga trimererna kombineras och utvärderas hoppas man kunna producera vaccinkandidater som är effektiva nog för att testas i kliniska försök. Sammanfattning I den här artikeln har vi beskrivit flera mekanismer HIV-1 har utvecklat för att värja sig från antikroppar under naturlig infektion och hur det har resulterat i ett ovanligt motståndskraftigt virus. Flera av dessa mekanismer bidrar till svårigheten att utveckla ett vaccin. Virusets förmåga att skydda sig mot antikroppar kan förklaras av dess till synes oändliga förmåga att generera nya varianter genom mutation vilket i sin tur leder till en kontinuerlig selektion av virus som inte längre känns igen av kroppens immunförsvar. Trots detta finns bevis för att skyddande, brett neutraliserande antikroppar i vissa fall kan produceras vid naturlig infektion; kroppen har alltså kapacitet att producera sådana antikroppar om den bara stimuleras på rätt sätt. Kunskap om virusets höljeproteiner gp120 och gp41, samt en förståelse för hur olika antikroppar binder till dessa, är därför det första steget mot att lyckas tillverka ett effektivt vaccin.9 Författarna tackar Ulla Bredberg, Karolinska Institutet, för goda råd och språkgranskning. Referenser: 1. Kwong, P. D., R. Wyatt, J. Robinson, R. W. Sweet, J. Sodroski, and W. A. Hendrickson. 1998. Structure of an HIV gp120 2. Wyatt, R., and J. Sodroski. 1998. The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens. Science 280: 1884-1888. 3. Burton, D. R., R. C. Desrosiers, R. W. Doms, W. C. Koff, P. D. Kwong, J. P. Moore, G. J. Nabel, J. Sodroski, I. A. Wilson, and R. T. Wyatt. 2004. HIV vaccine design and the neutralizing antibody problem. Nat Immunol 5:233-236. 4. Pantophlet, R., and D. R. Burton. 2006. GP120: target for neutralizing HIV-1 antibodies. Annu Rev Immunol 24:739-769. 5. Li, Y., S. A. Migueles, B. Welcher, K. Svehla, A. Phogat, M. K. Louder, X. Wu, G. M. Shaw, M. Connors, R. T. Wyatt, and J. R. Mascola. 2007. Broad HIV-1 neutralization mediated by CD4-binding site antibodies. Nat Med 13:1032-1034. mabs-medicinska stödstrumpor kkl1 ® mabs Bomull – i det långa loppet Rekommenderas som förstahandsval i de svenska behandlingsriktlinjerna* Epivir & Ziagen i en tablett för kombinationsbehandling av hivinfektion hos vuxna & barn (<12 år). Biverkningsprofil enligt de ingående substanserna Epivir (lamivudin) + Ziagen (abacavir) samt klassdefinierad (NRTI). En fast kombination: 30 tabletter, 300 mg lamivudin + 600 mg abacavir, i burk. ® mabs Tunn Produktresumé se www.fass.se www.hivrapport.nu mabs Förbandsstrumpa ® mabs Benjamin Påtagningshjälpmedel Endast hopen I webs mabs säljs på webshop: www.mabs.se *“Antiretroviral behandling av HIV-infektion 2007, uppdaterad version – Behandlingsrekommendation” finns på www.rav.nu RAV (Referensgruppen för AntiViral terapi) är en oberoende expertgrupp vars styrelseledamöter utses av Svenska Läkaresällskapet och Smittskyddsinstitutet. GlaxoSmithKline AB, Råsundavägen 12, Box 516, 169 29 SOLNA, Tel 08 - 638 93 00, www.glaxosmithkline.se, [email protected] INCITAMENT 7/2007 GSK 09/2007 ® 539