ATT DELTA I EN LÄKEMEDELSPRÖVNING
advertisement

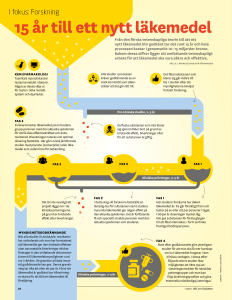
Information om ATT DELTA I EN LÄKEMEDELSPRÖVNING LÄKEMEDELSINFORMATIONSCENTRALEN Läkemedelsinformationscentralen PB 108, 00501 Helsingfors www.laaketietokeskus.fi INNEHÅLL Andra förnyade upplagan (första upplagan 1998) © Läkemedelsinformationscentralen Ab, Helsingfors 2002. Begränsat antal av publikationen kan beställas från Läkemedelsinformationscentralen, PB 108, 00501 Helsingfors eller per e-post: [email protected] I Bäste läsare 4 II Nya mediciner behövs 5 Projekt som kostar nästan en miljard 5 III Säkerhet tack vare preklinisk forskning 5 IV Klinisk läkemedelsprövning 6 V I lag stadgad och övervakad av läkemedelsverket Under den etiska kommitténs uppsyn Viktig information till prövningsdeltagaren 6 6 7 Frivilligt deltagande i läkemedelsprövningar 7 Kontrollering av uppgifter som insamlats Vem kan delta? Bästa möjliga uppföljning Information – en del av säkerheten Kostnader ersätts 8 8 8 9 9 VI Först friska frivilliga, sedan patienter Första fasens prövningar på friska frivilliga Andra fasens prövningar på patienter Tredje fasens prövningar på stora patientgrupper Prövningen kan avbrytas 9 9 10 10 11 VII Nya mediciner medför hälsa, välbefinnande och arbetstillfällen 11 Terminologi 12 3 I BÄSTE LÄSARE Läkemedelsindustrin utvecklar läkemedel till patienternas, läkarnas och hälsovårdens behov. De människor som deltar i de kliniska läkemedelsprövningarna är av avgörande betydelse för hela läkemedelsutvecklingen. Utan alla patienter och frivilliga prövningsdeltagare kan man inte utveckla nya läkemedel och göra dem tillgängliga för omfattande patientgrupper. Den här broschyren är avsedd för dig som överväger att delta eller kanske redan deltar i en klinisk läkemedelsprövning, dvs. en undersökning som görs på människor. I broschyren behandlas läkemedels utveckling. Frågor som broschyren besvarar är bl.a.: Vilka rättigheter har man? Är det tryggt att delta i en läkemedelsprövning? Kan man avbryta deltagandet? Får man lön för att delta? Lagstiftningen förutsätter att den information som tilldelas - prövningsdeltagaren uppfyller höga krav. Den här broschyren ersätter inte den information som prövningsdeltagaren bör få, utan är ett komplement till all annan information. Läs noggrant igenom den information och det dokument för samtycke som din prövare ger dig! LÄKEMEDELSINFORMATIONSCENTRALEN II NYA MEDICINER BEHÖVS Med läkemedel kan man bota eller förebygga sjukdomar, kontrollera sjukdomsförlopp och lindra symptom. Läkemedlens betydelse för vård av sjukdomar är stor och ökar konstant. Även om man numera kan behandla många sjukdomar som förr betydligt försvårade det dagliga livet och nedsatte arbetsförmågan, så utgör många sjukdomar fortfarande stora utmaningar för människosläktet. Många sjukdomar, såsom astma och psykiska sjukdomar, kan numera behandlas så väl att patienterna ofta kan vårdas inom öppen vård istället för sjukhus, vilket är behagligare för patienten och fördelaktigare för samhället. Man försöker som bäst inom medicinsk forskningen utveckla nya läkemedel mot dementerande hjärnsjukdomar och cancer. Det finns fortfarande mängder av sjukdomar, vilkas symptom kan behandlas, men som ännu saknar botemedel. AIDS-forskningen framskrider med stora steg, men man har fortfarande inte kommit fram med botande läkemedel eller vaccin. Andra viktiga forskningsområden är de stora folksjukdomarna, för vilka man söker bättre, effektivare och säkrare läkemedel – följaktligen till lägre totalkostnader för hälsovården. Även den åldrande populationen utgör en stor utmaning för utvecklingen av läkemedel. Projekt som kostar nästan en miljard Läkemedlet kan var en helt ny uppfinning, eller så vidareutvecklar man ett känt läkemedel så att det blir effektivare och har mindre biverkningar. Utvecklingen av ett läkemedel tar 10-15 år i anspråk och kostar i medeltal 895 miljoner euro. Även om god tur och slump ännu kan bidra till uppfinning av nya läkemedel, är största delen av de nya läkemedlen resultat av systematisk forskning. I början av utvecklingsskedet har man tusentals potentiella nya läkemedelsmolekyler, som så småningom gallras tills man har kvar de mest lovande molekylerna. Dessa molekyler testas vidare i prekliniska försök. III SÄKERHET TACK VARE PREKLINISK FORSKNING Med prekliniska försök avser man alla försök som görs innan man får ge läkemedlet till människor. Med försöken kartlägger man hur läkemedlet fungerar, men framför allt, om det potentiella nya läkemedlet är säkert. De prekliniska studierna tar oftast år i anspråk. Man gör försök med celler och mikrober i provrör, isolerade organ och 4 5 försöksdjur samt dessutom med hjälp av datorsimulering. Trots att prekliniska försök ofta utförs med alternativa metoder, kan tills vidare endast djurförsök ge en tillräckligt bra bild av hur läkemedlet verkar i ett levande system som helhet. I det här skedet påbörjas även läkemedlets produktutveckling, dvs. vilken form läkemedlet skall ges till patienterna och hur preparatet skall kunna framställas industriellt. IV KLINISK LÄKEMEDELSPRÖVNING En klinisk läkemedelsprövning är en undersökning av ett läkemedels effekt på människan samt hur läkemedlet tas upp, fördelas, sönderdelas och utsöndras ur människokroppen. Kliniska prövningar påbörjas först då de prekliniska undersökningarna påvisat att läkemedlet är väl tolererat och förväntningarna på det nya läkemedlet fyllts. Kliniska läkemedelsprövningar påbörjas endast i sådana fall, då man kan anta att läkemedelsbehandlingen är säker och effektiv samt att den färdiga produkten blir ekonomiskt lönande. I lag stadgad och övervakad av Läkemedelsverket Då kliniska läkemedelsprövningar utförs på människor skall läkemedelslagen, lagen om medicinsk forskning, lagen om patienternas ställning och rättigheter samt personuppgiftslagen efterföljas. Andra viktiga riktlinjer är de internationella anvisningarna om medicinsk forskning såsom Världsläkarförbundets Helsingforsdeklaration gällande biomedicinsk forskning samt för kliniska läkemedelsprövningar utfärdade anvisningar för god klinisk sed, GCP (good clinical practice). Läkemedelsprövningar bör alltid förhandsanmälas till Läkemedelsverket. Läkemedelsverket förutsätter en detaljerad plan på prövningen och godkänner den endast om goda medicinska grunder föreligger och prövningen utförs ändamålsenligt, säkert och kompetent. Under den etiska kommitténs uppsyn Innan prövningen inleds skall ett uttalande skrivet av en oberoende etisk kommitté lämnas in till Läkemedelsverket. Den etiska kommittén består av både läkare och lekmän. Kommitténs uppgift är att bevaka prövningsdeltagarnas rättigheter, säkerhet och välbefinnande. Den etiska kommittén bedömer om förhållandet mellan eventuell risk och eventuell nytta för individen är acceptabel. Prövningen kan påbörjas endast om personen som ansvarar för prövningen är legitimerad läkare eller tandläkare med tillräcklig yrkesmässig och vetenskaplig kompetens. Den etis6 ka kommittén bör i sitt uttalande ta ställning till huruvida den kliniska prövningen är etiskt godtagbar. Viktig information till prövningsdeltagaren En grundförutsättning för deltagande i en klinisk läkemedelsprövning är frivilligt, medvetet samtycke att delta. Prövningsdeltagaren bör få en tillräcklig utredning över sina rättigheter, prövningens syfte och karaktär och de metoder som används. Prövningsdeltagaren bör också få en tillräcklig utredning över eventuella biverkningar och risker. Ifrågavarande information skall ges både muntligt och skriftligt. Samtyckesdokumentet innehåller all väsentlig information om prövningen och den muntliga informationen skall komplettera den skriftliga. Prövningsdeltagaren har möjlighet att ställa frågor och få sina frågor besvarade. All information bör ges på ett sådant sätt, att prövningsdeltagaren säkert förstår informationen och kan på basen av den erhållna informationen avgöra om han eller hon vill delta eller inte. Ibland händer det att personen som skall undersökas omöjligt kan ge sitt samtycke, t.ex. en hjärninfarktpatient, prematur eller psykospatient, som inte kan uttrycka sin egen vilja. I sådana fall kan den etiska kommittén godkänna ett förfarande, där en nära anhörig tar ställning till eventuellt deltagande i en prövning. Utan dylika alternativ kan man inte utveckla nya läkemedel till t.ex. spädbarn eller psykiskt sjuka. V FRIVILLIGT DELTAGANDE I LÄKEMEDELSPRÖVNINGAR De kliniska läkemedelsprövningarna delas in i fyra olika faser. Prövningsdeltagaren har samma rättigheter oberoende av fas. Deltagandet i en läkemedelsprövning är fullständigt frivilligt och baserar sig på samtycket att delta. Prövningsdeltagaren har rätt att när som helst och utan att uppge orsak återta sitt samtycke. Avbrutet deltagande påverkar inte relationen till läkaren eller den fortsatta behandlingen. Deltagandet i prövningen träder i kraft först då det skriftliga samtyckesdokumentet undertecknas. Före det bör prövningsdeltagaren ha fått tillräcklig information om prövningen och ha haft god tid att bekanta sig med informationen. Ett muntligt löfte att delta är inte bindande. Endast genom att underteckna samtyckesdokumentet samtycker prövningsdeltagaren till att frivilligt delta i prövningen. Samtycket innebär också att man får samla in och behandla uppgifter om prövningsdeltagaren och att den in7 formationen i kodad form kan föras utanför Finlands gränser. I samtyckesdokumentet betonas vidare det faktum, att informationen behandlas konfidentiellt. Samtycke att delta i en prövning innebär inte att prövningsläkaren befrias från sitt ansvar för patienten. Läkaren bär alltid ansvar för prövningsdeltagaren. Kontrollering av uppgifter som insamlats Myndigheterna som ansvarar för läkemedelskontroll och säkerhet har rätt att kontrollera att den insamlade prövningsinformationen är korrekt och att prövningen utförts på ett sakenligt sätt samt att prövningsdeltagarna är riktiga personer. Detta görs genom att jämföra de uppgifter som insamlats vid prövningen med de ursprungliga journalanteckningarna och annat prövningsmaterial. Moderna läkemedel utvecklas för världsomfattande bruk och därför undersöks läkemedlen samtidigt i många länder. Därför ges i samtycket motsvarande rätt att kontrollera uppgifterna till andra länders läkemedelsmyndigheter och uppdragsgivarens representanter. Samtycke att delta innebär dock inte att all hälsoinformation får kontrolleras. Samtycket gäller enbart de uppgifter som berör den aktuella prövningen och all information behandlas konfidentiellt. Även om prövningsdeltagaren avslutar studien, kvarblir de uppgifter som insamlats som en del av prövningens helhetsdata. På så sätt kan myndigheterna försäkra sig om att man inte avsiktligt uteslutit personer som fått allvarliga biverkningar av läkemedlet eller p.g.a. utebliven effekt. Vem kan delta? Kraven på deltagande i en klinisk läkemedelsprövning varierar beroende på vilket läkemedel som undersöks och på prövningen. Den ledande principen är att undvika onödiga risker: om prövarna misstänker att en person kan ta skada av att delta, tas han eller hon för säkerhets skull inte med i prövningen. Först undersöks friska personer och sedan personer som har den sjukdom som man vill diagnostisera, förebygga eller behandla med det nya läkemedlet. I praktiken är det svårt att hitta personer med endast en sjukdom, vilket leder till att man i prövningsplanen definierar speciella kriterier, (t.ex. någon speciell sjukdom eller ålder), på basen av vilka man av säkerhetsskäl inte kan delta i prövningen. Bästa möjliga uppföljning Fördelen med att delta i en prövning är att deltagarens hälsotillstånd uppföljs mycket noggrant både genom olika un8 dersökningar och laboratorieprover. Vid behov kan prövningsdeltagaren och någon annan vårdande läkare kontakta prövningsläkaren. Information – en del av säkerheten Det är önskvärt att prövningsdeltagaren överväger sitt deltagande så väl, att han eller hon verkligen deltar ända till prövningens slut. Det kan man trots allt under inga omständigheter kräva, utan prövningsdeltagaren kan när som helst avsluta studien utan att det inverkar på hans eller hennes fortsatta vård. Prövaren är dessutom beredd på att flyttning, nytt jobb eller förändrad livssituation överhuvudtaget gör att prövningsdeltagaren upplever att fortsatt deltagande är för besvärligt. Det är viktigt att prövningsdeltagaren noga följer instruktioner om t.ex. när läkemedlet skall intas både för prövningsresultatens giltighets och för egen säkerhets skull. Det är också möjligt att man måste undvika något födoämne eller att alkoholförbrukning är förbjuden under prövningens gång. Under prövningens gång måste prövningsdeltagaren också regelbundet besöka t.ex. laboratorier och prövarens mottagning. Om prövningsdeltagaren inte följer instruktionerna avbryts prövningen för hans eller hennes del. Kostnader ersätts Läkemedelsföretagen står för alla extra utgifter, som beror på deltagandet i prövningen, t.ex. extra besök hos läkare eller i laboratorium. Enligt lag kan endast friska frivilliga få ersättning för deltagande i prövningar. Denna ersättning för tid och besvär som deltagandet orsakat fastställs av myndigheterna och är beskattningsbar inkomst. VI FÖRST FRISKA FRIVILLIGA, SEDAN PATIENTER Första fasens prövningar på friska frivilliga I den kliniska läkemedelsforskningens första fas ges det potentiella läkemedlet för första gången till människa. I dylika prövningar deltar endast några tiotal friska frivilliga. Den första fasens prövningar utförs vanligen på universitetssjukhus eller forskningsenheter under mycket sträng kontroll. Avsikten är att få preliminär information om hur läkemedlet tolereras och verkar i människokroppen. Med tolerans avses här hur väl människan tål läkemedlet och om eventuella biverkningar uppkommer. Man kan bl.a. genom att mäta läkemedlets koncentration i blodet få information om hur ämnet påverkar organismen och tvärtom. 9 Läkemedlet ges till en början i ytterst små doser. Doserna höjs och behandlingstiden förlängs vartefter man får erfarenhet av medlets verkan. Ibland måste även första fasens prövningar utföras på patienter som har den undersökta sjukdomen. Så är fallet om det undersökta läkemedlet av etiska eller andra skäl inte kan ges till friska människor. Dylika läkemedel är t.ex. cytostater, som används vid behandling av cancer och som är skadliga för friska människor. Om man undersöker cytostater kan följaktligen endast cancerpatienter, som inte kan erbjudas annan effektiv behandling, delta i prövningen. Dödssjuka patienter har precis samma rättigheter som övriga deltagare i prövningar. Andra fasens prövningar på patienter I andra fasens prövningar deltar för första gången patienter. Även dessa prövningar görs vanligtvis på sjukhus och under noga kontrollerade omständigheter. I prövningarna deltar från några tiotal till några hundra personer. Det är vanligtvis den vårdande läkaren som erbjuder möjlighet att delta, men ibland söker man också deltagare per annons. I den andra fasens prövningar undersöker man läkemedlets effekt och säkerhet. En av de viktigaste frågorna man försöker besvara är hur läkemedlets dos och effekt korrelerar, dvs. hitta den rätta dosen. I den andra fasens prövningar jämför man ibland också det nya läkemedlet med en placebo, dvs. en tablett som inte innehåller aktivt läkemedel. Patienterna delas slumpmässigt in i grupper, av vilka den ena får aktivt läkemedel och den andra inaktivt placebo. Genom att jämföra placebon och det aktiva läkemedlet får man fram den verkliga eller uteblivna effekten. Läkarens och patientens förväntningar kan annars leda till att man ser effekter som eventuellt inte finns. Det finns dock många sjukdomar som inte tillåter användning av placebo, eftersom patienterna inte kan vara utan medicinering. Tredje fasens prövningar på stora patientgrupper I den tredje fasens prövningar ingår t.o.m. tusentals personer. Dessa personer borde så väl som möjligt motsvara den kommande användargruppen. I tredje fasens prövningar försäkrar man sig om att tidigare forskningsresultat stämmer och samlar in ytterligare information om läkemedlets säkerhet, speciellt med tanke på långtidsbruk. Ett typiskt sätt att utföra tredje fasens prövningar är att jämföra prövningspreparatet med något existerande läkemedel, som man anser vara bäst vid behandling av den aktuella sjukdomen. Man genomför prövningarna dubbelblint, dvs. så att varken läkare eller patient vet vilket av läkemedlen som den enskilda patienten får. Den informationen får man 10 efter prövningens slut. Läkaren har visserligen vid behov tillgång till informationen även under prövningens gång. Det nya läkemedlet anses lyckat om det är bättre eller säkrare än existerande läkemedel. Prövningen kan avbrytas Läkemedelsverket, den etiska kommittén, läkaren som ansvarar för prövningen eller det uppdragsgivande läkemedelsföretaget kan också avbryta prövningen av säkerhetsskäl om så krävs. I längre prövningar tar oberoende expertgrupper under prövningens gång dessutom ställning till om det nya läkemedlet är betydligt bättre eller sämre än det nya läkemedlet. Om väsentliga skillnader kan påvisas, avbryts prövningen och alla deltagare erbjuds det bättre läkemedlet. VII NYA MEDICINER MEDFÖR HÄLSA, VÄLBEFINNANDE OCH ARBETSTILLFÄLLEN De olika utvecklingsfaserna tar många år i anspråk. Efter att de kliniska prövningarna slutförts är man ännu tvungen att vänta ganska länge på att läkemedlet eventuellt får försäljningstillstånd. Därför är det möjligt att den enskilda patienten inte personligen får höra om prövningens resultat trots att deltagandet i prövningen värdesätts högt. Forskare i Finland deltar aktivt i internationell läkemedelsforskning, vilket innebär att vårt land är med i främsta ledet då det gäller medicinsk forskning. Finländska prövare har deltagit i läkemedelsprojekt som ger miljoner människor runtom i världen en bättre livskvalitet. Alla de tiotusentals män och kvinnor som deltagit i olika läkemedelsprövningar förtjänar ett tack för sin insats. I Finland deltog år 2001 mer än 58000 frivilliga personer i så många som 523 olika läkemedelsprövningar. Läkemedelsindustrin i Finland satsade över 200 miljoner euro på forskning och produktutveckling. Enbart inom läkemedelsindustrin sysselsatte läkemedelsprövningarna 437 personer. 11 TERMINOLOGI ”Cross-over” studie • Ett tillvägagångssätt vid t.ex. jämförande läkemedelsprövningar: efter första behandlingsperioden låter man patientgrupperna byta preparat. Dubbel-blind studie (double-blind) • En studie där varken patient eller läkare under studien vet om ett preparat innehåller verksam substans eller ej. Etisk kommitté • Nationell eller regional, oberoende kommitté, som består av yrkesutbildade personer inom hälso- och sjukvård samt medlemmar som inte har medicinsk bakgrund. Kommitténs uppgift är att bevaka prövningsdeltagarens rättigheter, säkerhet och välbefinnande. Kommittén ger ett uttalande om prövningsplanen, prövarnas lämplighet, apparatur, samt om metoder och material, som används som grund för samtycke till deltagande. De oberoende etiska kommittéernas verksamhet är lagstadgad. Genetisk • Som avser arvsanlag, ärftlighet eller härstamning. God klinisk sed (good clinical practice, GCP) • Anvisningar som omfattar planering, utförande, dokumentering, verifiering, analysering och rapportering av kliniska läkemedelsprövningar. Anvisningarna avser vidare försäkra att insamlad information och rapporterade resultat är trovärdiga och exakta samt att man försäkrat sig om deltagarens rättigheter, integritet och konfidentialitet. Interaktion • Samverkan, växelverkan t.ex. mellan olika läkemedel som inverkar på varandras effekter så att de samordnar och/eller motverkar varandra. Klinisk • Som hör till eller avser direkt sjukvårdande verksamhet; praktisk medicin. Farmakodynamik • Läran om läkemedlens verkningar och verkningsmekanismer på organsystemet, organ och celler. Klinisk farmakologi • Tillämpning av farmakologin (läkemedelsläran) inom sjukvården. Farmakokinetik • Läran om läkemedels omsättning i människokroppen, dvs. hur de tas upp, fördelas, metaboliseras och utsöndras. Kontrollerad prövning • Prövning där patienterna fördelas i en grupp som behandlas med det nya läkemedlet och en grupp som behandlas med något annat känt läkemedel eller placebo. Farmakologi • Läkemedelslära, den medicinska vetenskapsgren som kartlägger hur läkemedlen verkar (farmakodynamik) och hur de omsätts i kroppen (farmakokinetik). Se även klinisk farmakologi. Fas • Skede, period; i läkemedelsprövningar faser I – IV (fas I: begränsade studier vanligtvis på friska, frivilliga deltagare, fas II: små studier på patienter, fas III: omfattande studier på patienter, fas IV: studier efter att läkemedlet fått försäljningstillstånd). Generiskt namn • Namn på aktiva läkemedelssubstansen, säljs under olika handelsnamn. 12 Metabolism • Ämnesomsättning, leverns sönderdelning eller omvandling av läkemedlet. Molekylärbiologi • Den del av biologin som handlar om cellens byggnad, funktion och reglering; läran om livet på molekylär nivå. Placebo • Preparat som liknar ett läkemedel men saknar verksamma beståndsdelar. Används vid testning av läkemedel. Profylax • Samlingsnamn för åtgärder för att förhindra eller förebygga sjukdom. 13 Randomisering, randomiserad • Att slumpmässigt dela upp ett material; ett nödvändigt förfaringssätt för att jämförelse mellan olika behandlingsformer eller läkemedel (aktivt preparat vs. annat läkemedel eller placebo) skall bli rättvisande. Respons • Svar, gensvar; reaktion i organismen på en retning (stimulus), behandling eller läkemedel. Toxicitet • Giftighet, giftverkan. Toxikologi • Läran om gifter och förgiftningar. 14