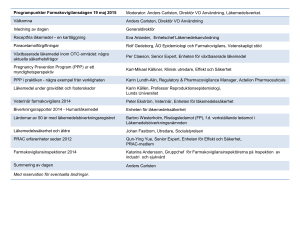
Kommunikation kring läkemedelssäkerhet
advertisement

Kommunikation kring läkemedelssäkerhet En förstudierapport från Läkemedelsverket 2015-04-27 Postadress/Postal address: P.O. Box 26, SE-751 03 Uppsala, SWEDEN Besöksadress/Visiting address: Dag Hammarskjölds väg 42, Uppsala Telefon/Phone: +46 (0)18 17 46 00 Fax: +46 (0)18 54 85 66 Internet: www.lakemedelsverket.se E-mail: [email protected] Sida: 1(31) Innehåll 1 SYFTE, TOLKNING, AVGRÄNSNINGAR OCH GENOMFÖRANDE .............................................. 3 1.1 1.2 1.3 1.4 2 UPPDRAGETS SYFTE................................................................................................................................... 3 TOLKNING AV UPPDRAGET ........................................................................................................................ 3 AVGRÄNSNINGAR ...................................................................................................................................... 4 GENOMFÖRANDE ....................................................................................................................................... 4 NULÄGE OCH MOTIV TILL UTVECKLINGEN ................................................................................. 4 2.1 PATIENTSÄKERHET .................................................................................................................................... 5 2.1.1 Läkemedelssäkerhet, ett viktigt område för patientsäkerheten i Sverige ......................................... 5 2.1.2 Patientsäkerhetskultur och ett systematiskt lärande ....................................................................... 5 2.2 TEKNISK UTVECKLING OCH TILLGÄNGLIGGÖRANDE AV OFFENTLIG INFORMATION ................................... 6 2.3 NATIONELLA AKTIVITETER INOM OMRÅDET LÄKEMEDELSSÄKERHET ....................................................... 8 2.3.1 Författningar ................................................................................................................................... 8 2.3.2 Tillsyn, rapportering och anmälan av skador ................................................................................. 9 2.3.3 Nationella strategier ..................................................................................................................... 10 2.3.4 Uppföljning inom patientsäkerhetsarbete ..................................................................................... 10 2.3.5 Information och utbildning............................................................................................................ 11 2.4 MER OM LÄKEMEDELSVERKETS UPPDRAG INOM LÄKEMEDELSSÄKERHET .............................................. 11 2.4.1 Läkemedelsverkets ansvar ............................................................................................................. 11 2.4.2 Förändringar i lagstiftning om säkerhetsövervakning av läkemedel ............................................ 12 2.5 KOMMUNIKATION OM LÄKEMEDELSSÄKERHET ....................................................................................... 14 2.5.1 Vem arbetar med data, information och rapportering inom läkemedelssäkerhet? ....................... 14 2.5.2 Läkemedelsverkets säkerhetskommunikation ................................................................................ 17 2.5.3 Internationella exempel ................................................................................................................. 19 2.6 ERFARENHETER FRÅN ARBETET MED ”LÄKEMEDELSSÄKERHET 2013” ................................................... 20 2.7 SAMRÅD OCH INTRESSENTSEMINARIER ................................................................................................... 22 2.7.1 Internt samråd ............................................................................................................................... 22 2.7.2 Aktörer som informerar inom området läkemedelssäkerhet ......................................................... 22 2.7.3 Representanter som företräder hälso- och sjukvårdspersonal ...................................................... 23 2.8 UPPFÖLJNING AV SÄKERHETSKOMMUNIKATION ...................................................................................... 23 3 BEHOV OCH FÖRESLAGNA INSATSOMRÅDEN ............................................................................ 25 3.1 BEHOV..................................................................................................................................................... 25 3.1.1 Hälso- och sjukvårdens behov....................................................................................................... 25 3.1.2 Läkemedelsverkets behov .............................................................................................................. 26 3.2 FÖRESLAGNA INSATSOMRÅDEN FÖR VIDAREUTVECKLING ...................................................................... 27 3.3 FÖRVÄNTAD NYTTA................................................................................................................................. 29 4 SLUTSATSER FRÅN FÖRSTUDIEN .................................................................................................... 30 Sida: 2(31) SAMMANFATTNING Läkemedelssäkerhet är en viktig del av patientsäkerhetsarbetet. Enligt 2014 års regleringsbrev ska Läkemedelsverket inom ramen för en förstudie utreda behov av vidareutveckling av Läkemedelsverkets kommunikation om läkemedelssäkerhet med hälso- och sjukvårdspersonal och berörda beslutsfattare som målgrupp. Läkemedelsverket har redan idag en omfattande säkerhetskommunikation som beskriver balansen mellan nytta och risk för läkemedel. Utifrån nulägesanalys och samråd med representanter för hälsooch sjukvårdspersonal identifierades följande behov, som skulle kunna mötas av en vidareutveckling av kommunikationen: Säkerhetsinformation som är tillgänglig via de systemstöd som hälso- och sjukvårdspersonal använder i sitt dagliga arbete, som journalsystem och apotekens expedieringsstöd. Lättillgänglig information om läkemedelssäkerhet ur ett brett perspektiv, som är satt i ett kliniskt relevant sammanhang. Informationsmaterial som är användbara i utbildnings- och fortbildningssammanhang. Hälso- och sjukvårdspersonal är en mycket bred målgrupp. Utifrån profession, verksamhet och arbetsuppgifter kan behovet av information se mycket skiftande ut. Befintliga strukturer för kunskapsspridning inom olika verksamheter och hälso- och sjukvårdspersonalen själva behöver därför kunna selektera information utifrån behov, vilket ställer krav på informationsstruktur. Det är också viktigt att information om läkemedelssäkerhet kan nås via flera olika kommunikationskanaler. Tre insatsområden föreslås för vidareutveckling av Läkemedelsverkets information om läkemedelssäkerhet: Säkerhetsinformation maskinläsbart format: Målsättningen är att kunna tillgängliggöra ytterligare informationen så att den kan distribueras vidare av andra aktörer via exempelvis journalsystem och apotekens expedieringssystem. Strukturerad säkerhetsinformation via Läkemedelverkets externa webbplats: Målsättningen är att tillgängliggöra säkerhetsinformation som är anpassad för att öka medvetenheten om läkemedelssäkerhet ur ett brett perspektiv hos hälso- och sjukvårdspersonal. Detta inkluderar återkoppling kring aktuella säkerhetsutredningar som beskriver nyttan och riskerna med läkemedelsbehandlingen. Kunskapsfrämjande insatser: Målsättningen är att tillgängligöra informationsmaterial om läkemedelssäkerhet som är anpassade för att integreras i olika utbildnings- och fortbildningssammanhang. I samband med en vidareutveckling bör rutiner för en strukturerad och återkommande uppföljning av säkerhetskommunikation införas. Samverkan mellan folkhälsomyndigheter och hälso- och sjukvård är av stor vikt för fortsatt arbete. Både vidareutvecklingen i sig och följande förvaltning är resurskrävande, och långsiktig finansiering är en förutsättning för genomförande. Kommunikation om läkemedelssäkerhet riktad till hälso- och sjukvårdspersonal är en central del i Läkemedelsverkets uppdrag. Genom en vidareutveckling av kommunikationen kan den ytterligare anpassas utifrån målgruppens behov av tydlig och lättillgänglig säkerhetsinformation, samt anpassas för att främja ett systematiskt lärande på området. Sida: 3(31) 1 SYFTE, TOLKNING, AVGRÄNSNINGAR OCH GENOMFÖRANDE 1.1 Uppdragets syfte Syftet med förstudien är att utreda behov av vidareutveckling av Läkemedelsverket kommunikation om läkemedelssäkerhet. Uppdraget utgår från 2014 års regleringsbrev1: Läkemedelssäkerhetsrapport Läkemedelsverket ska utveckla en årlig rapportering till svensk hälso- och sjukvårdspersonal och berörda beslutsfattare, Läkemedelssäkerhetsrapporten. Rapporteringen ska utformas på ett sådant sätt att den är tydlig, lättillgänglig och främjar ett systematiskt lärande. Läkemedelsverket ska under 2014 genom en förstudie beskriva hur kommunikationen kring läkemedelssäkerhet behöver utvecklas för att nå målet med Läkemedelssäkerhetsrapporten. Under 2014 ska även en delstudie innehållande säkerhetsdata från 2013 publiceras. 1.2 Tolkning av uppdraget Uppdraget kring utförandet av förstudien har tolkats som att: Målgruppen för rapporteringen är ”svensk hälso- och sjukvårdspersonal och berörda beslutsfattare”. Patientsäkerhetslagens (2010:659) definition av hälso- och sjukvårdspersonal har använts. ”Läkemedelssäkerhet” används som ett försvenskat alternativ till EMA:s och WHOs definition av farmakovigilans: “Science and activities relating to the detection, assessment, understanding and prevention of adverse effects or any other medicine-related problem”. På engelska används på motsvarande sätt ”drug safety” som en synonym till ”pharmacovigilance”. I 2014 års regleringsbrev angavs utveckling av en årlig rapportering. Under förstudiearbetet har det blivit klart att det som är av betydelse för målgruppen är att rapporteringen är återkommande, men inte nödvändigtvis att tidsintervallet skulle vara begränsat till årligen. Benämningen ”säkerhetskommunikation” används som motsvarande till vad som i EMA:s riktlinjer (GVP, module XV2) benämns ”safety communication”. Säkerhetskommunikation inkluderar: 1) Grundläggande information om läkemedel, inklusive lagstadgad information i produktresuméer, bipacksedlar, offentliga utredningsrapporter och märkning av förpackningar. 2) ”New or emerging safety information”, som här benämns ”säkerhetsinformation av akut art”, omfattar nytillkommen information om tidigare kända eller hittills oidentifierade risker med ett läkemedel som påverkar eller skulle kunna påverka nytta-riskbalansen eller hur läkemedlet används. Exempel på säkerhetsinformation av akut art är nytillkommen information om säkerhetsutredningar, information om indragningar motiverade av säkerhetsaspekter, särskilt viktiga uppdateringar av produktinformation (exempelvis ändring av kontraindikation eller dosering), information om kvalitetsproblem, problem med förväxlingar eller andra problem i samband med läkemedelshantering. För en säker och rationell användning av läkemedel krävs ytterligare information, nämligen 1 Utdrag ur Regleringsbrev för budgetåret 2014 avseende Läkemedelsverket (S2012/4488/FS och S2013/9047/SAM (delvis)). 2 Guideline on good pharmacovigilance practices (GVP), Module XV – Safety communication, 2013, EMA, EMA/118465/2012. Sida: 4(31) aggregerad information som omfattar exempelvis bearbetade statistiska rapporter och informations- och utbildningsmaterial. I denna förstudie benämns denna typ av information som ”kunskapsfrämjande rapportering”. Den beskriver till exempel hur säkerhetsövervakning av läkemedel går till, hur man kan understödja säkra och rationella läkemedelsprocesser och ger på en aggregerad nivå information om olika säkerhetsaspekter i förhållande till nyttan med läkemedelsbehandlingen. Syftet med den aggregerade informationen om läkemedelssäkerhet är att främja lärande och att skapa beredskap för att kunna tolka och agera utifrån säkerhetsinformation av akut art. 1.3 Avgränsningar Förstudien avhandlar endast humanläkemedel. Syftet med förstudien är inte att ge tekniska lösningsförslag. 1.4 Genomförande Förstudien omfattar följande delar: Nulägesanalys som beskriver aspekter som påverkar Läkemedelsverkets beslut om vidareutveckling av kommunikation inom läkemedelssäkerhet. Inventering av datakällor, informationskällor och aggregerad information inom området läkemedelssäkerhet. Samråd med medarbetare inom Läkemedelsverket. Intressentseminarier med företrädare för målgruppen hälso- och sjukvårdspersonal och med andra aktörer som arbetar med att förmedla kunskapsfrämjande rapportering inom området läkemedelssäkerhet. Analys av erfarenheterna från rapporten ”Läkemedelssäkerhet 2013”. Analys av aspekter som påverkar hur en vidareutveckling skulle kunna ske utifrån målgrupp, format, möjliga kommunikationskanaler och behov av uppföljning. De behov av en vidareutveckling som identifierats i förstudiens olika delar har sammanställts och analyserats. Utifrån dessa har sedan ett förslag på insatsområden formulerats. 2 NULÄGE OCH MOTIV TILL UTVECKLINGEN Ändamålsenlig läkemedelsanvändning är en central del av Läkedelsverkets uppdrag. Läkemedelsverket informerar och kommunicerar fortlöpande om läkemedelssäkerhet med olika målgrupper som mottagare. En satsning på vidareutveckling av Läkemedelsverkets kommunikation kring läkemedelssäkerhet kan motiveras utifrån en rad olika aspekter: Att läkemedelssäkerhet är ett viktigt område för patientsäkerheten i Sverige. Att det under senare år skett en betydande utvecklingen av e-hälsotjänster och en utveckling vad det gäller tillgängliggörande av offentlig information. Att flera aktörer har uppdrag inom området läkemedelssäkerhet, vilket kan försvåra för dem som söker information på området. Att Läkemedelsverket har ett omfattande uppdrag inom området läkemedelssäkerhet och att uppdraget har utvecklats under senare år. Sida: 5(31) 2.1 Patientsäkerhet 2.1.1 Läkemedelssäkerhet, ett viktigt område för patientsäkerheten i Sverige Mätningar nationellt och internationellt visar på en stor omfattning av skador i samband med hälsooch sjukvårdsåtgärder varav en betydande del är vårdskador, det vill säga undvikbara skador i samband med hälso- och sjukvårdsåtgärder. Dessa resulterar i personligt lidande, förlängda vårdtider och stora samhällsekonomiska kostnader. Läkemedel är inblandade i en betydande del av dessa skador och vårdskador3,4. Enligt en journalbaserad granskning genomförd av Sveriges Kommuner och Landsting (SKL) under första halvåret 2013 bidrog läkemedel till drygt åtta procent av alla skador vid svenska sjukhus3. Kostnaderna för extra vårddagar till följd av samtliga skador uppskattades i samma studie till 11,5 miljarder kronor. Inom somatisk slutenvård har Socialstyrelsen uppskattat antalet vårdskador till fler än 100 000 årligen4. Enligt denna studie var brister i samband läkemedelsbehandling den näst vanligaste orsaken till vårdskador; läkemedel orsakade 27 % av vårdskadorna. Vidare har uppskattats att andelen akuta inläggningar av äldre på sjukhus som orsakades av läkemedelsbiverkningar var drygt åtta procent av inläggningarna5. I indikatorbaserad jämförelse mellan landsting framträder indikatorer för patienters skattning av den information de får när de förskrivs läkemedel inom primärvården på samma nivå eller lägre jämfört med tidigare år, vilket pekar på att många patienter upplevde informationsbrister i samband med förskrivningen6. 2.1.2 Patientsäkerhetskultur och ett systematiskt lärande “Patientsäkerhet” innebär ”Skydd mot lidande, kroppslig eller psykisk skada eller sjukdom samt dödsfall som hade kunnat undvikas om adekvata åtgärder hade vidtagits vid patientens kontakt med hälso- och sjukvården7”. Skador och ogynnsamma effekter i samband med läkemedelsbehandling omfattas, varför läkemedelssäkerhetsarbete är en del av patientsäkerhetsarbetet. Patientsäkerhetslagen (2010:659) lyfter fram patientsäkerhetskulturen som en av de viktigaste faktorerna för säker vård. En god patientsäkerhetskultur kännetecknas av att medarbetarna inom hälsooch sjukvård och omsorg är medvetna om risker och rapporterar avvikelser. Den svenska patientsäkerhetslagstiftningen lägger stor vikt vid att ha en systemsyn på patientsäkerhet och fokuserar på bakomliggande orsaker till vårdskador. Inom patientsäkerhetsarbetet eftersträvas ett organisatoriskt lärande, vilket innebär förändringar i rutiner, regler och normer som påverkar framtida handlande i organisationen, och som lever vidare även om personal byts ut. Ett systematiskt patientsäkerhetsarbete förutsätter återkommande återkoppling kring identifierade risker och inträffade händelser. Idag sker en hel del av återkopplingen om läkemedelssäkerhet i form av data eller information (se vidare avsnitt 2.5). För att data och information ska kunna bidra till ett organisatoriskt lärande krävs ett systematiskt kvalitetsarbete inom verksamheterna, där informationen först sätts i sitt sammanhang och där kunskap sprids och bidrar till ett individuellt lärande, som på ett systematiskt sätt tas tillvara och omsätts i ett organisatoriskt lärande (Figur 1). 3 Skador i vården - skadeöversikt och kostnad. Markörbaserad journalgranskning januari-juni 2013, 2013, SKL. Vårdskador inom somatisk slutenvård, 2008, Socialstyrelsen, 2008-109-16. 5 Läkemedelsorsakad sjuklighet hos äldre, 2014, Socialstyrelsen, 2014-12-13. 6 Öppna jämförelser 2014, Läkemedelsbehandlingar, jämförelser mellan landsting, 2014, Socialstyrelsen, 201411-1. 7 Enligt definitioner i Socialstyrelsens termbank för ”patientsäkerhet” samt ”vårdskada” (2014-10-14). 4 Sida: 6(31) Individuellt lärande via kunskapsspridning Organisatoriskt lärande Kunskap Information Data Figur 1. Modellen med kunskapstrappan används inom patientsäkerhetsarbete och beskriver hur rådata formateras, filtreras och summeras för att bli till information. Information behöver i sin tur tolkas och ges kontext för att bli kunskap. Kunskap behöver spridas för individuellt lärande. Först därefter kan ett organisatoriskt lärande, med förändrade rutiner och normer, uppnås8. För att bidra till att information om läkemedelssäkerhet hamnar högre upp i trappan skulle Läkemedelsverket kunna bearbeta data och information i större utsträckning, så att den blir lättare att sätta i sitt sammanhang och omvandla till kunskap. Genom att använda intresseväckande format kan spridningen av information förbättras. Att läkemedel är involverade i ett betydande antal vårdskador motiverar genomförande av aktiviteter som syftar till en förbättrad läkemedelssäkerhet. Enligt resultat från Öppna jämförelser upplever patienter informationsbrister i samband med förskrivning av läkemedel, vilket motiverar till initiativ för att understödja förskrivarnas tillgång till information om läkemedel. För patientsäkerhetsarbete i Sverige är ett systematiskt lärande av stor betydelse, vilket motvierar att Läkemedelsverket utformar återkommande informationsinsatser som kan integreras i befintligt patientsäkerhetsarbete. Ytterligare insatser skulle kunna bidra till att öka hälso- och sjukvårdspersonalens medvetenhet om läkemedelssäkerhet och främja rapportering av identifierade risker och misstänkta biverkningar. 2.2 Teknisk utveckling och tillgängliggörande av offentlig information Sedan 2010 har Sverige en nationell strategi för eHälsa9. Ett av målen för den nationella eHälsostrategin är att ”Vård- och omsorgspersonal ska ha tillgång till välfungerande och samverkande elektroniska beslutsstöd som säkerställer en hög kvalitet och säkerhet samtidigt som det underlättar deras dagliga arbete. Nödvändig och strukturerad information ska finnas tillgänglig som underlag för beslut om insatser och behandlingar.” Att fatta beslut om patientens vård är ofta en avancerad och komplex uppgift och både i Sverige och internationellt blir det allt vanligare med olika typer av elektroniska beslutsstöd, bland annat i samband med ordination och expediering av läkemedel. Elektroniska beslutsstöd bygger på tillgång till relevant information om patienten kopplad till aktuell kunskap om exempelvis läkemedel, inklusive grundläggande information om läkemedel och säkerhetsinformation av akut art. 8 Nilsen et al., Läkartidningen 2012, vol. 109, nr. 20, 1028-1031. Nationell eHälsa– strategin för tillgänglig och säker information inom vård och omsorg, 2010, Socialdepartementet, S2010.020. 9 Sida: 7(31) Information om läkemedel inhämtas många gånger via digitala kanaler. Under 2014 hade exempelvis Läkemedelsverkets sökfunktion Läkemedelsfakta fler än 386 000 unika sidvisningar10 och fass.se hade ca 4 miljoner besökare i månaden11. Inera tillhandahåller tjänsten ”Svenska informationstjänster för Läkemedel” (SIL)12, som ett för hälso- och sjukvården gemensamt sätt att distribuera information om läkemedel från flera kvalitetssäkrade kunskapsdatabaser. Sedan 2012 är SIL infört i alla landets 21 landsting och regioner via respektive journalsystem. SIL förmedlar innehåll från bland annat vissa av Läkemedelsverkets informationskällor. För apotekens del tillhandahåller eHälsomyndigheten Elektroniskt expertstöd (EES)13 till alla öppenvårdsapotek som ett hjälpmedel vid receptexpediering. eHälsomyndigheten är den myndighet ansvarar för den digitala infrastrukturen kring läkemedel och har också ansvar för nationell läkemedelsstatistik. Inera har i uppgift att koordinera landstingens och regionernas gemensamma e-hälsoarbete. En förutsättning för att information inom läkemedelssäkerhet ska kunna tillgängliggöras via olika ehälsotjänster är att informationen är tillgänglig i så kallat maskinläsbart format. Detta innebär att informationen är strukturerad på ett sätt som möjliggör maskinell bearbetning och samkörning med data från andra informationskällor. Att innehållet är i maskinläsbart format innebär att andra aktörer kan visa innehållet via sina gränssnitt, som exempelvis olika typer av journalsystem och beslutstöd. Lagen (2010:566) om vidareutnyttjande av handlingar från den offentliga förvaltningen, också kallad PSI-lagen (Public Sector Information), syftar till att underlätta användning av handlingar som tillhandahålls av myndigheter. För att möjliggöra vidareutnyttjande av informationen behöver den finnas tillgänglig som öppna data, vilket innebär att data tillhandahålls fritt utan att betydande tekniska eller rättsliga begränsningar uppställs för hur den får utnyttjas. Enligt e-delegationens vägledning14 finns det starka politiska signaler om att myndigheter ska främja vidareutnyttjande av sina informationsresurser: ”Myndigheternas långsiktiga mål bör – inom ramen för det rättsliga utrymme som föreligger – vara att all information som är efterfrågad för vidareutnyttjande ska göras tillgänglig på nätet om det inte föreligger rättsliga hinder mot sådant tillgängliggörande.” En myndighets rättsliga utrymme för att bedriva informationsverksamhet på nätet bestäms av myndighetens uppgifter och vad som kan anses rymmas inom myndighetens allmänna service till medborgare och företag. Läkemedelsverket redovisade i en rapport från 201315 verkets aktiviteter kopplade till PSI-direktivet. Läkemedelsverket har en rad olika informationskällor och kunskapsunderlag som redan används eller skulle kunna tillgängliggöras i maskinläsbart format, som öppna data. Exempelvis är informationen i databaserna Nationella substansregistret, NSL, och Nationellt produktregister, NPL16 tillgängliga i maskinläsbart format. 10 Uppgift från Google Analytics, januari 2015. Personlig kommunikation med LIF, 201502. 12 http://www.inera.se/TJANSTER--PROJEKT/Sil/ 13 http://www.ehalsomyndigheten.se/ehalsotjanster/beslutsstod/ees/ 14 Vidareutnyttjande av offentlig information En vägledning för myndigheter, E-delegationen. 15 Redovisning av aktiviteter kopplade till genomförandet av PSI-direktivet Rapport från Läkemedelsverket, 2013, Läkemedelsverket, S2012/8855/SAM (delvis) 16 Uppgiften att tillhandahålla ett register med läkemedelsprodukter kommer under 2016 att övergå från Läkemedelsverket (NPL) till E-hälsomyndigheten och systemet VARA. 11 Sida: 8(31) Läkemedelsverket strävar efter öppenhet i sin verksamhet i enlighet med offentlighetsprincipen och bedriver ett kontinuerligt arbete med att förbättra tillgängligheten till den information som finns hos myndigheten. Att tillgängliggöra ytterligare information i maskinläsbart format, som öppna data, är en fortsättning på detta arbete som är i linje med PSI-lagstiftningen. Information om läkemedel söks idag många gånger via digitala kanaler. Hälso- och sjukvårdens egna beslutstöd utgör viktiga informationskanaler, vilket motiverar tillgängliggörande av information om läkemedel maskinläsbart format. 2.3 Nationella aktiviteter inom området läkemedelssäkerhet Målet med patientsäkerhetsarbete är att hälso- och sjukvården organiseras på ett sådant sätt att ingen patient skadas i samband med vård. Aktiviteter inom området läkemedelssäkerhet ingår som en del av patientsäkerhetsarbetet och omfattar förutom hälso- och sjukvårdens praktiska arbete, lagstiftning, tillsyn, anmälan av skador, rapportering av läkemedelsbiverkningar, uppföljning, kunskapsstyrning, utbildning och andra förebyggande initiativ. En del av aktiviteterna är organiserade inom olika nationella strategier. 2.3.1 Författningar Olika perspektiv av området läkemedelssäkerhet finns reglerade i lagar och förordningar, samt i föreskrifter från Läkemedelsverket och Socialstyrelsen. Läkemedelsverkets föreskrifter har ett produktperspektiv och styr handel och distribution av läkemedel. Socialstyrelsen har föreskrifter kring system, processer och personal inom patientsäkerhet och läkemedelshantering. Författningar på området är: Läkemedelslag (1992:859) Patientsäkerhetslag (2010:659) Patientlag (2014:821) Läkemedelsförordning (2006:272) Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel (2012:14) Socialstyrelsens föreskrifter och allmänna råd om läkemedelshantering i hälso- och sjukvården (2000:1)17 Läkemedelsverkets ansvar finns beskrivet i avsnitt 2.4.1. Enligt patientsäkerhetslagens ska hälso- och sjukvårdspersonal rapportera risker för vårdskador samt händelser som har medfört eller hade kunnat medföra en vårdskada till vårdgivaren. Vårdgivaren har en skyldighet att utreda händelser i verksamheten som har medfört eller hade kunnat medföra en vårdskada. Händelser som har medfört eller hade kunnat medföra en allvarlig vårdskada ska anmälas till Inspektionen för vård och omsorg (IVO). Enligt patientsäkerhetslagen ska också vårdgivare dokumentera genomfört patientsäkerhetsarbete årligen i en så kallade patientsäkerhetsberättelse. Såväl vårdgivarens händelseanalys som anmälan till IVO och vårdgivarnas patientsäkerhetsberättelser kan innehålla skador eller händelser relaterade till läkemedelsanvändning. Socialstyrelsens föreskrifter och allmänna råd om läkemedelshantering i hälso- och sjukvården omfattar regler kring ordination, läkemedelsgenomgångar, dokumentation om läkemedel, iordningställande, överlämnande, administrering, rekvisition, förvaring, samt kring informationsöverföring. Även i patientlagen som trädde i kraft i januari 2015 finns förtydligande om 17 Föreskriften genomgår revision under 2015. Sida: 9(31) informationsplikt i samband med läkemedelsbehandling. Här anges att ”Patienten ska få information om väsentliga risker för komplikationer och biverkningar”. Denna informationsplikt förutsätter att hälso- och sjukvårdspersonalen har tillgång till lättillgänglig, producentoberoende information om risker för komplikationer och biverkningar. 2.3.2 Tillsyn, rapportering och anmälan av skador Läkemedelsverket har tillsynsansvar för säkerhetsövervakning av läkemedel, restnoteringar av läkemedel, avregistreringar, reklamation, olaga försäljning, kvalitetsbrister, apoteksverksamhet, receptfri detaljhandel och marknadsföring av läkemedel. Tillsynsåterföring till berörda aktörer sker i form av årliga sammanställningar för respektive område18 och vid konferenser. IVO är tillsynsmyndighet för verksamheter inom hälso- och sjukvården och hälso- och sjukvårdspersonal i deras yrkesutövning. Tillsynsåterföring sker i form av årliga sammanställningar, samt vid specifika möten, så kallade återföringsdialoger. Nationellt finns ett antal system för att anmäla och rapportera händelser som lett till skada/ogynnsam händelse eller risk för skada/risk för ogynnsam händelse i samband med vård. Om skadan eller den ogynnsamma händelsen misstänks ha koppling till läkemedelsbehandling finns ytterligare anmälningsoch rapporteringsvägar. De olika systemen har olika syfte och vem som är anmälare varierar: Anmälan enligt lex Maria: Allvarliga vårdskador eller risk för allvarliga vårdskador ska anmälas av vårdgivaren till IVO. IVO säkerställer att händelsen har utretts i nödvändig omfattning av vårdgivaren och att de åtgärder som krävs för att uppnå hög patientsäkerhet har vidtagits. Klagomål till IVO: Syftar till att ge privatpersoner möjlighet att påtala för IVO att de upplevt att någon har drabbats av eller har riskerat att råka ut för en vårdskada. Avvikelserapportering: En avvikelserapport beskriver avvikande händelser och tillbud och skrivs av hälso- och sjukvårdspersonal som varit involverad i händelsen. Vårdgivaren är skyldig att rapportera de allvarligaste avvikelserna till IVO och/eller Läkemedelsverket. Spontanrapporterade biverkningar till Läkemedelsverket. Den som bedriver verksamhet inom hälso- och sjukvården ska rapportera samtliga misstänkta biverkningar av läkemedel. Även patienter och konsumenter har möjlighet att rapportera misstänkta biverkningar. Reklamationer av läkemedel: Den som har misstanke om kvalitetsbrister eller fel på ett läkemedel ska reklamera det. Apotek, sjukhusapotek och den som bedriver detaljhandel med vissa receptfria läkemedel ska ta emot och hantera reklamationer enligt Läkemedelsverkets föreskrifter. Klagomål och synpunkter till patientnämnderna: Patientnämnderna, som finns i alla landsting och kommuner, ska stötta patienter och anhöriga i att rapportera avvikelser till vårdgivare och vårdenheter. Patient och anhöriga kan även anmäla skador och ogynnsamma händelser i samband med läkemedelsanvändning till försäkringsbolag, som utreder och beslutar om rätt till ekonomisk ersättning. Landstingens Ömsesidiga Försäkringsbolag, LÖF, hanterar ärenden där patienter skadats i samband med hälso-, sjuk- och tandvård. Patientförsäkringsföreningen (PFF) betalar ut ersättning till patient som skadas av en oförsäkrad vårdgivare. Den som anser sig ha blivit skadad av ett läkemedel kan göra en anmälan till Läkemedelsförsäkringen, som utreder och beslutar om rätt till ersättning. Beslut av Läkemedelsförsäkringen kan överklagas via Läkemedelsskadenämnden. 18 Tillsynsrapporter 2013, Läkemedelsverket, https://www.lakemedelsverket.se/overgripande/Publikationer/Rapporter/ Sida: 10(31) 2.3.3 Nationella strategier Kommunikation om läkemedelssäkerhet till hälso- och sjukvårdspersonal berörs av ett antal nationella strategier, där ett flertal aktörer samverkar: Läkemedelsverket har som uppdrag att samordna den Nationella läkemedelsstrategin (NLS). Syftet med NLS är bättre läkemedelsanvändning, och flera aktiviteter handlar om förbättrad säkerhet i samband med läkemedelsanvändning19. SKL har återkommande överenskommelser med regeringen för att stärka landstingens patientsäkerhetsarbete via så kallade Patientsäkerhetssatsningar20. I Patientsäkerhetsöverenskommelsen har staten och SKL enats om en prestationsbaserad ersättning för patientsäkerhetsarbetet i landstingen. Nationell e-hälsostrategi21 har som beskrivits i avsnitt 2.2 implikationer för hur information distribueras till hälso- och sjukvårdspersonal. Socialdepartementet leder arbetet med den Nationella e-hälsostrategin. Arbetet är ett samarbete med Socialstyrelsen, eHälsomyndigheten, SKL, Vårdföretagarna och Famna. Socialstyrelsen kom 2013 med ett förslag till en nationell strategi för ökad patientsäkerhet, där läkemedelsrelaterade vårdskador är ett av insatsområden22. I juni 2011 fick Socialstyrelsen i uppdrag av regeringen att årligen, under perioden 2013-2015, lämna en lägesrapport inom patientsäkerhetsområdet23. 2.3.4 Uppföljning inom patientsäkerhetsarbete Det finns ett antal möjliga vägar att följa upp patientsäkerhetsarbete. Datasammanställningar utifrån de system för anmälan och rapportering beskrivna i 2.3.2 är ett sätt. Det är dock viktigt att vara tydlig med att det handlar just om antal anmälningar/antal rapporter, inte det faktiska antalet inträffade händelser. Det finns ett stort mörkertal vad det gäller rapportering. För att bättre skatta det faktiska antalet skador och tillbud behövs kompletterande uppgifter från exempelvis hälsodataregister, kvalitetsregister och journalgranskning. I samband med att skador/vårdskador eller risk för sådana genomförs risk- och händelseanalys för att utreda orsaker och förhindra att det inträffar igen. Inera tillhandahåller ett nationellt IT-stöd för händelseanalys, Nitha, som i dagsläget har 17 anslutna landsting. Nitha innehåller också en kunskapsbank för att stimulera till ett systematiskt lärande Markörbaserad journalgranskning är en metod för att identifiera och mäta skador i vården. SKL tillhandahåller en handbok för metoden, som bygger på en strukturerad journalgranskning där markörer som tyder på att en skada kan ha inträffat identifieras i journaldokumentationen. Därefter följer en bedömning av om en skada har uppstått, och när så är fallet uppstått bedöms typ, allvarlighetsgrad av skadan och om skadan var undvikbar. Resultaten sammanställs och fungerar som underlag för fortsatta aktiviteter för att förbättra patientsäkerheten. Enligt Patientsäkerhetslagen ska vårdgivaren varje år skriva en patientsäkerhetsberättelse, där vårdgivare dokumentera sitt patientsäkerhetsarbete. Här kan exempelvis mål om minskat antal läkemedelshanteringsfel finnas upptagna, samt strategier för hur man på en övergripande nivå kommer att arbeta för att uppnå det. 19 Nationell läkemedelsstrategi, Handlingsplan 2014, 2014, Regeringskansliet,. S2014.003. Protokoll I:14 vid regeringssammanträde 2010-12-16, 2010/9054/HS. 21 Nationell eHälsa– strategin för tillgänglig och säker information inom vård och omsorg, Socialdepartementet 2010, Artikelnummer: S2010.020. 22 Förslag till nationell strategi för ökad patientsäkerhet, Socialstyrelsen, (2011/5702/FS). 23 Lägesrapport inom patientsäkerhetsområdet 2014, 2014, Socialstyrelsen, 2014-4-7. 20 Sida: 11(31) Öppna jämförelser är ett indikatorbaserat verktyg för att stimulera landsting och kommuner att analysera sin verksamhet, lära av varandra, förbättra kvaliteten och effektivisera verksamheten. Arbetet med öppna jämförelser sker i samarbete mellan SKL och Socialstyrelsen. Läkemedelsverket samarbetar kring indikatorer på läkemedelsområdet. 2.3.5 Information och utbildning Flera aktörer arbetar med information och kunskapsstyrning som ur någon aspekt gäller läkemedelssäkerhet. För att samordna den statliga kunskapsstyrningen inrättades ett råd, Kunskapsstyrningsrådet, 2015 bestående av myndighetscheferna för E-hälsomyndigheten, Folkhälsomyndigheten, Forskningsrådet för hälsa, arbetsliv och välfärd, Inspektionen för vård och omsorg, Läkemedelsverket, Socialstyrelsen, Statens beredning för social och medicinsk utvärdering och Tandvårds- och läkemedelsförmånsverket24. Utbildning om läkemedelssäkerhet behöver finnas i tillräcklig omfattning för samtliga yrkeskategorier som hanterar läkemedel eller vårdar läkemedelsbehandlade personer. Eftersom området läkemedelssäkerhet ständigt utvecklas behövs även möjlighet till fortbildning på området. På läkemedelsområdet har exempelvis Socialstyrelsen arbetat med att ta fram webbutbildningar25. Patientlagen från 2015 är tydlig kring patientens rätt till information om komplikationer och biverkningar. Detta förutsätter att den hälso- och sjukvårdspersonal som informerar patienten har tillgång till denna information i ett format som är användbart i patientmötet. Det finns ett antal nationella system som innehåller uppgifter relevanta vid uppföljning av läkemedelssäkerhet. För hälso- och sjukvården är det inte alltid uppenbart vilket/vilka system som ska användas. Genom samlad information från aktörerna skulle detta kunna tydliggöras. För flera professioner är utbildning om läkemedelssäkerhet viktig. Kvalitetssäkrad och aktuell information utformad för att kunna användas inom grundutbildning, vidareutbildning och fortbildning behövs. 2.4 2.4.1 Mer om Läkemedelsverkets uppdrag inom läkemedelssäkerhet Läkemedelsverkets ansvar Läkemedelsverkets övergripande uppdrag är att främja folk- och djurhälsan. Uppdraget innebär att den enskilde patienten och hälso- och sjukvården ska få tillgång till säkra och effektiva läkemedel. Läkemedelverket ansvarar för säkerhetsövervakning av läkemedel (Läkemedelslagen 1992:859 §9, Läkemedelsförordning 2006:272 4 kap, LVFS 2012:14), och har också ansvar att informera om läkemedel, och bedriva utrednings- och utvecklingsverksamhet för att förbättra läkemedelsanvändningen samt verka för samordning och samverkan mellan de aktörer som är verksamma på området (förordningen 2007:1205 §2). Ett viktigt steg för att den enskilde patienten och hälso- och sjukvården ska få tillgång till säkra och effektiva läkemedel är det godkännandeförfarande där Läkemedelsverkets utredare utvärderar kvalitet, effekt och säkerhet innan läkemedelsprodukterna får marknadsföringstillstånd. I samband med godkännande bedöms även namngivning, utseende på förpackning och tillhörande produktinformation, för att minimera risk för förväxling och felanvändning. I Läkemedelsverkets uppdrag ingår att därefter följa förhållandet mellan nytta och risker under läkemedlets hela livscykel. 24 En samlad kunskapsstyrning för hälso- och sjukvård och socialtjänst, Regeringskansliet, Socialdepartementet, Ds 2014:9. 25 http://www.kunskapsguiden.se/utbildning/Sidor/default.aspx Sida: 12(31) En stor del av arbetet med att godkänna läkemedel och bedriva säkerhetsövervakning är samordnat inom EU. Läkemedelsverket är samordnande myndighet för läkemedelssäkerhet i Sverige. Lagstiftningen på området26 omfattar bland annat läkemedelsföretagens ansvar att följa sina produkter och vid behov vidta åtgärder, hälso- och sjukvårdens skyldighet att rapportera misstänkta läkemedelsbiverkningar, allmänhetens möjlighet att rapportera misstänkta läkemedelsbiverkningar samt hur Läkemedelsverkets arbete med säkerhetsövervakning ska bedrivas. Säkerhetsövervakning inom EU innefattar många olika ansvariga aktörer; den europeiska läkemedelsmyndigheten (European Medicines Agency, EMA), de nationella läkemedelsmyndigheterna i EU:s medlemsstater, Europeiska kommissionen, hälso- och sjukvårdspersonal, patienter och läkemedelsföretag. Arbetet med säkerhetsövervakning av läkemedel bygger på rapportering av biverkningar, företagens uppföljning av sina produkter och signalspaning. Sedan 2012 finns en gemensam europeisk kommitté för utredningar kring läkemedelssäkerhet, Pharmacovigilance Risk Assessment Committee (PRAC). Biverkningsrapportering är ett viktigt verktyg för ökad kunskap om förhållandet mellan effekt och säkerhet för läkemedel. I Sverige inkom under 2014 drygt 6900 spontana rapporter om misstänkta biverkningar27. Systemet med biverkningsrapportering från hälso- och sjukvården i Sverige infördes 1965. Systemet har sedan succesivt utvecklats kring vad och hur man rapporterar, samt kring hur samarbetet kring säkerhetsövervakningen samordnas med övriga EU-medlemstater. Förutom systemen för godkännande av läkemedel och säkerhetsövervakning av läkemedel har Läkemedelsverket ytterligare en rad uppdrag av betydelse för att främja en säker läkemedesanvändning. För att fånga upp kvalitetsbrister har Läkemedelsverkets föreskrifter28 som reglerar att alla verksamhetsutövare som bedriver försäljning av läkemedel är skyldiga att kunna ta emot och hantera reklamationer (påtalande av kvalitetsproblem). Bristsituationer för läkemedel kan orsaka problem för patienter och hälso- och sjukvården. Läkemedelsföretagen har det övergripande informationsansvaret och ska anmäla restnoteringar till Läkemedelsverket, som undersöker möjliga lösningar och alternativ i samarbete med inblandade aktörer. I vissa fall, då bristen bedöms som allvarlig och det är nödvändigt att informera om behandlingsalternativ, går Läkemedelsverket ut med information på webbplatsen. Via Giftinformationscentralens verksamhet ger Läkemedelsverket allmänhet och hälso- och sjukvårdspersonal vägledning i hantering av förgiftningsfall, inklusive förgiftningar till följd av läkemedelsexponering. Giftinformationscentralen förvaltar också databaser, antidotlistan som innehåller uppgifter om lagerhållning av antidoter samt databas för hälso- och sjukvårdspersonal om handläggning av förgiftningsfall. Vidare ansvarar Läkemedelsverket för uppdrag som syftar till förbättrad patientsäkerhet. Här finns exempelvis projekt för att möjliggöra direktrapportering av biverkningar från hälso- och sjukvårdens egna informationssystem29. 2.4.2 Förändringar i lagstiftning om säkerhetsövervakning av läkemedel Med syfte att minska antalet ogynnsamma och skadliga effekter i samband med läkemedelsanvändning trädde en ny lagstiftning om säkerhetsövervakning av läkemedel i kraft 26 Läkemedelslagen (1992:859 §9), Läkemedelsförordning (2006:272), Läkemedelsverkets föreskrifter om säkerhetsövervakning av humanläkemedel (2012:14). 27 Läkemedelsverkets årsredovisning 2014, 2015, Läkemedelsverket, 1.1-2015-012803. 28 LVFS 2013:13, Uppsala: Läkemedelsverket. 29 Elektronisk rapportering av läkemedelsbiverkningar, 2014, Läkemedelsverket, S2013/2702/FS. Sida: 13(31) sommaren 201230. Den nya lagstiftningen innehåller flera aspekter som behöver beaktas i Läkemedelsverkets arbete med kommunikation kring läkemedelssäkerhet. Ett övergripande mål med den förnyade lagstiftningen var att öka transparensen kring läkemedelsmyndigheternas arbete med säkerhetsövervakning av läkemedel. Detta har medfört att läkemedelsinformation tillgängliggjorts via en europeisk webbportal och att vissa data från den europeiska biverkningsdatabasen EudraVigilance är sökbar för allmänhet och hälso- och sjukvårdspersonal31. Denna dataåterföring finns beskriven i en EU-gemensam åtkomstpolicy32. Målsättningarna med den ökade åtkomsten till data i den europeiska biverkningsdatabasen är att förbättra folkhälsan genom att underlätta säkerhetsövervakningen av läkemedel, stödja signaldetektion i samband med spontan rapportering om godkända läkemedel, informera hälso- och sjukvårdspersonal och allmänheten genom att ge ut information om spontana rapporter om godkända läkemedel, låta EudraVigilance-data användas i forskningssyfte. Ett uttalat syfte med lagstiftningen har också varit att förbättra samordning av säkerhetsinformation mellan de nationella läkemedelsmyndigheterna och att minska dubbelarbetet för läkemedelsföretagen. I och med den nya lagstiftningen har också ny information tillkommit, som uppgifter om ett läkemedel står under utökad övervakning och resultat från PRAC:s säkerhetsutredningar. Strukturen för annan information om läkemedel som är av intresse för hälso- och sjukvårdspersonal utvecklas också i samband med den nya lagstiftningen, och inkluderar utbildningsmaterial33 och kommunikation om bedömning av nytta-riskbalans under läkemedels livscykel 34. Lagstiftningen om säkerhetsövervakning av läkemedel som trädde i kraft sommaren 2012 innebar också att ett bredare perspektiv på säkerhetsproblem i samband med läkemedelsanvändning lyfts. Förutom biverkningar som uppkommer vid dosering och användning enlig godkänd produktinformation finns nu också förtydligat att misstänkta ogynnsamma effekter i samband med läkemedelsanvändning som uppstår till följd av läkemedelshanteringsfel, avsiktlig felanvändning, missbruk, off label-användning och yrkesexponering också ska rapporteras in till Läkemedelsverket. Lagstiftningen lyfter också vikten av att medlemstaterna ska arbeta för att främja rapporteringen av misstänkta biverkningar. I ändringsdirektiv 2010/84/EU framgår: ”Medlemsstaterna ska vidta alla lämpliga åtgärder för att uppmuntra patienter, läkare, farmaceuter och annan hälso- och sjukvårdspersonal att rapportera misstänkta biverkningar till den nationella behöriga myndigheten. I dessa uppgifter får organisationer som representerar konsumenter, patienter och hälso- och sjukvårdspersonal engageras i lämplig utsträckning”. Ytterligare ett verktyg i arbetet med uppföljande säkerhetsstudier var bildandet av ett nätverk för uppföljningsstudier inom farmakoepidemiologi och farmakovigilans, The European Network of 30 Europaparlamentets och Rådets förordning (EU) nr 1235/2010, direktiv 2010/84/EU, LVFS 2012:14, se vidare http://ec.europa.eu/health/human-use/pharmacovigilance/index_en.htm#geninf Spontanrapporterade biverkning. 31 http://www.adrreports.eu/sv/index.html 32 EudraVigilance Access Policy, Draft revision of EudraVigilance access policy for medicines for human use (04/08/2014). 33 Guideline on good pharmacovigilance practices (GVP), XVI Addendum I Educational materials, planerad publicering andra kvartalet 2015. 34 Guideline on good pharmacovigilance practices (GVP), VII Continuous pharmacovigilance, ongoing benefitrisk evaluation, regulatory action and planning of public communication, planerad publicering andra kvartalet 2015. Sida: 14(31) Centres for Pharmacoepidemiology and Pharmacovigilance, ENCePP35. Via ENCePP kan uppgifter om pågående uppföljningsstudier eftersökas. Det pågår ett omfattande arbete att implementera de olika delarna av lagstiftningen. Ytterligare riktlinjer (GVP) kommer att publiceras under 2015 och via SCOPE36 finns en rad projekt som syftar till att utveckla de europeiska läkemedelsmyndigheternas farmakovigilansarbete utifrån den nya lagstiftningen. Flera av insatserna handlar om läkemedelsmyndigheternas kommunikation om läkemedelssäkerhet. I Läkemedelsverkets uppdrag ingår säkerhetsövervakning av läkemedel och att ge producentobunden information om läkemedel. Läkemedelsverket har också som uppdrag att bedriva utvecklingsverksamhet för att förbättra läkemedelsanvändningen och verka för samordning mellan aktörer på läkemedelsområdet. Att vidareutveckla Läkemedelsverkets information och rapportering om läkemedelssäkerhet och att samverka med andra nationella aktörer på området är motiverat utifrån verkets grundläggande uppdrag. Den lagstiftning om säkerhetsövervakning om läkemedel som trädde i kraft 2012 innebär ytterligare möjlighet att utveckla Läkemedelsverkets information om läkemedelssäkerhet, och flera argument för en vidareutveckling kan identifieras: - Good pharmacovigilance practice innehåller omfattande riktlinjer kring utformningen av säkerhetsinformation som kommer till användning i en utveckling av Läkemedelsverkets läkemedelssäkerhetsinformation. Det pågår ett utvecklingsarbete också bland andra europeiska läkemedelsmyndigheter. - En vidareutveckling behövs för att kunna lyfta läkemedelssäkerhet utifrån ett bredare perspektiv, där biverkningar till följd av läkemedelshanteringsfel, yrkesexponering, missbruk och användning utanför godkänd produktinformation finns belysta på ett adekvat sätt. -Mycket information om läkemedelssäkerhet har tillgängliggjorts via EMA, men hur man hittar och använder informationen skulle kunna förtydligas. För att den utökade tillgången till data ska vara meningsfull för svensk hälso- och sjukvård krävs utbildnings- och fortbildningsinsatser inom området läkemedelssäkerhet. - Kunskapsfrämjande insatser och återkoppling kring vad biverkningsrapportering har resulterat i är lämpliga åtgärder för att främja biverkningsrapportering. 2.5 2.5.1 Kommunikation om läkemedelssäkerhet Vem arbetar med data, information och rapportering inom läkemedelssäkerhet? ”Det huvudsakliga problemet i dag är inte bristen på data vi samlar in, utan att informationen inte är tillgänglig eller användbar när den behövs som bäst” 35 36 http://www.encepp.eu/ http://www.scopejointaction.eu/ Sida: 15(31) är en formulering hämtad från den Nationella eHälsostrategin37. Detta gäller i hög grad för information om läkemedelssäkerhet. Hälso- och sjukvårdspersonal mottar information om läkemedelssäkerhet från många håll (Figur 2). Myndigheter Läkemedelsverket Socialstyrelsen Folkhälsomyndigheten E-hälsomyndigheten IVO SBU Information om lagstiftning Godkänd produktinformation Kunskapsstöd Riktlinjer Rekommendationer Kunskapsförmedling inom den egna organisationen Landsting och kommuner SKL Inera Läkemedelskommittéer HR- funktion Kvalitetsfunktion, Patientsäkerhetsavdelningar. Läkemedelsenhet Läkemedelinformations-centraler Avdelning för klinisk farmakologi Patienter Patientkontakt Patientföreningar Anmälningar, klagomål Återkoppling Frågeverksamhet Utbildningsmaterial Statistik och uppföljning Årsrapporter Nyheter Rutiner Lokala anvisningar Hälso- och sjukvårdspersonal Media TV Press Sociala medier Återkoppling av patientsäkerhetsarbete Vårdprogram Beslutsstöd Utbildningsmaterial Behandlingsrekommendationer Larm och nyheter Handböcker Förstärkning av patienters , professionens , myndigheters och företagens budskap Konferenser Personaltidningar DHPC Marknadsföring Produktinformation Kliniska studier Läkemedelsföretag LIF Vetenskapliga tidskrifter Kvalitetsregister Personliga möten Kollegors erfarenhet Nätverk Stiftelser Forskning Profession Professionsföreningar Grundutbildning/vidareutbildning/fortbildning Figur 2. Hälso- och sjukvårdspersonal är mottagare av information om läkemedelssäkerhet från en rad olika aktörer. Syftet med informationen, innehåll och format ser mycket skiftande ut. Det finns en rad datakällor, informationskällor och informationsmaterial som utifrån någon aspekt handlar om läkemedelssäkerhet. Informationen distribueras via olika kommunikationsverktyg, som digitala verktyg, tidskrifter, nyhetsflöden, rapporter, utbildningsmaterial och via personlig kommunikation. Myndigheterna har behov av att rikta information om läkemedelssäkerhet både till beslutsfattare på olika nivåer och till hälso- och sjukvårdspersonal med patientnära arbetsuppgifter. I flera fall finns någon mellanhand, som vidareförmedlar myndigheternas kommunikation till hälso- och sjukvårdspersonal med patientnära arbetsuppgifter. Läkemedelsverket och EMA står för lagstadgad, grundläggande information om läkemedel (2.5.2). Ytterligare grundläggande läkemedelsinformation förmedlas exempelvis via SIL, FASS och via olika databaser och handböcker. Svenska informationstjänster för läkemedel (SIL) tillhandahålls av Inera och innehåller uppgifter från en rad datakällor, som exempelvis NPL, NSL, Sfinx, Amningslistan, FASS och landstingens rekommenderade läkemedelslistor. Informationen sprids i första hand via journalsystem, men viss information finns även tillgänglig via tjänsten SIL Online38. Via fass.se, som tillhandahålls av branschorganisationen Läkemedelsindustriföreningen (LIF), publiceras förutom FASS-texter med grundläggande läkemedelinformation anpassad till förskrivares 37 Nationell eHälsa– strategin för tillgänglig och säker information inom vård och omsorg, 2010, Socialdepartementet, S2010.020. 38 https://silonline.silinfo.se/#/search?filter-by=_drug.productTypeCode=MEP Sida: 16(31) behov också information som exempelvis lagerstatus för uppgift om en läkemedelsprodukt finns tillgänglig på ett specifikt apotek och information om utbytbarhet, baserat på Läkemedelsverkets lista. Via landstingen finns också databaser med omfattande produktspecifik, grundläggande läkemedelsinformation, som exempelvis Sfinx och Amningslistan, som är tillgängliga via Jansuinfo39. Via läkemedelskommittéer har landstingen också rekommendationslistor, som innehåller information om läkemedelsbehandling. Läkemedelsverket och EMA publicerar säkerhetsinformation av akut art via olika kanaler (se avsnitt 2.5.2). Denna information vidareförmedlas bland annat via landstingens egna kanaler för kunskapsspridning och förstärks i vissa fall via publicering i media och tidskrifter knutna till professionen. Flera aktörer har nyhetsflöden som innehåller uppgifter om läkemedelssäkerhet. Förutom Läkemedelsverket har Socialstyrelsen, IVO och Folkhälsomyndigheten aggregerad information om läkemedelssäkerhet. SKL och landstingen publicerar också återkommande bearbetad information om läkemedelssäkerhet. I flera fall är beslutsfattare den primära målgruppen. Exempel på rapporter är Lägesrapport inom patientsäkerhetsområdet 201440, Skador i Vården – Skadeöversikt och kostnad41, Vaccinuppföljning42, De Nationella Vaccinationsprogrammen43, Läkemedelsorsakad sjuklighet hos äldre44, Årsrapport för öppna jämförelser av hälso- och sjukvård45 och Apotekens vårdskador46. Flera myndigheter och andra organisationer producerar olika typer av kunskapsdokument med terapiorienterad information, utifrån sjukdomstillstånd eller specifik patientgrupp. Läkemedelsbehandling ingår många gånger i dessa. Exempel på publikationer är behandlingsrekommendationer från Läkemedelsverket, nationella riktlinjer från Socialstyrelsen, publikationer från SBU, rapporter från Folkhälsomyndigheten, vårdprogram, riktlinjer, anvisningar och behandlingsrekommendationer från profession och vårdgivare. Läkemedelskommittéerna har i många landsting en viktig roll i att sprida information om läkemedelssäkerhet och anpassa informationen till lokala förhållanden. Inom flera landsting finns även avdelningar för klinisk farmakologi, som förmedlar information och utbildning på läkemedelsområdet. Landstingen har även särskilda läkemedelsenheter, patientsäkerhetsenheter och/eller kvalitetsenheter som sysslar med frågor inom området läkemedelssäkerhet. Läkemedelsinformationscentraler besvarar frågor om läkemedel och läkemedelsbehandling från hälsooch sjukvårdspersonal. Svar på frågor till svenska, finska och danska läkemedelsinformationscentraler finns sökbara i databasen Drugline47. Drugline är ett samarbete mellan Läkemedelsinformationscentralena och stiftelsen SIDI, Swedish Institute for Drug Informatics, som verkar för att tillgängliggöra oberoende läkemedelsinformation. Utbildningsmaterial är ytterligare en typ av aggregerad information. Undervisning om biverkningsrapporteringens betydelse riktad till hälso- och sjukvårdspersonal sker bland annat via 39 http://www.janusinfo.se/ Lägesrapport inom patientsäkerhetsområdet 2014, 2014, Socialstyrelsen 2014-4-7. 41 Skador i Vården – Skadeöversikt och kostnad, 2013, SKL, ISBN 978-91-7585-030-6. 42 Vaccinuppföljning, 2013, Smittskyddsinstitutet, 2013-101-26. 43 De Nationella Vaccinationsprogrammen lägesrapport 2014, 2014, Socialstyrelsen, 2014-9-39. 44 Läkemedelsorsakad sjuklighet hos äldre Kartläggning och förslag till åtgärder, 2014, Socialstyrelsen, 2014-1213. 45 Öppna jämförelser: hälso- och sjukvård 2014, 2014, SKL, ISBN 978-91-7555-221-7 samt ISBN 978-91-7585157-0. 46 Apotekens vårdskador – analys av lex Maria och klagomål inom apoteksverksamhet 2010–2013, 2014, IVO 2014-16, 47 http://drugline.se/ 40 Sida: 17(31) Läkemedelverkets sex regionala centra, lokaliserade på Sveriges universitetssjukhus. Socialstyrelsen har tagit fram utbildningar om läkemedel; Läkemedelsbehandling av äldre48, Specialitetsövergripande klinisk farmakologi för ST-läkare49 samt Läkemedelsgenomgångar för äldre50. Webbutbildningar och viss annan aggregerade information från folkhälsomyndigheterna kan nås via Kunskapsguiden.se. Professionsföreningar, som sektioner under Läkaresällskapet och Apotekarsocieteten, tar fram målgruppsanpassade utbildningar som rör olika aspekter av läkemedelssäkerhet. Apotekarsocieteten och läkaresällskapet är också ansvariga för stiftelsen NEPI, Nätverk för läkemedelsepidemiologi, vars huvudmål är att utveckla området läkemedelsepidemiologi. 2.5.2 Läkemedelsverkets säkerhetskommunikation Good Pharmacovigilance Practice (GVP), Module XV51 innehåller riktlinjer för utformning av säkerhetskommunikation, val av kommunikationskanaler och uppföljning. Att kommunicera inom området läkemedelssäkerhet ställer stora krav på samordning av kommunikation internationellt (andra läkemedelsmyndigheter) och nationellt (andra myndigheter och aktörer). Syftet med läkemedelsmyndigheternas säkerhetskommunikation är enligt de europeiska riktlinjerna: Att vid rätt tidpunkt tillhandahålla evidensbaserad information om säker och effektiv läkemedelsanvändning. Att främja nödvändiga förändringar i utförande av hälso- och sjukvårdsåtgärder (inklusive egenvård). Att påverka attityder, beslut och beteende kopplat till läkemedelsanvändning. Att stödja riskminimering i samband med läkemedelsbehandling. Att främja välgrundade beslut kring rationell läkemedelsanvändning. Läkemedelsverket och EMA ansvarar för omfattande grundläggande information om läkemedel i form av godkända produktresuméer (SmPC) och bipacksedlar (PIL), offentliga utredningsrapporter (PAR), och riskhanteringsplaner (RMP). Denna information är reglerad i lagstiftning. Till den grundläggande informationen räknas även märkning av läkemedelsförpackningar. Den grundläggande informationen om läkemedel innehåller många specifika uppgifter som är väsentliga för en välfungerande läkemedelsbehandling. Uppgifterna uppdateras under läkemedlets livscykel, och det är viktigt för hälso- och sjukvårdspersonal att enkelt kunna identifiera nytillkommen information om exempelvis namnändringar, registreringsstatus, godkända terapeutiska indikationer, kontraindikationer, dosering, varningar, nytillkommen information om specifika patientgrupper, interaktioner, graviditet och amning, anvisningar kring läkemedelshantering, biverkningar, och andra identifierade säkerhetsrisker. Produktbaserad information kan sökas via olika ingångar. Läkemedelsverket förvaltar Läkemedelsfakta, Nationella substansregistret (NSL) och Nationella Produktregistret (NPL). Via Läkemedelsfakta är produktspecifik information från exempelvis NSL och NPL sökbar. Via Läkemedelsfakta kan även senast godkända versionerna produktdokument (SmPC, PIL, PAR, sPAR och sRMP) och läkemedelsmonografier nås. Läkemedelsfakta innehåller också möjlighet till specialsökningar, exempelvis ”Läkemedel som omfattas av särskilda regler för biverkningsrapportering”. Informationen i Läkemedelsfakta kan nås via Läkemedelsverkets webbplats. 48 http://www.kunskapsguiden.se/utbildning/Lakemedelsbehandling-av-aldre/Sidor/Default.aspx http://www.kunskapsguiden.se/utbildning/Specialitetsovergripande-klinisk-farmakologi-for-STlakare/Sidor/default.aspx 50 http://www.kunskapsguiden.se/utbildning/lakemedel/Sidor/Default.aspx 51 Guideline on good pharmacovigilance practices (GVP), Module XV – Safety communication, 2013, EMA, EMA/118465/2012. 49 Sida: 18(31) Information läkemedelssäkerhet av akut art innebär nytillkommen information om tidigare kända eller hittills oidentifierade risker med ett läkemedel som påverkar eller skulle kunna påverka nyttariskbalansen eller hur läkemedelet används. Exempel på säkerhetsinformation av akut art är nytillkommen information om säkerhetsutredningar, ändrad indikation, kontraindikation eller dosering, information om restonteringar, information om kvalitetsproblem, problem med förväxlingar eller andra problem i samband med läkemedelshantering. Läkemedelsverket har en rad informationskällor och kommunikationskanaler som används för säkerhetskommunikation av akut art. Extern webbplats, Direct Healtcare Professional Communication (DHPC), nyheter och pressmedelanden samt tidskriften ”Information från Läkemedelsverket” är de kanaler som vanligtvis används för säkerhetskommunikation. Good Pharmacovigilance Practice (GVP), Module XV lyfter att läkemedelsmyndigheterna ska beakta bredden i tillgängliga kommunikationsverktyg och kommunikationskanaler vid säkerhetskommunikation. Angående målgruppsanpassning anger samma källa att: “Safety communication should be tailored to the appropriate audiences (e.g. patients and healthcare professionals) by using appropriate language and taking account of the different levels of knowledge and information needs whilst maintaining the accuracy and consistency of the information conveyed.” Området läkemedelsinformation är till viss del reglerat i författningar. Läkemedelsförordningen anger att 1 b § Läkemedelsverket ska på sin webbplats tillhandahålla information om humanläkemedel med följande innehåll 1. offentliga utredningsrapporter, produktresuméer och bipacksedlar, 2. sammanfattningar av riskhanteringsplaner, 3. en förteckning över läkemedel som avses i artikel 23 i Europaparlamentets och rådets förordning (EG) nr 726/2004 av den 31 mars 2004 om inrättande av gemenskapsförfaranden för godkännande av och tillsyn över humanläkemedel och veterinärmedicinska läkemedel samt om inrättande av en europeisk läkemedelsmyndighet, 4. upplysning om hur konsumenter och hälso- och sjukvårdspersonal kan rapportera misstänkta biverkningar av läkemedel till Läkemedelsverket, och 5. en länk till den webbportal som avses i artikel 26 i förordning (EG) nr 726/2004. Förordning (2012:347).// Enligt förordning (2007:1205) med instruktion för Läkemedelsverket gäller att 2 § Läkemedelsverket ska särskilt 8. svara för information inom sitt ansvarsområde till andra myndigheter och enskilda, Läkemedelsverket publicerar även en hel del information som inte är knuten till en specifik läkemedelsprodukt. Läkemedelsboken innehåller läkemedelsinformation utifrån terapiområde och är tillgänglig i ett digitalt sökbart format anpassat för mobila enheter. För vissa läkemedel publiceras läkemedelsmonografier, som sammanfattar kunskapsläget för läkemedlet vid godkännandet och behandlingsrekommendationer utarbetas i samarbete med professinen för olika terapiområden. Vidare publiceras en årlig sammanställning om spontanrapporterade biverkningar och en årsredovisning av Giftinformationscentralens verksamhet. Läkemedelsverket tillgängliggör viss information i form av listor, som utbytbarhetlistan52 och antidotregistret som är Giftinformationscentralens tjänst till sjukvården med information om lagerhållning av antidoter53. 52 Listan för utbytbara läkemedel nås via Läkemedelsverkets webbplats (https://www.lakemedelsverket.se/upload/halso-ochsjukvard/forskrivning/utbytbarhet/Utbytbara%20Grupper%20Internet.pdf) 53 https://antidot.gic.se/antidot-web/ Sida: 19(31) Såväl hälso- och sjukvård som allmänhet kan ställa läkemedelsfrågor via telefon eller e-post till Läkemedelsverkets frågeverksamhet via Läkemedelsupplysningen. En hel del av frågeställningarna har koppling till läkemedelssäkerhet, och rör exempelvis biverkningar, interaktioner, och läkemedelsbehandling under graviditet och amning. 2.5.3 Internationella exempel Information och rapportering om läkemedelssäkerhet ser olika ut i olika länder. Läkemedelsmyndigheterna har olika stort ansvar. Därutöver finns andra myndigheter (HTAmyndigheter, folkhälsomyndigheter och tillsynsmyndigheter), stiftelser och organisationer som rapporterar om läkemedelssäkerhet. Inom det Europeiska samarbetet ansvarar läkemedelsmyndigheterna för att samordna viss säkerhetskommunikation med övriga läkemedelsmyndigheter inom samarbetet. För nationell information och rapportering har myndigheterna ett avsevärt större utrymme vad det gäller utformning och hur informationen förmedlas. Som en del av den implementering av lagstiftningen om säkerhetsövervakning av läkemedel som pågår bland europeiska läkemedelsmyndigheter ett antal projekt som handlar om säkerhetskommunikation (SCOPE Work Package 654). Som en del av detta arbete har en kartläggning av europeiska läkemedelsmyndigheters säkerhetskommunikation utförts och håller på att sammanställas. Resultat från denna kartläggning är viktiga i en vidareutveckling av Läkemedelsverkets säkerhetskommunikation. Nedan beskrivs exempel på information om läkemedelssäkerhet via läkemedelsmyndigheters webbplatser. I Danmark är tillståndsgivning på läkemedelsområdet en del av folkhälsomyndigheten Sundhedsstyrelsens uppdrag. Exempel från Sundhedsstyrelsen är: - Förmedling av ett brett perspektiv på problem i samband med läkemedelsanvändning som inkluderar läkemedelshanteringsfel, missbruk, förfalskade läkemedel. Informationen finns samlad via en webbsida för läkemedelssäkerhet; ”medicin/sikkerhed55”. - Målgruppsanpassad information via nyhetsbrev (Nyt om biverkninger56), och målgruppsanpassat informationsmaterial (via Institut for Rationel Farmakoterapi (IRF)57) som kan användas exempelvis i mötet med patienter. Exempel från Nederländerna är: - Sökfunktion för läkemedelsprodukter som möjliggör sökning i SmPC-texter (Database Human Medicines). Sökning kan göras på ord i godkänd indikation, kontraindikation eller i hela produktresumén. Sökningar kan också utföras utifrån läkemedelsform eller administreringssätt. Via söksidan nås även information om rapportering av läkemedelsbiverkningar. - Strukturerad säkerhetsinformation via en webbsida med tydliga rubriker. Via sidan nås på ett enkelt sätt information om rapportering avogynnsamma händelser i samband med läkemedelsanvändning, DHPC, läkemedel under utökad övervakning, periodiska säkerhetsrapporter, riskhanteringsplaner, information från PRAC och läkemedel med teratogena egenskaper som ingår i ett särskilt program för att förebygga graviditet under pågående behandling. 54 55 http://www.scopejointaction.eu/ http://sundhedsstyrelsen.dk/da/medicin/sikkerhed 56 http://sundhedsstyrelsen.dk/da/medicin/sikkerhed/bivirkninger/nyt-om-bivirkninger 57 http://www.irf.dk/dk/ Sida: 20(31) Exempel från Food and Drug Administration (FDA), den myndighet i USA som bland annat ansvarar för tillståndsgivning inom läkemedelsområdet är: - Pågående satsning att tillgängliggöra läkemedelsinformation som öppna data. - Samlad information om läkemedelssäkerhet (på engelska ”drug safety”) och tillgänglighet (på engelska ”availability”), ”Drug safety and Availability”. Här finns information som exempelvis säkerhetsmeddelanden om enskilda produkter, information om ändrad märkning, indragningar, säkerhetsstudier efter godkännande, bristsituationer och beskrivningar kring hur FDA arbetar med olika typer av risker och säkerhetsuppföljning. Via länkar nås även information om hur man rapporterar läkemedelsbiverkningar och övriga säkerhetsproblem till FDA via MedWatch. - Möjlighet att prenumerera på säkerhetsrelaterade nyheter. Urvalet av vilka nyheter man är intresserad av kan begränsas ytterligare (exempelvis bristsituationer, läkemedelshanteringsfel, övriga nyheter om läkemedelssäkerhet). Information och data om läkemedel och läkemedelssäkerhet kommer i dagsläget från ett flertal aktörer och det förekommer en stor mängd information på området. I flera fall presenteras relativt obearbetade data. Uppdelningen utgår från typ av data snarare än relevans för en viss verksamhet eller patientgrupp, vilket försvårar att hälso- och sjukvårdspersonal får del av relevant information. Den digitala utvecklingen leder till att information om läkemedel styckas upp; en snuttifierad bild förmedlas. För att den uppstyckade informationen ska kunna användas som underlag för beslut om läkemedelsbehandling behöver förskrivare och annan hälso- och sjukvårdspersonal ha mycket goda kunskaper om läkemedel, vilket motiverar att Läkemedelsverket också satsar på långsiktigt kunskapsfrämjande insatser om läkemedelssäkerhet. Tillgänglighet, språk och sammanhang är ofta inte anpassat för att direkt kunna användas som kunskapsfrämjande information av hälso- och sjukvårdspersonal i patientnära verksamhet. För att främja att hälso- och sjukvårdspersonal tar del av informationen är målgruppsanpassning av informationen motiverad. Läkemedelsverket har redan idag flera kommunikationskanaler som är lämpliga för att förmedla information om läkemedelssäkerhet. Via Läkemedelsfakta, Nationella Produktregistret (NPL) och Nationella Substansregistret (NSL) har Läkemedelsverket kommunikationsverktyg för att tillgängliggöra informationen så att den kan distribueras vidare och tillgängliggörs via elektroniska beslutsstöd. Hur läkemedelsmyndigheter jobbar med information om läkemedelssäkerhet finns beskrivet i europeiska riktlinjer, och även bland andra europeiska läkemedelsmyndigheterna pågår aktiviteter för att utveckla säkerhetskommunikationen vilket ger synergieffekter i en vidareutveckling av Läkemedelsverkets säkerhetskommunikation. 2.6 Erfarenheter från arbetet med ”Läkemedelssäkerhet 2013” Rapporten Läkemedelssäkerhet 201358 har utgjort ett steg i vidareutvecklingen av Läkemedelsverkets information och rapportering inom området läkemedelssäkerhet. Syftet med Läkemedelssäkerhet 2013 var att förmedla ett bredare perspektiv på Läkemedelsverkets arbete inom läkemedelssäkerhet genom 58 Läkemedelssäkerhet 2013, 2014, Läkemedelsverket. Sida: 21(31) att integrera tillgänglig data från olika källor och målgruppsanpassa informationen. Läkemedelsverket arbete med läkemedelssäkerhet och vikten av olika aktörers, till exempel hälso- och sjukvårdens bidrag, lyftes i rapporten. Läkemedelssäkerhet 2013 publicerades i maj 2014 på Läkemedelsverkets webbplats tillsammans med ett presentationsmaterial. En sammanfattning publicerades även i Information från Läkemedelsverket nr 3 2014 och rapporten har presenterats i ett flertal olika forum. Rapporten utgick från information om läkemedelssäkerhet som Läkemedelsverket fått sig delgivet eller inhämtat och spridit under 2013. Rapporten gav en sammanfattande bild av Läkemedelsverkets arbete med läkemedelssäkerhet och händelser under 2013 med exempel på bland annat inrapporterade biverkningar, säkerhetsutredningar, förväxlingsrisker, bristsituationer eller olaglig läkemedelsanvändning. I rapporten beskrivs även Läkemedelsverkets kontinuerliga och förebyggande arbete inom läkemedelssäkerhet. Via konferenser, direkt kontakt och intressentseminarier har Läkemedelsverket fått återkoppling på rapporten. Synpunkter som framfördes var att rapporten var lättläst med en bra disposition men att en utveckling av en mer interaktiv rapport i elektronisk form vore önskvärd. De exempel och fallbeskrivningar som ingick i rapporten framhölls som viktiga för att hälso- och sjukvården ska uppfatta materialet som intressant och lärorikt. Det finns flera skäl till att presentera information om läkemedelssäkerhet i ett format som sammanställer data från flera källor, såsom i rapporten Läkemedelssäkerhet 2013: Det blir lättare att få en överblick. För att kunna förmedla en intressantare bild. För att det finns ett sort mörkertal i rapportering. En enskild källa ger varken heltäckande eller rättvisande bild av förekomst av ogynnsamma effekter och risker i samband med läkemedelsbehandling. Av olika skäl är det svårt att ge återkoppling på enskilda biverkningsrapporter. I rapporten Läkemedelssäkerhet 2013 kunde Läkemedelsverket förmedla vad som händer efter rapportering av biverkningar och delvis relaterade dessa till faktisk användning av läkemedel. Denna förståelse lyfts som viktig för att främja biverkningsrapportering. I diskussionen om rapporten Läkemedelssäkerhet 2013 framkom att flertalet ansåg att behovet av en tryckt rapport var begränsat. Behovet av återkommande återkoppling, och inte årlig rapportering var tydligt. Återkoppling på rapporten Läkemedelssäkerhet 2013 har synliggjort behoven av att satsa på kunskapsfrämjande insatser, anpassad till målgruppen hälso- och sjukvårdspersonal, där man strävar efter att förmedla information om läkemedelssäkerhet utifrån ett nytta-riskperspektiv. Läkemedelsverket fick bekräftat att bearbetning av säkerhetsinformation så att den kan identifieras utifrån exempelvis terapiområde samt fallbeskrivningar som en form för att sätta informationen i ett kliniskt sammanhang är användbart för att nå hälsooch sjukvårdspersonal med patientnära arbetsuppgifter. Läkemedelsverkets tolkning av återkoppling kring Läkemedelssäkerhet 2013 var att intresse finns hos målgruppen för informationen i rapporten, men att målgruppen föredrar annat format än rapportformatet, gärna återkommande, kortfattad information i digitalt format. Sida: 22(31) 2.7 2.7.1 Samråd och intressentseminarier Internt samråd För att inhämta information från medarbetare inom Läkemedelsverket med erfarenhet av arbete med läkemedelssäkerhet och kommunikation genomfördes under februari-april 2014 tio intervjuer. Intervjuerna rörde innehåll och arbetssätt för rapporten Läkemedelssäkerhet 2013, men även mer generella frågeställningar kring vidareutveckling av Läkemedelsverkets rapportering om läkemedelsäkerhet. Under intervjuerna gavs exempel på information som Läkemedelsverket förvaltar, vars tillgänglighet för hälso- och sjukvårdspersonal skulle kunna förbättras. Eftersom det finns en så omfattande säkerhetskommunikation framfördes hur viktigt det är att kunna selektera och lyfta viss information för rapportering. Behov av att målgruppsanpassa information lyftes också. Som ett viktigt syfte med rapportering om läkemedelssäkerhet uppgavs återrapportering till hälso-sjukvården, så att nyttan med biverkningsrapportering förmedlas. Återkommande lyftes vikten av att kunna sätta olika säkerhetaspekter i ett nytta-riskperspektiv, för att informationen ska vara rättvisande och användbar i ett kliniskt sammanhang. Vid intervjuerna framfördes även synpunkter kring andra nationella aktörer som Läkemedelsverket skulle kunna samverka med kring viss information om läkemedelssäkerhet. Specifika områden som skulle kunna uppmärksammas i rapportering om läkemedelssäkerhet som uppgavs var till exempel specifika patientgrupper som barn, äldre, cancerpatienter, gravida, personer med demenssjukdom, organfunktionsnedsättning och psykisk ohälsa. Såväl information om nya läkemedel, som information för läkemedel som funnits länge på marknaden ansågs viktiga att lyfta. Angående utformning och spridning av information diskuterades kring behov av att anpassa informationen utifrån specifika situationer. Beträffande distribution av rapportering om läkemedelssäkerhet lyftes flera av Läkemedelsverkets befintliga kommunikationskanaler. Spridning till nyckelindivider/organisationer omnämndes också. 2.7.2 Aktörer som informerar inom området läkemedelssäkerhet Vid intressentseminariet skickades inbjudan ut till åtta aktörer. Gemensamt för aktörerna var att de inom sina ansvarsområden utför arbete som har bäring på området läkemedelssäkerhet och bearbetar och presenterar information om läkemedelssäkerhet. Vid seminariet deltog representanter från följande organisationer: Uppsala Monitoring Centre, Socialstyrelsen, Tandvårds- och läkemedelsförmånsverket, Statens beredning för medicinsk utvärdering, Folkhälsomyndigheten, Sveriges kommuner och landsting, Inspektionen för vård och omsorg samt Patientnämnden i Stockholm. Inför seminariet fick deltagarna ut ett antal frågor, samt rapporten Läkemedelssäkerhet 2013. Samtliga representanter var positiva till någon form av samarbete kring rapportering inom området läkemedelssäkerhet till hälso- och sjukvårdspersonal, för att bidra till en ökad medvetenhet om läkemedelssäkerhetsfrågor. Flera tankar kring vad ett sådant samarbete skulle kunna innebära delades vid seminariet. Under mötet presenterades flera exempel på datakällor/informationskällor som skulle kunna vara användbara vid ett fortsatt samarbete. Beträffande organisation av arbetet föreföll gruppen enig i att en nationell strategi, som NLS, skulle kunna vara en lämplig tillhörighet när flera aktörer ska bidra, även om det krävs att en aktör har huvudansvar. Deltagarna vid seminariet framförde ett antal förbättringsförslag för hur innehållet och formatet för rapporten Läkemedelssäkerhet 2013 skulle kunna utvecklas vidare. Sida: 23(31) 2.7.3 Representanter som företräder hälso- och sjukvårdspersonal Vid intressentseminariet deltog representanter från organisationer som företräder hälso- och sjukvårdspersonal och representanter för grundutbildningarna för läkarprogrammet, sjuksköterskeprogrammet och de farmaceutiska utbildningarna. Inbjudan att delta vid ett intressentseminarium för att diskutera information om läkemedelssäkerhet skickades ut till sexton aktörer. Representant(er) för Sveriges läkemededelskommittéer, Sveriges Apoteksförening, Sveriges läkarförbund, Vårdförbundet, Apotekarsocieteten, Sveriges Farmaceuter, Unionen, Karolinska universitetssjukhuset, , Svensk sjuksköterskeförening, Sjuksköterskeutbildningen vid Uppsala Universitet, Farmaceutbildningarna vid Uppsala Universitet, Sjuksköterskeutbildningen vid Karolinska Institutet, och läkarutbildningen vid Karolinska Institutet deltog. Inför seminariet fick deltagarna ut ett antal frågor, samt rapporten Läkemedelssäkerhet 2013. En majoritet av deltagarna var positiva till att samla information från flera aktörer om hälso- och sjukvårdens läkemedelssäkerhetsarbete på ett ställe. Flera konkreta förslag på arbetets utformning framfördes. Flera synpunkter om behovet av att målgruppsanpassa informationen framfördes. Beträffande distribution av information om läkemedelssäkerhet framfördes synpunkter att utnyttja befintliga strukturer för informationsförmedling inom hälso- och sjukvårdens egna organisationer. Som viktigt för framtida utveckling av kommunikation om läkemedelssäkerhet sågs samverkan mellan myndigheter, landstingen och apoteksvärlden. Beträffande format och distribution var det tydligt hur skiftande behoven såg ut för olika delar av målgruppen. Att informationen är digitalt tillgänglig och att språket är enkelt var synpunkter som framkom flera gånger under diskussionen. Ytterligare synpunkter kring format var att mottagaren behöver ha möjlighet att välja grad av fördjupning, samt behov av olika format för olika situationer. Generellt sätt efterfrågades kortfattade texter med ett konkret språk, anpassat till målgruppen. Olika typer av läsbarhetstester kan genomföras för att testa särskilt viktiga texter. Förutom fallbeskrivningar lyftes även illustrationer som ett grepp för att nå ut med informationen. Rapporten Läkemedelssäkerhet 2013 betraktades i nuvarande form som ett utbildningsmaterial. Övergripande framhölls att fallbeskrivningar och olika exempel har ett stort värde vid lärande om läkemedelssäkerhet. Flera aktörer med nationella uppdrag inom läkemedelssäkerhet ser möjlighet i att samverka kring delar av informationen. Hälso- och sjukvården har ett stort intresse av information om läkemedelssäkerhet. Behoven ser olika ut beroende på profession, verksamhet och arbetsuppgift. Efterfrågan av information i digitalt format och information som kan förmedlas vidare via verksamheternas egna kunskapsorganisationer efterfrågades. Återkoppling kring vad inrapporterade biverkningar leder till är viktigt för att stimulera rapporteringsviljan. Rapporten Läkemedelssäkerhet 2013 gav exempel där hälso- och sjukvårdens rapportering bidragit till förbättringar. 2.8 Uppföljning av säkerhetskommunikation Också vad det gäller uppföljning finns riktlinjer i Good Pharmacovigilance, GVP module XV59: 59 Guideline on good pharmacovigilance practices (GVP), Module XV – Safety communication, 2013, EMA, EMA/118465/2012. Sida: 24(31) ”Safety communication is considered effective when the message transmitted is received and understood by the target audience in the way it was intended, and appropriate action is taken by the target audience. Adequate mechanisms should be introduced in order to measure the effectiveness of the communication based on clear objectives. Measuring effectiveness allows lessons to be learned and helps in making decisions on prioritising and adapting tools and practices to meet the needs of the target audiences. A research-based approach will normally be appropriate in order to establish that safety communications have met the standard of XV.B.2. This approach may measure different outcomes, including behaviour, attitudes, and knowledge. When evaluating the effectiveness of safety communication, the scope of the evaluation may be broadened to include factors other than the performance of the individual tools used in the safety communication (see Module XVI).” Att följa upp nyttan och effekterna av insatser som syftar till ökad kunskap låter sig inte lätt göras. En kombination av metoder behövs. Val av metoder måste vägas mot kostnader. Möjliga vägar för uppföljning av kommunikationsinsatser är: Kvantitativa mått för att utvärdera räckvidd: Spridning som exempelvis antal nedladdningar, antal sidvisningar, antal som länkar till specifika dokument, antal prenumeranter av ett nyhetsbrev etc. Sekundär räckvidd: Att uppskatta hur informationen sprids vidare är en viktig aspekt för viss säkerhetsinformation. Både omfattningen av vidareförmedlingen och hur informationen tolkats är viktig. Mediabevakningsverktyg är ett redskap som används för detta. Hur många av landstingens kunskapsorganisationer som vidareförmedlar specifik information om läkemedelssäkerhet eller omfattning av användning av ett visst material inom grundutbildning är andra sätt. Fokusgrupper: Kan tillföra kvalitativa uppgifter och användas vid test av läsbarhet, utvärdering av format, ge förslag på framtida utveckling och för att få en uppfattning om målgruppen upplever att informationen har avsedd effekt, exempelvis om informationen upplevs bidra till ökad kunskap eller en ändrad arbetsrutin. Kontinuerlig möjlighet till att lämna synpunkter via webbformulär och fritextfält: Kontinuerlig insamling av synpunkter från slutanvändarna kan vara ett väsentligt bidrag till den löpande verksamheten och utvecklingen av denna, även om endast kvalitativa uppgifter kan insamlas och det inte går at veta hur representativa inkomna synpunkter är. Ett system för att kategorisera synpunkterna och en rutin för hur synpunkterna tas till vara behöver vara på plats innan insamlandet av synpunkter inleds. Uppföljning av specifika frågeställningar: Om patienter upplever att de får del av information om säkerhet och risker i samband med behandling skulle möjligtvis kunna följas via frågeställningar i befintliga enkäter, som Nationell patientenkät. Förtroende för Läkemedelsverket, har fångats exempelvis med enkätundersökning via SOM-institutet60. Hur väl Läkemedelsverket lyckas nå hälso- och sjukvårdspersonal med information om läkemedelssäkerhet, om informationen uppfattats såsom avsett och om informationen använts som beslutsstöd och påverkat handling, skulle kunna fångas via riktad uppföljning, exempelvis som uppföljning av informationsinsats kring en specifik säkerhetshändelse. Många gånger är det komplext och svårt att kunna dra slutsatser om en informationsinsats faktiskt lett till en effekt. Exempel som skulle kunna följas via statistik från Socialstyrelsen och eHälsomyndigheten är doseringsändringar, varning för en läkemedelsinteraktion och användning i en viss åldersgrupp. För andra frågeställningar är dialog med målgruppen, exempelvis i fokusgrupper som beskrivits ovan, metoder för uppföljning av specifika frågeställningar. Vårdanalys utför en uppföljning av effekterna av Socialstyrelsens nationella 60 Förtroendet för Läkemedelsverket, SOM-Institutet, 2014, SOM-rapport nr 2014:17, http://som.gu.se/digitalAssets/1488/1488796_f--rtroendet-f--r-l--kemedelsverket-2013.pdf. Sida: 25(31) riktlinjer ur ett patientperspektiv61. Liknande metodologi skulle kunna tillämpas för behandlingsrekommendationer och kunskapsstöd inom området läkemedelssäkerhet. Rapportering och anmälan, exempelvis biverkningsrapportering, är svårt att använda som uppföljningsmått, men skulle kunna användas för att studera rapporteringsvilja och medvetenhet om rapportering. Hälso- och sjukvårdens behov av kommunikation inom läkemedelssäkerhet kommer att ändras över tid. Målgruppens behov behöver därför följas upp med viss regelbudenhet. I samband med en vidareutveckling av kommunikationsinsatser behövs uppföljning för att Läkemedelsverket ska veta vilken effekt satsningen haft. Uppföljning av säkerhetskommunikation bör ske återkommande och strukturerat. I samband med en vidareutveckling av Läkemedelsverkets kommunikation om läkemedelssäkerhet föreslås även att rutiner för uppföljning av kommunikation inom området fastställs. 3 BEHOV OCH FÖRESLAGNA INSATSOMRÅDEN 3.1 Behov 3.1.1 Hälso- och sjukvårdens behov Vårdskador kopplade till läkemedelsbehandling fortsätter att vara vanligt förekommande i svensk sjukvård. Det finns också resultat som visar att patienter inte upplever att de får den information om läkemedel som de har behov av. Detta utgör viktiga argument för att Läkemedelsverket ska vidareutveckla kommunikationen inom området läkemedelssäkerhet, så att den anpassas utifrån behov hos hälso- och sjukvårdspersonal. Behov finns både av insatser som syftar till att öka medvetenheten och kunskapen om läkemedelssäkerhet och insatser för att förbättra tillgängligheten av produktrelaterad information. Hälso- och sjukvårdspersonal har behov av att tillgå säkerhetsinformation via de systemstöd som de använder i sitt dagliga arbete, som journalsystem och apotekens expedieringsstöd. Den digitala utvecklingen i samhället har medfört att hälso- och sjukvårdspersonal kommer att använda sig av den säkerhetsinformation som är enkelt tillgänglig via ett digitalt format. Genom att Läkemedelsverket tillhandahåller säkerhetsinformation som hälso- och sjukvården har behov av i maskinläsbart format minskas riskerna för spridning av information om läkemedelssäkerhet som inte uppfyller de krav på kvalitet och aktualitet som krävs för denna typ av information. En viktig aspekt är att hälso- och sjukvårdspersonal har behov både av att nå information om läkemedelssäkerhet via de arbetsredskap som används vid läkemedelshantering kopplad till en specifik patient/kund, men också av att söka information utanför journalsystem, ordinationsstöd och expedieringsstöd. Därför behöver information om läkemedelssäkerhet finnas sökbar per läkemedelsprodukt, exempelvis via Läkemedelsfakta, och information av mer generell karaktär behöver vara sökbar via Läkemedelsverkets webbplats. Behovet av lättillgänglig information om läkemedelssäkerhet ur ett brett perspektiv, som är satt i ett kliniskt relevant sammanhang framkom på flera sätt under förstudiearbetet. Det förekommer omfattande information om läkemedelssäkerhet, vilket gör det särskilt viktigt att utveckla 61 http://www.vardanalys.se/Pagaende-projekt/En-samlad-uppfoljning-av-Nationella-riktlinjers-effekter-papatientperspektivet/ Sida: 26(31) informationsstrukturen, så att informationen blir enkelt sökbar. Det är också viktigt att målgruppen kan välja grad av fördjupning. Läkemedelssäkerhet är ett viktigt område för alla som arbetar med vård eller omsorg av läkemedelsbehandlade personer. I verksamheterna finns hälso- och sjukvårdspersonal som i hög grad är specialiserade på läkemedel, som har behov av att tillgång till komplex och detaljerad information om läkemedelsäkerhet. Information om läkemedelssäkerhet behöver också tillgängliggöras via flera olika kommunikationskanaler. Framför allt efterfrågas digitala format, men viss information är lämplig att spridas i utskriftsvänliga format. Grundutbildning, vidareutbildning och fortbildning inom området läkemedelssäkerhet är en förutsättning för flera yrkeskategorier. Detta är ytterligare ett argument för att Läkemedelsverket behöver satsa på informationsmaterial som är användbara i utbildnings- och fortbildningssammanhang. 3.1.2 Läkemedelsverkets behov För att värna folkhälsan och patientsäkerheten behöver Läkemedelsverket kontinuerligt vidareutveckla informationen om läkemedelssäkerhet, så att den är anpassad utifrån mottagarnas behov. Syftet med information om läkemedelssäkerhet av akut art är att snabbt nå ut till målgruppen med aktuell säkerhetsinformation för att värna folkhälsa och tillförsäkra att läkemedelsprodukter används på ett så säkert och effektivt sätt som möjligt. Dessutom kan effektiv säkerhetsinformation av hög kvalitet påverka förtroendet för det regulatoriska systemet för läkemedel. Information om läkemedelssäkerhet av långsiktig, kunskapsfrämjande karaktär behövs för att hälso- och sjukvårdspersonal ska kunna tolka och tillämpa säkerhetsinformation av akut karaktär, men är också viktig för att främja biverkningsrapportering. Den lagstiftning om säkerhetsövervakning av läkemedel som trädde i kraft 2012 syftade till att öka transparensen kring läkemedelsmyndigheternas säkerhetsövervakning. Den innebar också att läkemedelsmyndigheternas ansvar för säkerhetsproblem i samband med läkemedelshanteringsfel, missbruk, yrkesexponering och off label-användning förtydligades, vilket medför ett behov av vidareutveckling av Läkemedelsverkets kommunikation kring dessa aspekter av läkemedelssäkerhet. För att kunna förmedla denna bredd av området läkemedelssäkerhet finns behov av samverkan med andra nationella aktörer. Återkoppling av säkerhetsövervakning av läkemedel är viktigt för att öka medvetenheten om riskerna, men också för att främja biverkningsrapporteringen, vilket också lyftes i lagstiftningen från 2012. Erfarenheter från pågående aktiviter inom området säkerhetskommunikation bland europeiska läkemedelsmyndigheter kan tillvaratas, vilket talar för att det är lägligt att genomföra en vidareutveckling. Ytterligare ett viktigt argument för en vidareutveckling är utvecklingen inom området e-hälsa, som medfört att Läkemedelsverket kan nyttja digitala kommunikationskanaler för att nå hälso- och sjuvårdspersonal på ett effektivt sätt med information om läkemedelssäkerhet. För att säkerställa att hälso- och sjukvårdspersonal använder samma underlag om läkemedelssäkerhet för sina beslut finns behov av att vidareutveckla hur Läkemedelsverkets distribuerar säkerhetskommunikation. Läkemedelsverket skulle i och med en satsning på att tillgängliggöra säkerhetsinformation i digitalt format anpassat för att distribueras vidare stärka insatserna inom e-hälsoområdet och få ytterligare möjligheter att ge hälso- och sjukvårdspersonal återkoppling kring aktuella säkerhetsutredningar. Den säkerhetsinformation som Läkemedelsverket förfogar över är avsedd för olika målgrupper, och uppvisar varierande komplexitet. Viss information är anpassad till att kunna vara användbar för allmänhet och annan för hälso- och sjukvårdspersonal, i synnerhet förskrivare. Läkemedelsverket och EMA har dessutom en hel del komplex säkerhetsinformation som i dagsläget inte är specifikt anpassad utifrån hälso- och sjukvårdens behov. I vissa fall skulle sådan information kunna synliggöras för att i Sida: 27(31) större utsträckning bli användbar för olika funktioner med uppdrag att förmedla läkemedelsinformation, såsom läkemedelskommittéer, läkemedelsinformationscentraler, landstingens och apotekens egna kunskapsorganisationer och hälso- och sjukvårdspersonal med specifika uppdrag inom läkemedelsområdet. Dessa har i sin tur möjlighet att selektera och sprida informationen på ett målgruppsanpassat sätt till sina respektive mottagare. Läkemedelsverket har goda förutsättningar för att ansvara för ytterligare insatser kring långsiktig, kunskapsfrämjande rapporteringen om läkemedelssäkerhet: • Läkemedelsverket förmedlar en balanserad bild av förhållandet mellan effekt och säkerhet. Risk finns att säkerhetsinformationen skulle bli mer ensidigt belyst om annan aktör ansvarade för den långsiktiga rapporteringen. • Läkemedelsverket är ägare till flera av de data- och informationskällor som rapporteringen om läkemedelssäkerhet bygger på. • Läkemedelsverket har kommunikationskanaler/verktyg som redan idag används för kommunikation om läkemedelssäkerhet. • Läkemedelsverket har förutsättningar att arbeta långsiktigt med rapportering om läkemedelssäkerhet till hälso- och sjukvårdspersonal. • Läkemedelsverkets är en väl etablerad kommunikatör på området läkemedelssäkerhet, och har hög trovärdighet hos målgruppen hälso- och sjukvårdspersonal. Eftersom flera nationella aktörer har uppdrag inom läkemedelssäkerhet finns behov av samverkan kring delar av informationen. En vidareutveckling som omfattar ökad samverkan mellan nationella aktörer förväntas bidra till samordning på området läkemedelssäkerhet och ökad förståelse för de olika aktörernas uppdrag. 3.2 Föreslagna insatsområden för vidareutveckling För att vidareutveckla Läkemedelsverkets kommunikation om läkemedelssäkerhet med syfte att förbättra tydlighet och lättillgänglighet samt främja ett systematiskt lärande föreslås tre insatsområden. Insatsområdena täcker olika informationsbehov och möjliggör anpassning till målgruppens skiftande krav på format och distribution. Att flera områden för vidareutveckling presenteras möjliggör också en stegvis utveckling. Nedan följer en kortfattad beskrivning av identifierade områden: Säkerhetsinformation i maskinläsbart format Förslaget innebär utveckling av Läkemedelsverkets kommunikationsverktyg (såsom Nationella Produktregistret, Nationella Substansregistret och Läkemedelsfakta), så att viss säkerhetsinformation tillgängliggörs i systematiserad, digital och maskinläsbar form och görs sökbar utifrån läkemedelsprodukt och substans. På detta sätt kan säkerhetsinformationen få en ökad spridning och blir tillgänglig för vidareutnyttjande av andra aktörer för distribution via olika elektroniska beslutsstöd. Säkerhetsinformation skulle på så vis kunna tillgängliggöras via arbetsredskap i läkemedelshanteringen, såsom journalsystem inom vården och apotekens expedieringssystem. Förslaget förutsätter ett fördjupat utredningsarbete, med fokus på tekniska och legala aspekter samt på praktiska aspekter för varje typ av information. Exempel på information som skulle ingå i detta fortsatta utredningsarbete är: DHPC, resultat från genomförda säkerhetsutredningar, akuta indragningar, nyheter om akuta larm, information om utökad övervakning, förändrad produktinformation (exempelvis begränsad indikation, nytillkommen kontraindikation, Sida: 28(31) förändrad dosering), påvisade kvalitetsproblem, kommande avregistrering, säkerhetsrelaterad information i godkänd produktinformation samt information om restnoteringar62. Även funktionen ”färdiga sökningar” i Läkemedelsfakta skulle kunna omfattas av det fördjupade utredningsarbetet för att utvärdera möjligheterna till ytterligare färdiga sökningar, som exempelvis läkemedelsprodukter som bytt namn under året och avregistrerade produkter. Norge och Tjeckien är exempel på europeiska läkemedelmyndigheter som satsat på att tillgängliggöra information om läkemedelssäkerhet så att den kan nås per läkemedelsprodukt via ordinationsstöd, respektive via apotekens datasystem63. Den amerikanska läkemedelsmyndigheten FDA håller också på att utöka informationen om läkemedel som finns tillgänglig som öppna data via extern webbplats64. Att tillgängliggöra ytterligare information i maskinläsbart format är resurskrävan och förknippat med omfattande teknisk utveckling. Resurser behöver också kunna avsättas under en lång period för att täcka förvaltningskostnader. En förutsättning för att kunna tillgängliggöra ytterligare information i maskinläsbart format är tilldelning av resurser för genomförande och förvaltning. För ett fördjupat utredningsarbete är samverkan med eHälsomyndigheten, Inera, SKL och LIF en förutsättning. Strukturerad information om läkemedelssäkerhet via Läkemedelverkets externa webbplats Förslaget innebär att Läkemedelsverket utvecklar informationsstrukturen och innehållet om läkemedelssäkerhet på externa webbplatsen. Utvecklingsarbetet föreslås vara ett prioriterat område inom ett redan planerade arbete med Läkemedelsverkets externa webbplats. En viktig målsättning är att förbättra sökbarheten av den säkerhetsinformation som Läkemedelsverket förvaltar. För förbättrad sökbarhet via webbplatsen föreslås ett systematiseringsarbete av informationen (förse informationen med metadata så att specifika säkerhetsproblem och terapiområden görs sökbara). Även nyheter som rör läkemedelssäkerhet kan taggas med metadata för att specifik kategori av nyhet eller terapiområde ska kunna identifieras. Genom att strukturera informationen om läkemedelssäkerhet blir den också lättare att länka till från andra aktörers webbsidor, som exempelvis ”Kunskapsguiden65” eller liknande nationell kunskapsportal. Flera europeiska läkemedelsmyndigheter har organiserat sina webbplatser så att information som belyser läkemedelssäkerhet ur ett bredare perspektiv finns strukturerat via en ingångssida. Förslaget att vidareutveckla informationen om läkemedelssäkerhet på Läkemedelsverkets externa webb utgår från europeiska riktlinjer, GVP module XV, där det anges att: “A website is a key tool for members of the public (including patients and healthcare professionals) actively searching the internet for specific information on medicinal products. Competent authorities as well as marketing authorisation holders should ensure that important safety information published on websites under their control is easily accessible and understandable by the public“. Eftersom ett utvecklingsarbete av Läkemedelsverkets externa webbplats planeras i närtid behöver ett arbete med att vidareutveckla informationen om läkemedelssäkerhet ske inom 62 Att analysera hur information om restnoteringar kan tillgängliggöras på ett mer systematiskt ingår i pågående regeringsuppdrag, S2014/3699/FS. 63 http://www.scopejointaction.eu/ 64 https://open.fda.gov/about/ 65 http://www.kunskapsguiden.se/Sidor/start.aspx Sida: 29(31) ramen för detta. Arbetet föreslås ske i samverkan med representanter för hälso- och sjukvården. Erfarenheter från andra europeiska läkemedelsmyndigheter kan vara användbara i arbetet. Kunskapsfrämjande insatser Förslaget innebär att Läkemedelsverket genomför kunskapsfrämjande insatser på området läkemedelssäkerhet, anpassade utifrån hälso- och sjukvårdens behov. Ökat läkemedelssäkerhetsperspektiv i Läkemedelsboken, en kunskapsbank med fallbeskrivningar och moduler för webbutbildning är exempel på insatser som har efterfrågats av hälso- och sjukvårdspersonal. Syftet med satsningar på kunskapsfrämjande insatser bör vara att ge en helhetsbild av det läkemedelssäkerhetsarbete som utförs i Sverige och beskriva hur hälso- och sjukvårdspersonal ska hantera identifierade läkemedelssäkerhetsrisker, misstänkta biverkningar och vårdskador med misstänkt koppling till läkemedelsbehandling. Såväl Läkemedelsvekets uppdrag kring säkerhetsövervakning av läkemedel som andra nationella myndigheters uppdrag på området (exempelvis lagstiftning kring läkemedelshantering och patientsäkerhet samt tillsyn av hälsooch sjukvård), sjukvårdens arbete (exempelvis händelseanalys, hälso- och sjukvårdspersonalens läkemededelssäkerhetsarbete i praktiken samt förebyggande initiativ) och övriga aktörers roller (exempelvis möjlighet för patienter att ansöka om ersättning för läkemedelsrelaterad skada) föreslås ingå. Arbetet med kunskapsfrämjande insatser inom läkemedelsäkerhet behöver ske i samverkan med andra nationella aktörer på området, som Socialstyrelsen, IVO, SKL och representanter från landsting och kommuner. Samråd behöver ske med representanter för professionen, och med representanter för grund- och vidareutbildning samt fortbildning inom området. 3.3 Förväntad nytta Förväntad nytta för insatser inom respektive område för olika intressenter presentera i Tabell 1. Tabell 1. Siffrorna inom parentes hänvisar till insatsområdens 1) Säkerhetsinformation i maskinläsbart format, 2) Strukturerad information om läkemedelssäkerhet via Läkemedelverkets externa webbplats, 3) Kunskapsfrämjande insatser. Intressent Nytta Patienter/konsumenter Säkrare läkemedelsbehandling (1-3). Långsiktig målsättning är att en ökad medvetenhet hos hälso- och sjukvårdspersonal om läkemedelssäkerhet bidrar till en säkrare läkemedelsbehandling. Hälso- och sjukvårdspersonal Ökad medvetenhet om läkemedelssäkerhet och dess betydelse för patienten (1-3). Ökad kunskap om rapportering av biverkningar (2-3). En bredare målgrupp nås med information om läkemedelssäkerhet (1-3). Ordinatören får förbättrad tillgång till säkerhetsinformation i ordinationsögonblicket (1) och i patientmötet (1-2). Upplevd förbättrad service utförd av Läkemedelsverket (1-3). Hälso- och sjukvårdspersonal under utbildning Ökad spridning och användning av information om läkemedelssäkerhet (1-3) på relevanta grundutbildningar. Ökad kunskap förväntas leda till större trygghet kring läkemedelsbehandling hos nyutexaminerad hälso- och sjukvårdspersonal (1-3). Sida: 30(31) Folkhälsomyndigheterna och andra aktörer verksamma inom området läkemedelssäkerhet Utökad samverkan kring läkemedelssäkerhet där olika aktörers roller och ansvar kan synliggöras (1-3). Ökat förtroende för folkhälsomyndigheternas arbete kring läkemedelssäkerhet. Förbättrad samordning av information kring läkemedelssäkerhet. Ett utökat samarbete kring rapportering om läkemedelssäkerhet antas även kunna bidra till att områden som är i behov av insatser synliggörs på ett tydligare sätt. Läkemedelsföretagen (MAH) MAH är inte den primära målgruppen för detta arbete, även om rapporteringen kan komma också MAH till nytta genom att information om läkemedelssäkerhet blir mer lättillgänglig. Läkemedelsverket Stärkt nationell dialog om läkemedelssäkerhet (1-3). Ökad kunskap om och förtroende för Läkemedelsverkets arbete för ändamålsenlig läkemedelsanvändning (1-3). Förbättrad spridning av aktuell säkerhetsinformation (1). Enklare för Läkemedelsverkets anställda att söka rätt på information om läkemedelssäkerhet (1, 2). Förbättrat nyttjande av befintliga kommunikationskanaler (1-3). Ökad kunskap hos Läkemedelsverkets anställda om andra nationella aktörers arbete med läkemedelssäkerhetsfrågor (2, 3). 4 SLUTSATSER FRÅN FÖRSTUDIEN Syftet med förstudien är att beskriva hur Läkemedelsverket behöver vidareutveckla kommunikationen om läkemedelssäkerhet för att den ska vara tydlig, lättillgänglig och främja ett systematiskt lärande, med hälso- och sjukvårdspersonal och berörda beslutsfattare som målgrupp. Följande slutsatser har dragits utifrån arbetet med förstudien och rapporten Läkemedelssäkerhet 2013: För att kunna möta behov hos målgruppen och förbättra tydligheten och tillgängligheten, samt främja ett systematiskt lärande behövs en vidareutveckling både av säkerhetsinformation av produktrelaterad, akut karaktär och av långsiktig, kunskapsfrämjande rapportering. Identifierade behov hos hälso- och sjukvårdsperosonal sammanfattades i: - Säkerhetsinformation som är tillgänglig via de systemstöd som hälso- och sjukvårdspersonal använder i sitt dagliga arbete, som journalsystem och apotekens expedieringsstöd. - Lättillgänglig information om läkemedelssäkerhet ur ett brett perspektiv, som är satt i ett kliniskt relevant sammanhang. - Informationsmaterial som är användbara i utbildnings- och fortbildningssammanhang. Internationell utveckling, i synnerhet den lagstiftning om säkerhetsövervakning av läkemedel som trädde i kraft 2012, ligger till grund för förslaget om vidareutveckling av Läkemedelsverkets kommunikation inom området läkemedelssäkerhet. Genom vidareutveckling kan de förändringar som lagstiftningen inneburit på ett optimalt sätt komma svensk hälso- och sjukvårdspersonal till nytta. Utvecklingen på e-hälsoområdet får också konsekvenser för hur Läkemedelsverkets information om läkemedelssäkerhet vidareutvecklas. Här kan Läkemedelsverket nyttja utvecklingen för att nå hälsooch sjukvårdspersonal med information om läkemedelssäkerhet. Både utvecklingen inom området e- Sida: 31(31) hälsa och utveckling inom patientsäkerhetsområdet, med den patientlag som trädde i kraft januari 2015, och det pågående arbetet kring säkerhetskommunikation bland europeiska läkemedelsmyndigheter talar för att det är lägligt att genomgöra insatser inom området säkerhetskommunikation. Ytterligare slutsatser kring genomförandet av en vidareutveckling är: Att befintlig teknik, befintliga kommunikationsverktyg och strukturer för informationsförmedling till hälso- och sjukvårdspersonal bör användas. Att informationen behöver målgruppsanpassas. Att samverkan mellan nationella aktörer kring viss information om läkemedelssäkerhet kan underlätta hälso- och sjukvårdens arbete inom området. Att en vidareutveckling bör utgå från pågående europeiska initiativ kring läkemedelsmyndigheternas säkerhetskommunikation. Att rutiner för uppföljning av kommunikation inom läkemedelssäkerhet fastställs i samband med en vidareutveckling. I kontakt med representanter för målgruppen blev det tydligt hur skiftande önskemålen på format, innehåll och distribution är. Det är också tydligt att Läkemedelsverket redan har flera lämpliga kommunikationskanaler som kan användas för att förmedla information om läkemedelssäkerhet. Den genomförda inventeringen av information inom området läkemedelssäkerhet visar på bredden av aktörer som är involverade. För att förmedla en bild av läkemedelssäkerhetsarbetet i Sverige som är relevant för hälso- och sjukvårdspersonal finns behov av samverkan kring viss information på området. I arbetet med rapporten Läkemedelssäkerhet 2013 sammanställdes information om läkemedel per terapiområde snarare än utifrån typ av data. En slutsats från utvärderingen av rapporten var att denna bearbetning av informationen underlättar väsentligt när Läkemedelsverket vill återkoppla till målgruppen hälso- och sjukvårdspersonal vad arbetet med säkerhetsövervakning av läkemedel resulterat i. För att möte identifierade behov föreslås tre insatsområden för vidareutveckling: 1. Säkerhetsinformation i maskinläsbart format, så att ytterligare produktrelaterad säkerhetsinformation kan spridas vidare via vårdens och apotekens egna systemstöd. 2. Strukturerad säkerhetsinformation via Läkemedelverkets externa webbplats, för att underlätta sökbarhet och förmedla en bredare bild av området läkemedelssäkerhet. 3. Kunskapsfrämjande insatser, för att öka medvetenheten om läkemedelselssäkerhet hos hälso- och sjukvårdspersonal och hälso- och sjukvårdspersonal under utbildning. För att möjliggöra en vidare utveckling behövs långsiktig finansiering. Samtliga insatsområden innebär samverkan med andra aktörer inom området läkemedelssäkerhet och läkemedelsinformation, samt med företrädare för målgruppen.