Hur leder dålig djurhållning till antibiotikaresistens?
advertisement

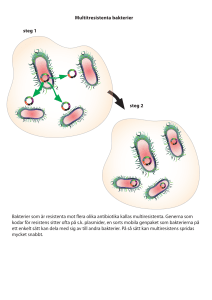
Hur leder dålig djurhållning till antibiotikaresistens? Sara Thedvall Independent Project in Biology Självständigt arbete i biologi, 15 hp, vårterminen 2014 Institutionen för biologisk grundutbildning, Uppsala universitet Sammanfattning I takt med att allt mer antibiotika används och att världen blir allt mer globaliserad ökar och sprids antibiotikaresistensen. Djurhållningen i världen kantas av stressgivande miljöer som för små utrymmen och för många djur per yta. Det får djuren att drabbas av infektioner som vi botar med antibiotika. Antibiotika används även inom djurhållning i tillväxtfrämjande syfte och för att förebygga sjukdom och minska stress. Denna fel- och överbehandling av antibiotika i kombination med att vi använder samma sorts antibiotika inom human sjukvård som inom djurhållning gör att våra livsmedelsproducerande djur utgör en smittorisk för resistenta bakterier som hotar att nå oss via bland annat livsmedelskedjan. I och med att djuren medicineras via tillägg i foder och vatten och att upp till 90% av antibiotikan följer med fekalierna ut, sprids resistensen i naturen då stor del av fekalierna distribueras på jordbruksåkrar i fertiliserande syfte. Det ökar på spridningsrisken samt utgör ytterligare en risk för oss när vi äter grödorna. Från akvakulturer hamnar ungefär 80% av antibiotikan i det omgivande vattnet och i sedimentet och kan därifrån spridas till havets mikrober, vidare till fisk- och skaldjurspatogener och sedan till terrestra bakterier. Åtgärder till dessa problem innefattar att minska spridningen och förhindra uppkomsten av resistenta bakterier. Man bör forska fram fler antibiotika exklusivt för en sektor, i första hand vaccinera och när man måste använda antibiotika bör det vara en smalspektrumsvariant. Man måste också förbättra den globala djurhållningsstandarden, så att risken för spridning minskar vid resor och handel. Det krävs också ett ökat kunskapsläge och ett gemensamt internationellt samarbete för minskad och mer restriktiv antibiotika-användning. Inledning Antibiotikaresistens är ett problem som växer sig allt större. I dagsläget finns det bakterieinfektioner som trotsar all antibiotika vilket påverkar oss alla, lokalt som globalt, med högre vårdkostnader, längre behandlingstider och högre dödlighet. I takt med att fler antibiotika blivit verkningslösa har nya antibiotika utvecklats i hopp om att kunna behandla de resistenta bakterierna. Dagens antibiotika upptäcktes 1929 och användes till människor för första gången 1941 (Abraham et al. 1941), medan den inom animalsektorn har antibiotika använts sedan 60 år (Kemper 2008). Dagens djurhållning i världen kantas för vinstintressets skull, av små utrymmen och stor antibiotikaanvändning, i många fall i tillväxtfrämjande syfte. Antibiotikaresistens varnades för redan 1945 men trots det har inte mycket hänt, förutom att försöka skapa nya antibiotika. Nuförtiden utvecklas och introduceras det mycket få nya antimikrobiella läkemedel på marknaden och det är ett allvarligt problem. Om flera antibiotika blir ineffektiva på grund av resistenta bakterier har vi snart inget försvar mot dessa bakterier kvar, vilket gör att sjukdomar som idag inte är ett problem kan bli letala i framtiden. WHO (2007a) anser därför att antibiotikaresistens är ett av nutidens allvarligaste folkhälsoproblem. Med det här som bakgrund vill jag med den här artikeln ta reda på hur dålig djurhållning kan leda till antibiotikaresistens, vad vi kan och bör göra för att förhindra antibiotikaresistensens uppkomst och spridning samt hur vi ska minska resistensrisken och mängden antibiotika men samtidigt kunna behålla levnadsstandarden för oss och vår boskap? 1 Antibiotika Läkemedel som är verksamma mot bakterieinfektioner kallas för antibiotika. Dessa mediciner förstör prokaryota celler utan att inverka på eukaryota celler. Dagens antibiotika upptäcktes 1928 av Alexander Fleming då han observerade att en bakteriekultur (Staphylococcus aureus) hämmats av blåmöglet Penicillium notatum (Fleming 1929). Detta penicillin gavs för första gången till en mänsklig patient 1941 (Abraham et al. 1941) och kom att användas flitigt under andra världskriget (Gustafson 1997). Veterinärer började använda antibiotika under samma årtionde (Gustafson 1997), men inom djurhållningen började man inte använda antibiotika på allvar förrän i början av 1950-talet (Kemper 2008). Antibiotika som läkemedel är dock ingenting nytt. Redan i det gamla Egypten för 3500 år sen hyllades möglet för sina helande effekter och spår av 2000 år gamla tetracykliner har hittats i mänskliga skelett från Nubien. Det tyder på att människorna åt mat som innehöll antibiotika, som till exempel mögligt bröd (Basset 1980). Under 1900-talet har dock utvecklingen gått framåt med framställnngen av flera antibiotikagrupper per decennium (Tabell 1). 1942 upptäcktes den första antibiotikaresistensen i och med att den tillgängliga antibiotikan blev mindre verksam (Appelbaum 2007) och därför skapades nya antibiotika för både humant och animalt behov. När man sökte efter ett billigare substitut för vitamin B12 (vitamin B12 främjar bland annat bildandet av nukleinsyra och därav tillväxt i kroppen), genom att studera foder med rester av fermenterade tetracykliner, fann man att antibiotikumet, förutom att kontrollera smittspridning mellan djuren, ökade viktuppgången för kycklingar, nötkreatur och svin, samt minskade mängden foder de behövde innan de nådde upp till marknadsvikten. Man märkte sedan samma effekter hos andra antibiotika (Gustafson 1997). Fleming, som fick Nobelpriset i fysiologi eller medicin 1945, varnade redan då för antibiotikaresistens i sitt tacktal (Ingdahl 2012). Det finns olika sätt för olika antibiotika att ta död på bakterier (Tabell 1), där de mest använda grupperna av antibiotika för både djur och människor är β-laktam (till exempel penicilliner och cefalosporiner), tetracykliner, fluorokinoloner och folsyrahämmare (exempelvis trimetoprim/TMP och sulfonamider/SMX), där β-laktam är den största gruppen (Neu 1992). Man kan dela in antibiotika i två grupper: smal- och bredspektrumantibiotika. Smalspektrumantibiotika är effektiva mot en specifik sorts bakterie medan bredspektrumantibiotika är effektiva mot många olika sorters bakterier. Smalspektrumantibiotika utgör därmed en lägre risk för att resistens ska uppstå. 2 Tabell 1. Tidslinje för olika antibiotika och hur de verkar i bakterieceller. Årtal: a = upptäckt, b = introduktion, c = när resistens hittades. a, b, c Verkningssätt för antibiotika Exempel på Årtal antibiotika a b c Hämmar cellväggssyntesen genom att få bakteriens β-laktam 1928, 1938, 1945 transpeptidas att binda till fel enzymkomplex så bakterierna lyserar Hämmar folsyrasyntesen så bakterierna inte kan celldela SMX a 1932, 1936, 1942 Hämmar proteinsyntesen genom att binda till ribosomens 30S-enhet så aminoacyl-tRNA inte kan binda Tetracykliner a 1944, 1952, 1950 Hämmar proteinsyntesen genom att binda till ribosomens 50S-enhet så aminoacyl-tRNA inte kan binda Makrolider a 1948, 1951, 1955 a 1961, 1968, 1968 Hämmar nukleinsyrasyntesen genom att blockera Fluorokinoloner topoisomerasreaktionen så fogningen av DNAsträngarna går sönder Referenser: Faktatillägg till tabellen från Neu 1992. Omritad efter Lewis 2013. b c b c b c b c Hur används antibiotika? Antibiotika används förutom inom humanvård även för veterinärt bruk, djurhållning samt för jordbruk och akvakulturer (Barbosa & Levy 2000). Till livsmedelsproducerande djur används antibiotika av flera anledningar: behandla och förhindra sjukdom, parasiter, svampar och stress samt i tillväxtfrämjande syfte, där alla sker genom tillägg i foder och vatten (McEwen & Fedorka-Cray 2002, Kumar et al. 2005, Shah et al. 2014). I Sverige förbjöds antibiotika som tillväxtfrämjande medel redan 1986 medan det dröjde ända till 2006 innan samma lagar infördes för övriga EU (Cogliani et al. 2011). Resten av världen har inget förbud mot tillväxtfrämjande antibiotika (Viswanathan 2006). Statistik från Jordbruksverket (2012) visar att försäljningen av antibiotika till djur i Sverige har minskat från ca 45 ton 1986 till 11,79 ton 2012. Jämfört med andra europeiska länder ligger Sverige därför bland de som använder minst antibiotika (Figur 1) (Grave 2010). Figur 1. Mängden veterinärantibiotika (tetracykliner, SMX, fluorokinoloner, makrolider, β-laktam samt övriga) som sålts 2007 i mg/kg biomassa av gris-, kyckling- och nötkreaturkött som producerats plus estimerad vikt hos levande mjölkkor. Omritad efter Grave (2010). 3 Antibiotikaresistens När man behandlar med antibiotika finns det alltid en risk att en del bakterier överlever. De som överlever gör det eftersom de har en viss egenskap som gör dem motståndskraftiga – resistenta. Det finns tre sätt som bakterier kan förvärva resistents genom: spontana mutationer, rekombination och transposition. Transposition innebär att DNA-segment omfördelas inom genomet med hjälp av transposoner – ”hoppande gener”. Vissa specialiserade transposoner kallas integroner och är riktiga mästare på att fånga in nya gener. Rekombination är horisontell överföring där DNA förs över från en bakterie till nästa och det kan i sin tur skötas på tre sätt (Figur 2) (Levy 1998, Barbosa & Levy 2000): Ø Konjugering – resistensgener (oftast plasmider - cirkulära DNA-molekyler som finns fritt i bakteriecytosolen) överförs via ett pilus (proteinrör) från en bakterie till en annan. Detta kan ske både inom och mellan bakteriearter (A). Ø Transduktion – bakteriofager överför resistensgener från en bakterie till nästa. Bakteriofager infekterar bakterier med sitt eget DNA. Bakterien replikerar virusets DNA och får sitt eget DNA sönderstyckat. När nya fager sedan sätts ihop kan vissa delar av bakteriens DNA komma med. När fagen med bakterie-DNA sedan infekterar nästa bakterie kan den första bakteriens resistensgener överföras till den andra bakterien (B). Ø Transformation – upptag av fritt DNA från omgivningens döda bakterieceller. Apatogena bakterieceller kan ta upp patogena DNA-strängar och sådeles bli patogena bakterier (C). I och med att en mottagare förvärvar nytt DNA via rekombination, förändras dess genotyp (och eventuellt fenotyp) och mottagaren blir också resistent mot samma antibiotikum som donatorn. Figur 2. Tre olika rekombinationssätt bakterier kan förvärva antibiotikaresistens genom: A) få plasmider från en annan bakteriedonator, B) en bakteriofag tar med sig genen från en bakterie till nästa, C) ta upp löst DNA från döda bakterieceller. Omritad efter Levy (1998). 4 Enligt Neu (1992), Levy (1998) och Wilke et al. (2005) finns det tre sätt för bakterier att vara resistenta mot antibiotika (Figur 3): Ø Förhindra att antibiotikan får tillgång till bindningsstället genom att ändra cellväggens genomsläpplighet eller använda effluxpumpar i cellväggen som aktivt pumpar ut antibiotikan (A). Ø Producera enzym som bryter ner eller förändrar antibiotikan innan den når fram till sitt bindningsställe och därför inte kan binda (B). Ø Förändra de proteiner antibiotikan ska binda till så att läkemedlet får svårt att hitta bindningsstället (C). Antibiotikaresistens kan vara nedärvd, vilket sker vertikalt, det vill säga från en modercell till två dotterceller, eller förvärvad, vilket tillkommer horisontellt. Om resistens mot ett antibiotikum också ger resistens mot andra antibiotikum med samma verkningssätt kallas det korsresistens medan det kallas multiresistens om en bakteriestam blir resistent mot flera antibiotika med olika verkningssätt. När två eller fler resistensgener ligger nära varandra, till exempel på en plasmid, kallas det co-resistens där båda generna främjas vid selektion av den ena genen. Resistensen är klinisk om bakterierna inte bromsas av normal dosering vid behandling (EUCAST 2000). Figur 3. Olika sätt bakterier kan vara resistenta på: A) aktivt pumpa ut antibiotikan ur cellen, B) bryta ner antibiotikan med specifika enzym och C) kemiskt ändra antibiotikan så den inaktiveras. Omritad efter Levy (1998). En av anledningarna till att resistens uppkommit är att samma typer av antibiotika används inom flera sektorer; till exempel inom både human sjukvård och djurhållning (Barbosa & Levy 2000). Antibiotikaresistens som uppkommer inom en sektor kan lätt spridas vidare och skapa problem i en annan. Antibiotikaresistens är också ett resultat av för mycket och fel användning av antibiotika där fel dos ofta skrivs ut för fel antal dagar. Ibland skrivs antibiotika även ut mot virala infektioner där de inte alls har någon verkan (Barbosa & Levy 2000). Spridning Patogena bakterier som blivit resistenta är en direkt fara för både människor och djur eftersom de inte är behandlingsbara med antibiotika. Apatogena bakterier räknas dock inte som ofarliga, utan som en indirekt fara eftersom resistensgener fortfarande kan överföras till patogena bakterier (Wessels et al. 2004). Antibiotikaresistenta apatogena bakterier som hamnar i våra mag- och tarmkanaler kan föra vidare sin resistens till vår normala tarmflora. Därifrån kan generna via konjugering spridas till patogena bakterier i tarmarna som sedan kan göra oss eller andra sjuka (van den Bogaard & Stobberingh 2000). Det är vanligt att grampositiva bakterier överför resistenta gener till gram-negativa, men det är ovanligt att det går åt andra hållet (Neu 1992). 5 Resistenta bakterier kan spridas mellan djur och människor (så kallad zoonos) och nå oss vid direktkontakt med djur men också indirekt via livsmedelskedjan (Figur 4). Gödslade vegetabilier och vatten utgör en risk och likaså obehandlat eller felbehandlat kött (kontaminering vid slakt samt kors- och återkontaminering vid matlagning) (WHO 2007b, Egerwärn & Lindmark 2009). Figur 4. Antibiotikaresistensens spridning och hur de olika sektorerna påverkar varandra. Omritad efter McEwen & Fedorka-Cray (2002). Djurhållning Vad händer när djur blir stressade och ängsliga för att de bor och lever i en stressgivande miljö? Stressgivande faktorer som tagits upp av Penny et al. (1981), Hsia & Wood-Gush (1982), Petersen (1994), Schrøder-Petersen & Simonsen (2001) och McEwen & FedorkaCray (2002) är bland annat: Ø Ø Ø Ø Ø Ø Ø Ø Ø För små burar. För många djur på för liten yta. För liten utfodringsyta. För fiberfattigt foder (djuren blir inte mätta vilket skapar rastlöshet och irritation). Brist på stimuli. Sjukdom. Kyla och värme. Långa transportsträckor. Avvänjning från mamman (ungdjuren har tagits bort för tidigt från moderns mjölk och getts riktigt foder istället). Schrøder-Petersen & Simonsen (2001) hänvisar till en stressmodell av Moberg (1985) som visar att hög och ständig stressnivå bland djur i slutändan leder till lägre reproduktion, ändrad metabolism, onormalt beteende och död. Stressade kycklingar börjar enligt Blokhuis (2000) att hacka på varandra och plocka bort fjädrar vilket kan gå så långt att huden skadas eller än värre; att de blir hackade till döds, så kallad kannibalism. Blokhuis (2000) berättar också att oroliga grisar biter varandra i svansen och i öronen, ibland till den grad att de ramlar av. Schrøder-Petersen & Simonsen (2001) visar också att kannibalism även förekommer hos grisar, liksom viktnedgång och smittspridning vid öron- och svansbitning. Dessa onormala beteenden kan ge upphov till infektioner som lätt sprider sig till andra delar av grisarna, ofta till bronkerna. En nederländsk granskning av suggor på 438 bondgårdar visade ett samband mellan luftrörsproblem och öron- och svansbitning. Därför använder man nästan alltid antibiotika för att bota infektionerna (Schrøder-Petersen & Simonsen 2001). Fraser (1987) studerade hur mineralbrist hos grisar kan leda till att de blir attraherade av blod. Genom att låta grisarna välja mellan två olika canvasmodeller av grissvansar (den ena vanlig och den andra täckt av grisblod) såg han att grisarna föredrog att tugga på den blodiga. Det tolkade han som att en blödande svans stimulerar till fortsatt bitande. Schrøder-Petersen & 6 Simonsen (2001) nämner även att svansbitning, när den väl börjat, kan bli ett återkommande beteende både från den utsatta grisen och från andra i samma hage. Juvenila grisar lär sig dessutom dessa beteenden genom att titta på de adulta djuren. Penny et al. (1981) och Hunter et al. (1999) visar att (speciellt kastrerade) galtar lider 70% större risk att bli bitna än suggor. Petersen (1994) studerade grisar som hade tillgång till bitleksaker och fått gå fritt under sina första 18 levnadsveckor. Han observerade då inga bett mellan grisarna som symboliserar anormalt beteende och Ekkel et al. (1995) observerade att grisar som fått leva i ”särskilt stressfria byggnader” (inga transporter, bra klimat och bra mat) från födsel till slakt bet sina medgrisar mycket mer sällan. När det kommer till levande djur handlar mycket om hur de ska transporteras till sitt nästa levnadsställe eller till slakteriet för att undvika spridning av resistenta bakterier. Broens et al. (2010) studerade ifall 117 stycken MRSA-negativa grisar kunde bli MRSA-positiva under transporten från bondgården till slakteriet (MRSA står för ”meticillinresistent Straphylococcus aureus”, en bakterie resistent mot all β-laktamantibiotika). De tog prover från grisarnas trynen på bondgården (0 stycken MRSA-positiva grisar), vid ankomsten till slakteriet (12 stycken MRSA-positiva grisar) och efter att grisarna slaktats (70 stycken MRSA-positiva grisar). Inom akvakultur hålls fisken på för trånga ytor i förhållande till antalet individer. Antibiotika tillsätts i fodret för att undvika infektioner från parasiter, svampar och bakterier, vilka ofta kan leda till fiskarnas död och tillkommer när fisk växer så nära inpå varandra, samt som ett tillväxtfrämjande medel (Shah et al. 2014). Akvakulturindustrin har vuxit snabbt de senaste decennierna för att tillfredsställa världens krav på fisk- och skaldjur eftersom de kraven inte kan mötas av fiskerier på grund av överfiske, föroreningar och habitatförstörelser (Akinbowale et al. 2006). Samband mellan djurhållning och antibiotikaresistens Enligt Levy (1998) och Phillips et al. (2004) är det vanligt att livsmedelsproducerande djur medicineras i grupp genom att man tillsätter antibiotika i djurens foder och vatten då det är mer effektivt att behandla djur som grupp än som individer. När det handlar om antibiotika som tillväxtfrämjande medel tillsätts en så pass låg dos till foder och vatten under flera veckor, ibland månader, att dosen inte kan slå ut infektioner. Det gör att resistensgener har tid att utvecklas och spridas bland populationen. Problemet med massmedicineringen är storskaligheten: tillväxten av resistenta bakterier är i relation till hur stor mängd antibiotika som använts på hur många individer och hur stor arean som blivit påverkad är. Ju mer storskalig behandlingen är, desto fler bakterier överlever och kan sprida sig med resistens i bagaget som bevis (Levy 2001). Ett ytterligare problem med massmedicinering är att sjuka djur sällan vill äta eller dricka vilket leder till att antibiotikadosen till största del ges till friska djur (Barton 2000). Sambandet ligger i att boskapen fungerar som en reservoar som överför resistenta bakterier till människan via livsmedelskedjan (kött, mjölk och ägg) – resistens som kommer utav feloch överbehandling av boskap med antibiotika (utskrivning av fel dos för fel antal dagar, massmedicineringar, antibiotika i tillväxtfrämjande syfte, fel antibiotikum för bakterierna eller verkningslös antibiotika mot virala infektioner (Barbosa & Levy 2000)). Har djuren resistenta bakterier i magen följer många av dem med ut och hamnar därmed på åkrarna 7 (McEwen & Fedorka-Cray 2002) och enligt Kumar et al. (2005) följer upp till 90% av oralt utdelade antibiotika med ut. Hamnar antibiotika ute i naturen följer en del av den med regnet och sprids vidare genom bäckar och grundvatten till sjöar och hav och kontaminerar dem med antibiotika eller hamnar i vilda djur som äter grödorna (Figur 4). Sjöar och hav kontamineras även genom akvakulturer: en del av fodret (upp till 80%) som ges till fiskarna äts inte utan hamnar tillsammans med fiskarnas urin och avföring i den omgivande akvatiska miljön. Antibiotika i vatten och sediment behåller ofta sin verkan och kan stanna kvar i miljön under en längre tid. Det gör att resistens kan uppstå hos sedimentets och vattenkolumnens mikrober för att sedan spridas vidare till fisk- och skaldjurspatogener och terrestra bakterier (Buschmann et al. 2012, Cabello et al. 2013). Buschmann et al. (2012) mätte mängden antibiotikaresistenta bakterier i sedimenten på en plats för akvakultur och på en plats utan. De fann att sedimentet under akvakulturen hade en signifikant ökning av de resistenta bakterierna, vilket ledde till beviset för att akvakulturer selekterar för antibiotikaresistens i marina sediment. Fey et al. (2000) visade i sin studie att resistens också kan överföras vid direktkontakt med djur. De studerade en 12-årig pojke vars pappa hade medicinerat sina nötkreatur. Pojken hade sedan blivit sjuk och det visade sig efter att man studerat isolat både från honom och nötkreaturen att han hade erhållit antibiotikaresistent Salmonella från djuren. Import/export Eftersom resistenta bakterier kan spridas från djur till människor och mellan människor så har det ökade resandet och den ökade importen/exporten av olika livsmedel och djur de senaste decennierna spelat stor roll (D’Aouse 1994, WHO 2007a). Sedan inträdet i EU 1995 redovisas inte ursprungslandet vid importer. Om varor har tullats på väg från ett tredje land in i EU anges endast avsändningslandet i EU medan varornas bestämmelseland redovisas vid export (Jordbruksverket 2013b). En konsekvens av detta är att konsumenterna inte kan vara säkra på vilket land livsmedlen ursprungligen kommer ifrån. Det gör att konsumenterna kan välja bort dyrt svenskt kött, för billigare importerat kött i tron om att livsmedlet kommer från ett land med låg resistensnivå i EU, när det i själva verket kommer från ett land på andra sidan världen som inte har ett bra resistensläge. Jordbruksverket (2013b, 2014) visar också att de största importländerna av livsmedel för Sverige år 2012 var Norge, Danmark, Tyskland och Nederländerna (här är tre av fyra EUländer) men vi importerade även kött, levande djur, frukt och grönt från bland annat: Brasilien, USA, Kina och Thailand. De länder vi främst exporterade till 2013 var Norge, Danmark, Finland, Tyskland och USA. Lewis et al. (2009) studerade minimajs importerade från Thailand som orsakade ett utbrott av Shigella sonnei i både Danmark (215 personer) och Australien (12 personer) år 2007. De studerade matprover, avföringsprover och miljöprover från ursprungslandet, importörerna, affärerna och konsumenterna och kom fram till att S. sonnei-isolat från testpersonerna var resistenta mot 5 antibiotikum. Från Danmark såldes minimajsen vidare till Sverige, där fyra personer i Skåne insjuknade - dessa personer hade dock besökt Danmark under tiden för det danska utbrottet. Minimajsen som sålts vidare från Danmark till Sverige var troligtvis inte smittad, eftersom det inte blev något utbrott i Sverige (Folkhälsomyndigheten 2014). 8 Fler studier har gjorts av Zhao et al. (2003), Nawaz et al. (2012) och Abgottspon et al. (2014). Zhao et al. (2003) studerade 187 Salmonella-isolat i USA från drygt 4000 importerade (från bland annat Sydostasien, Kanada, Ecuador och Danmark) matvaror (kryddor, ost, fisk- och skaldjur samt kyckling) och hittade resistens mot antibiotika viktiga för både djur och människor. Resistens hittades i 15 isolat för åtminstone ett antibiotikum och i 5 isolat för minst 3 antibiotikum. Nawaz et al. (2012) studerade existensen av Klebsiella spp. hos frusna, farmade jätteräkor (Penaeus monodon) importerade från Thailand till USA och fann 67 multiresistenta bakteriestammar. Abgottspon et al. (2014) studerade nio råa kycklingbröst, -lår och -vingar köpta i en Schweizisk affär där fyra av kycklingbitarna var lokala och fem var importerade. De fann 24 ESBL-resistenta Escherichia coli-stammar och kom sådeles fram till slutsatsen att kycklingkött kan vara en reservoar för bakteriefamiljen Enterobacteriaceae (bland annat E. Coli, Salmonella ssp., Shigella ssp. och Klebsiella ssp.). ESBL- egenskapen (kort för ”extended spectrum beta-lactamases”) är en av de viktigaste antibiotikaresistensmekanismerna som Enterobacteriaceae-familjen har. ESBL går ut på att bakterierna producerar plasmidburna enzymer som inaktiverar β-laktamantibiotika genom att hydrolisera antibiotikans β-laktamring och på så vis gör antibiotikan verkningslös. Det betyder alltså att de bakterier som förvärvat ESBL är antibiotikaresistenta (Abgottspon et al. 2013). Resor En stor del i många människors resande är att smaka på det lokala köket i landet vi kommit till. Mat och vatten i andra delar av världen har dock andra bakterier i sig än vi är vana vid och det leder för många till magsjuka och diarréer om man inte är försiktig. Det kan också leda till att man får i sig resistenta bakterier utan att man märker det. På den långa, trånga flygresan hem kan bakterier lätt spridas mellan människor (via till exempel nysningar, otvättade händer efter toalettbesök och flygsjuka) (Memish et al. 2003). Det är dock inte bara människor som reser. Bonnedahl et al. (2010) tog ett kloakprov från 100 stycken juvenila skrattmåsar (Larus ridibundus) på en ö utanför Karlmar. Frekvensen av ESBL-egenskapen var låg, men fanns (blaCTX-M-14 och blaCTX-M-15). Samma CTX-M finns hos människor med ESBL. Deras slutsats var att trots att ESBL-förekomsten i Sverige är låg så är det möjligt för egenskapen att spridas mellan människor och vilda djur. Veldmann et al. (2013) gjorde ett liknande exempel i Nederländerna. De tog också ett kloakprov, från 414 fågelkadaver från 55 arter, och hittade ESBL-resistenta E. Coli på 65 fåglar från 21 av arterna. De identifierade generna hade de plasmider som vanligtvis hittas i livsmedelsproducerande djur och i människor (även här blaCTX-M-14 och blaCTX-M-15). Oroväckande är att många fåglar är flyttfåglar och på så vis kan sprida resistensen vidare samt att de flesta av fåglarna som Veldmann et al. (2013) studerade var vattenlevande. Resistensen kan på så vis lätt spridas vidare i den akvatiska miljön. Det har också tillkommit studier som visar på antibiotikaresistens bland fiskar från fiskodlingar och bland frilevande marina toppredatorer. Blackburn et al. (2010) studerade sju hajarter i Karibiska havet och fann att alla infångade djur var resistenta mot åtminstone ett antibiotikum. De flesta infångningsplatser var dessutom multiresistenta. I en annan fiskstudie jämförde Shah et al. (2014) bakterier hos laxar från en akvakultur utanför Chile med frisimmande laxar för att se om de hade antibiotikaresistenta gener. De fann att 81% av alla isolaten för både akvakulturen och de frisimmande laxarna var resistenta mot åtminstone ett antibiotikum. 9 Frukt och grönt Fekalier från livsmedelsproducerande djur används ofta fertiliserande, speciellt på organiska jordbruksmarker. På de åkrar man gödslar följer näringen med upp i växten med vattnet och det gör även antibiotikan med de eventuellt resistenta bakterierna. När man sedan skördar grödorna följer de resistenta bakterierna med och äts sedan av djur eller ovetande konsumenter (Vidaver 2002). Många frukter och grönsaker besprutas dessutom med antibiotika som hamnar både på växterna, på och i frukten samt följer med regnet vidare till grundvatten, åar, sjöar och hav. Uppskattningsvis besprutas 53 000 hektar frukt och grönsaker med antibiotika i USA varje år (Vidaver 2002). Läkemedel i naturen Läkemedel är ur ett kemiskt perspektiv, vanligtvis stabila ämnen för att kunna transporteras genom hela kroppen och brytas ner på rätt ställe med tillräckligt hög styrka. Att brytas ner långsamt är dock negativt om man tänker på miljön, eftersom dessa läkemedel tar längre tid på sig innan de försvinner. Halveringstiden för antibiotika i naturen kan vara allt mellan dagar och år och enligt Egerwärn & Lindmark (2009) är det speciellt de syntetiska antibiotika som bryts ner väldigt långsamt. Det betyder att de har möjligheten att spridas över en större geografisk yta (Larsson & Lööf 2014). Larsson & Lööf (2014) påpekar också att eftersom läkemedel binder till proteiner i kroppen, och vi samt många andra vertebrater har samma sorts proteiner, så kan många av dessa arter komma att påverkas om antibiotika hamnar i naturen – fiskar får till exempel problem med fortplantningen. Kumar et al. (2005) beskriver att antibiotika som hamnar i den terrestra naturen bryts ner olika fort beroende på fyra faktorer: Ø Temperatur – ju lägre temperatur, desto längre tid tar det för antibiotikan att brytas ner (exempelvis hade tetracyklin brutits ner till 56% efter 30 dagar i 30°C medan den inte brutits ner något alls efter lika lång tid vid 4°C). Detta är ett problem för länder som ligger i ett kyligare klimat, där gödsel ofta läggs ut på senhösten eller vintern och sedan kan spridas än längre under vårens töväder med tillhörande översvämmande älvar och floder. Ø Marktyp – bland de testade marktyperna (lerjord, mjällera och lerig mo) bryts antibiotika ner långsammast i den förstnämnda och snabbast i den sistnämnda. Ø Kvoten mark-gödsel – antibiotika bryts ner långsammare ju mer gödsel det är per markyta. Ø pH och UV-ljus – där det tar kortare tid för antibiotika att brytas ner med ökad pHkoncentration och ökad ljusexponering (Gilbertson et al. 1990). Antibakteriella medel Antibakteriella medel (som exempelvis Triklosan, 5-klor-2-(2,4-diklorfenoxi)fenol) används för att sterilisera och rengöra ytor och användandet av dem anses precis som antibiotika ha bidragit till ökad antibiotikaresistens. Från början användes de i sjukhuskläder för att minska infektionsspridningen på sjukhus men sedan dess (åtminstone de senaste 30 åren) har de kommit att användas även i tandkräm och tvål, diskmedel, mattor och madrasser, soppåsar, barnleksaker, köksredskap och smink med mera (Levy 1998, Levy et al. 1999, Yazdankhah et al. 2006, Wignall et al. 2008). 10 Antimikrobiella medel kan precis som antibiotika göra att resistenta bakterier växer till i antal om det inte ges tillräckligt hög dos. Det är fullt möjligt att bakterier som har resistens mot antibakteriella medel på sina plasmider samtidigt kan ha antibiotikaresistenta gener. Om man använder fel antimikrobiella medel så kan man alltså späda på resistensrisken för antibiotika (Levy 1998, Yazdankhah et al. 2006). Eftersom triklosan används till så mycket är det en stor del som försvinner ut med vatten från hushåll, industrier och sjukhus och hamnar i den akvatiska och terrestra miljön. Det bidrar till att öka på triklosanresistensen och därmed också anibiotikaresistensen (Yazdankhah et al. 2006). Det bevisade bland annat Randall et al. i sin studie från 2004 där de lät bakteriestammar växa i näringslösningar med eller utan triklosan och sedan spred dem på agarplattor med antibiotika på. Efter en inkubation på 1-2 dygn räknades resistensens mutationsfrekvens för stammarna och resultatet blev att mutationsfrekvensen för de stammar som fått vara i näringslösningen med triklosan hade ökat. De drog därför slutsatsen att antimikrobiella medel kan leda till resistens för antibiotika. Åtgärder För att minska sambandet mellan djurhållning och resistens måste det till att börja med forskas fram nya antibiotika. Det är i dagsläget inte speciellt attraktivt för läkemedelsföretag att ta på sig den uppgiften eftersom vinsten i förhållande till risken inte är så stor. Nya läkemedel måste användas med än större försiktighet och dessutom inte inom flera sektorer. Trots om man följer dessa råd finns det ändå en risk att resistens uppstår. Det gör att det inte blir speciellt vinstgivande för företagen att fortsätta sina forskningsförsök, men det gör det inte heller till en mindre viktig uppgift. Det är tråkigt att världens ekonomiska intressen betyder mest. Enligt SVA (2011) finns det två mål vi måste uppnå för att kunna behålla antibiotika som läkemedel i framtiden: förhindra uppkomst och minska spridning av resistens. Minska spridningen För att minska spridningen av antibiotikaresistenta bakterier anser SVA (2011) att vi måste minska inköpen av levande djur samt isolera dem innan de får möta den övriga boskapen. Vi bör också övervaka boskapen och vid tecken på sjukdom isolera de berörda individerna för att minska risken för smittspridning. God hygien förespråkas också av WHO (2007b), vilket måste bli praxis eftersom resistens hör ihop med bakterier. Därför måste man tvätta händerna längs hela livsmedelskedjan för att minska spridningen. Minska uppkomsten För att minska uppkomsten av antibiotikaresistenta bakterier föreslås två delmål; minska användningen av antibiotika samt utöva en korrekt användning av antibiotika (SVA 2011). För att minska användningen måste vi till att börja med förbättra djurhållningen, det vill säga ge djuren en bättre miljö att leva i för att minska deras stress. Mindre stress kommer innebära att färre djur måste behandlas för infektioner och sjukdom. I stora delar av världen ingår till exempel läkemedelsförsäljning i veterinärernas lön vilket leder till att onödigt mycket antibiotika förskrivs. Andra förslag är att avla mot friskare djur och att satsa mer på vaccin och probiotika (McEwen & Fedorka-Cray 2002, SVA 2011). 11 För att på ett korrekt sätt använda antibiotika bör man enligt van den Bogaard & Stobberingh (2000) använda smalspektrumantibiotika för att minska resistensrisken. Läkare och veterinärer bör endast skriva ut antibiotika när det är klarlagt att det handlar om en bakterieinfektion samt skriva ut rätt dos för rätt antal dagar. Man bör inte heller använda antibiotika om infektionen kan läka av sig själv. Jag trycker ett delsteg för korrekt antibiotikaanvändning är att receptbelägga antibiotika samt att sluta använda antibiotika som tillväxtfrämjande medel världen över. I många utvecklingsländer är antibiotika inte receptbelagd och därför alldeles för lätt att få tag i, både till djur och människor. Därför tycker jag att det är viktigt att man även sprider kunskap till vanliga människor (patienter) eftersom det är vanligt att folk inte tar hela antibiotikakuren då de känner sig bättre efter bara några dagar. Resterande doser kan då sparas till ett senare tillfälle eller säljas för att få ihop pengar. Detta leder till att infektioner inte helt slås ut utan istället späder på tillväxten av resistensgener (Levy 1998). Diskussion Ju mer antibiotika som används desto större är risken för resistens och att antibiotika förloras som botemedel. Av den anledningen är det oroväckande att så mycket antibiotika används och dessutom att samma typer av antibiotika används inom olika sektorer. Jag anser därför att man måste förbjuda vissa antibiotika inom vissa sektorer och på så vis hålla humanantibiotika och animalantibiotika separerade (det gäller även för jordbruk och akvakultur). Trots att Fleming redan 1945 varnade för antibiotikaresistens så har lite hänt sedan dess. Istället för att ta till uttänkta åtgärder, har vi använt antibiotikum efter antibiotikum tills de inte längre har någon effekt för att sedan skapa nya antibiotika. I och med att den framtida folkhälsan är i fara måste vi börja med åtgärderna snarast. När resistensen sprids inom boskapen och ute i naturen berörs vi ytterligare en gång, eftersom det är från djurhållning och jordbruk vi får vår mat. Tabell 1 visar att en av de fem antibiotikagrupperna redan hade resistens innan den ens blev introducerad på marknaden. Jag har inte tagit med fler antibiotikum i min tabell, men tabellen i arbetet Lewis (2013) skrivit visar att det skett flertalet gånger, speciellt på 2000-talet. Var det verkligen smart att introducera dessa antibiotika trots att man visste att det redan fanns bakterier resistenta mot dem? Sedan antibiotika och antimikrobiella medel introducerades för ungefär 70 respektive 40 år sedan har de inkorporerades i våra dagliga liv (i tandkräm och husgeråd med mera), men trots vårt beroende av dem är få människor medvetna om att dessa medel finns överallt samt hur skadliga de är och ägnar därför knappt en tanke åt det (Fleming 1929, Levy 1998, Yazdankhah et al. 2006, Wignall et al. 2008). Denna okunskap är ett stort problem som också behöver belysas. Enligt Bengtsson et al. (2011) är resistenssituationen i Sverige bättre än utomlands, vilket jag anser beror på att vi förbjöd tillväxtfrämjande antibiotika två decennier före resterande EU. Det är tråkigt att världens ekonomiska intressen (högre produktion och avkastning) skyndar på resistensutvecklingen i och med användandet av tillväxtfrämjande medel. I Sverige är vi också mer sparsamma i att ge antibiotika till våra djur än många andra länder. Att inte använda tillväxtfrämjande antibiotika när resten av världen gör det har dock sina konkurrensmässiga nackdelar. Om vi producerar mindre, för att vi inte använder oss av dessa 12 medel, får vi en lägre ekonomisk vinst i jämförelse med övriga länder. Antibiotika är dessutom dyrare i Sverige än utomlands. Det är en dålig idé att behöva importera kött bara för att vi har en för liten nationell produktion - världens köttkonsumtion ökar, men andelen svenskt kött i vår inhemska konsumtion sjunker (Jordbruksverket 2013a). I och med att vi reser och importerar/exporterar allt mer blir det svårare att behålla samma resistensnivå som vi har nu (D’Aoust 1994). Ökad handel med utlandet ökar risken för att resistenta gener når fram till vår befolkning, och då spelar det ingen roll hur bra resistensläget i Sverige är om vi mest äter kött från länder med dålig resistensnivå. Vårt ansvar som ett av de ledande länderna måste därför vara att sprida kunskap samt hjälpa andra länder att förbättra sin djurhållningsstandard så den kommer mer i linje med vår egen. Jag förslår därför att EU bör se till att ursprungslandet står med på den importerade varan hela vägen till konsumenten, så folk inte blir lurade utan kan göra ett smart val. Det vore också bra om konsumenter i alla länder kunde få information om närproducerade varor och vad det kan vara för fördelar med att köpa det (mer än bara minskat CO2-utsläpp). Globalt sett måste alla länder börja ta ansvar eftersom detta problem kräver ett gemensamt internationellt samarbete. Ett samarbetsförslag från McEwen & Fedorka-Cray (2002) är ett världsomfattande övervakningsprogram. Olika faktorer spelar en stor roll i hur fort resistens i miljön sprids och bryts ner. De senaste rapporterna angående klimatförändringar (IPCC 2014) visar på att det kommer bli både varmare och blötare. Det betyder att resistensen kan spridas över större områden med tanke på kommande översvämningar och regn men å andra sidan också kommer brytas ner fortare med tanke på den globala uppvärmningen och att den blivit mer utspridd med vattnet. Vad gäller sura utsläpp får vi dock se upp – ju surare naturen blir desto längre tid tar det att bryta ner resistensen. Ibland får man en känsla av att antibiotikan redan från början var dömd att tappa sin effekt, men jag tror inte att antibiotikan är ett utdömt läkemedel. Ett ansvarsfullt användande redan från början hade definitivt varit bättre men om vi tar tag i saken nu och använder antibiotika med ett långsiktigt tänk så tror jag det kan bli en hållbar behandlingsform. I framtiden kan vi få antibiotikaresistensen att minska, inte minst i frånvaro av antibiotika eftersom antibiotikakänsliga bakterier har en större överlevnadschans då de inte måste lägga energi på att behålla resistensgenen (Levy 1998). Med restriktiva och uttänkta antibiotikabehandlingar samt med mer forskning kan vi i framtiden skapa nya antibiotika med andra sätt att verka än de gamla och på så vis kunna behålla antibiotika som botemedel. Tack Till min handledare Monika Schmitz för den konstruktiva kritik som gjort min uppsats till den bättre version den är idag, till alla kurskamrater som opponerat på min uppsats och till Linn Sohlman för goda fikaidéer och fint pluggsällskap. 13 Referenser Abgottspon H, Stephan R, Bagutti C, Brodmann P, Hächler H, Zurfluh K. 2014. Characteristics of extended-spectrum cephalosporin-resistant Escherichia coli isolated from Swiss and imported poultry meat. Journal of Food Protection, 77:112-115. Abraham EP, Gardner AD, Chain E, Heatley NG, Fletcher CM, Jennings MA. 1941. Further observations on penicillin. The Lancet (British edition), 2:177-189. Akinbowale OL, Peng H, Barton MD. 2006. Antimicrobial resistance in bacteria isolated from aquaculture sources in Australia. Journal of Applied Microbiology, 100:1103-1113. Appelbaum PC. 2007. Microbiology of antibiotic resistance in Straphylococcus aureus. Clinical Infectious Diseases, 45:165-170. Barbosa TM, Levy SB. 2000. The impact of antibiotic use on resistance development and persistence. Drug Resistance Updates, 3:303-311. Barton MD. 2000. Antibiotic use in animal feed and its impact on human health. Nutrition Research Reviews, 13:279-299. Bengtsson, B., Börjesson S, Englund S, Ericsson Unnerstad H, Greko C, Grönlund Andersson U, Landén A, Nilsson O, Pringle M. 2011. Enheten för djurhälsa och antimikrobiella strategier, Statens veterinärmedicinska anstalt. Västerås (Edita Västra Aros), 1-64. Blackburn, JK, Mitchell MA, Holley Blackburn M-C, Curtis A, Thompson BA. 2010. Evidence of antibiotic resistance in free-swimming, top-level marine predatory fishes. Journal of Zoo and Wildlife Medicine, 41:7-16. Blokhuis HJ, Ekkel ED, Korte SM, Hopster H, van Reenen CG. 2000. Farm animal welfare research in interaction with society. Veterinary Quarterly, 22:217-222. Bonnedahl J, Drobni P, Johansson A, Hernandez J, Melhus A, Stedt J, Olsen B, Drobni M. 2010. Characterization, and comparison, of human clinical and black-headed gull (Larus ridibundus) extended-spectrum β-laktamase-producing bacerial isolates from Kalmar, on the southeast coast of Sweden. Journal of Antimicrobial Chemotherapy, 65:1939-1944. Broens EM, Graat EAM, van der Wolf PJ, van de Giessen AW, de Jong MCM. 2010. Transmission of methicillin resistant Straphylococcus aureus among pigs during transportation from farm to abattoir. The Veterinary Journal, 189:302-305. Buschmann AH, Tomova A, López A, Maldonado MA, Henríquez LA, Ivanova L, Moy F, Godfrey HP, Cabello FC. 2012. Salmon aquaculture and antimicrobial resistance in the marine environment. Plos One, 7:1-11. Cabello FC, Godfrey HP, Tomova A, Ivanova L, Dölz H, Millanao A, Buschmann AH. 2013. Antimicrobial use in aquaculture re-examined: its relevance to antimicrobial resistance and to animal and human health. Environmental Microbiology, 15:1917-1942. Cogliani C, Goossens H, Greko C. 2011. Restricting antimicrobial use in food animals: lessons from Europe. Microbe 6:274-279. D’Aoust Jean-Yves. 1994. Salmonella and the international food trade. International Journal of Food Microbiology, 24: 11-31. Egerwärn M, Lindmark H. 2009. Livsmedel som spridningsväg för antibiotikaresistens. Livsmedelsverket och Strama VL. EUCAST. 2000. Terminology relating to methods for the determination of the susceptibility of bacteria to antimicrobial agents (EUCAST definitive document E.Def 12). Clinical Microbiology and Infection, 6:503-508. Fey PD, Safranek TJ, Rupp ME, Dunne EF, Ribot E, Iwen PC, Bradford PA, Angulo FJ, Hinrichs SH. 2000. Ceftriaxone-resistant salmonella infection aquired by a child from cattle. The New England Journal of Medicine, 342:1242-1249. 14 Fleming A. 1929. On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae. British Journal of Experinmental, 10:226-236. Folkhälsomyndigheten. Shigellainfektion. WWW-dokument. http://www.folkhalsomyndigheten.se/amnesomraden/statistik-och-undersokningar/sjukdomsstatistik /shigellainfektion/?t=com&p=5949. Hämtad: 2014-06-14. Fraser D. 1987. Attraction to blood as a factor in tail-biting by pigs. Applied Animal Behaviour Science, 17:61-68. Gilbertson TJ, Hornish RE, Jaglan PS, Koshy KT, Nappier JL, Stahl GL, Cazers AR, Nappier JM, Kubicek MF, Hoffman GA, Hamlow PJ. 1990. Environmental fate of ceftiofur sodium, a cephalosporin antibiotic. Role of animal excreta in its decomposition. Journal of Agricultural Food Chemistry, 38:890-894. Grave K, Torren-Edo J, Mackay D. 2010. Comparison of the sales of veterinary antibacterial agents between 10 European countries. Journal of Antimicrobial Chemotherapy, 65:20372004. Gustafson RH, Bowen RE. 1997. Antibiotic use in animal agriculture. Journal of Applied Microbiology, 83:531-541. Hsia LC, Wood-Gush DGM. 1982. The relationship between social facilitation and feeding behaviour in pigs. Applied Animal Ethlogy, 8:410. Hunter EJ, Jones TA, Guise HJ, Penny RHC, Hoste S. 1999. Tail biting in pigs 1: The prevalence at six UK abattoirs and the relationship of tail biting with docking-, sex and other carcass damage. The Pig Journal – Refereed section, 43:18-32. Ingdahl W. 2012. Världens väntan på antibiotika: sex förklaringar till antibiotikaresistensproblemet. Timbro 1-24. Intergovernmental Panel on Climate Change (IPCC). Fifth Assessment Report – Impacts, Adaptation and Vulnerability. WWW-dokument. http://www.ipcc.ch/report/ar5/wg2/. Hämtad 2014-05-26. Jordbruksverket, enheten för foder och hälsa. 2012. Försäljning av djurläkemedel 2012. Jordbruksverket. 2013a. Hållbar köttkonsumtionen. Vad är det? Hur når vi dit? Rapport 2013:1. Jordbruksverket. 2013b. Sveriges utrikeshandel med jordbruksvaror och livsmedel 20102012. Rapport 2013:27. Jordbruksverket 2014. Svensk handel med jordbruksvaror och livsmedel 2013. Kemper N. 2008. Veterinary antibiotics in the aquatic and terrestrial environment. Ecological Indicators, 8:1-13. Kumar K, Gupta SC, Chander Y, Singh AK. 2005. Antibiotic use in agriculture and its impact on the terrestrial environment. Advances in Agronomy, 87:1-54. Larsson J, Lööf L. 2014. Läkemedel i miljön. Läkemedelsboken, läkemedelsverket, 12671279. Lewis HC, Ethelberg S, Olsen KEP, Nielsen EM, Lisby M, Madsen SB, Boel J, Stafford R, Kirk M, Smith HV et al. 2009. Outbreaks of Shigella sonnei infections in Denmark and Australia linked to consumption of imported raw baby corn. Epidemiology & Infection, 137:326-334. Lewis K. 2013. Platforms for antibiotic discovery. Nature reviews Drug Discovery, 12:371387. Levy SB. 1998. The challenge of antibiotic resistance. An ecological imbalance. Scientific American, 278:46-53. Levy CW, Roujeinikova A, Sedelnikova S, Baker PJ, Stuitje AR, Slabas AR, Rice DW, Rafferty JB. 1999. Molecular basis of triclosan activity. Nature, 398: 383-384. 15 Levy SB. 2001. Antibiotic Resistance: consequences of inaction. Clinical Infectious Diseases, 33:124-129. McEwen SA, Fedorka-Cray PJ. 2002. Antimicrobial use and resistance in animals. Clinical Infectious Diseases, 34:93-106. Memish ZA, Venkatesh S, Shibl AM. 2003. Impact of travel on international spread of antimicrobial resistance. International Journal of Antimicrobial Agents, 21:135-142. Moberg GP. 1985. Biological response to stress: key to assessment of animal wellbeing? Animal Stress, ed. GP Moberg, ss.27-49. Nawaz M, Khan SA, Tran Q, Sung K, Khan AA, Adamu I, Steele RS. 2012. Isolation and characterization of multidrug-resistant Klebsiella spp. Isolated from shrimp imported from Thailand. International Journal of Food Microbiology, 155:179-184. Neu HC. 1992. The crisis in antibiotic-resistance. Science. 257:1064-1073. Penny RH, Walters JR, Tredget SJ. 1981. Tail-biting in pigs: a sex frequency between boars and gilts. Veterinary Record, 108:35. Petersen V. 1994. The development of feeding and investigatory behaviour in free-ranging domestic pigs during their first 18 weeks of life. Applied Animal Behaviour Science, 42: 87-98. Phillips I, Casewell M, Cox T, De Groot B, Friis C, Jones R, Nightingale C, Preston R, Waddell J. 2004. Does the use of antibiotics in food animals pose a risk to human health? A critical review of published data. Journals of Antimicrobial Chemotherapy, 54:276-278. Randall LP, Cooles SW, Piddock LJV, Woodward MJ. 2004. Effect of triclosan or a phenolic farm disinfectant on the selection of antibiotic-resistant Salmonella enterica. Journal of Antimicrobial Chemotherapy, 54:621-627. Schrøder-Petersen DL, Simonsen HB. 2001. Tail biting in pigs. The Veterinary Journal, 162:196–210. Shah SQA, Cabello FC, L’Abée-Lund TML, Tomova A, Godfrey HP, Buschmann AH, Sørum H. 2014. Antimicrobial resistance and antimicrobial resistance genes in marine bacteria from salmon aquaculture and non-aqauculture sites. Environmental Microbiology, 16:1310-1320. Statens Veterinärmedicinska Anstalt. Strategier mot resistens. WWW-dokument. Uppdaterad: 2011-09-15. http://www.sva.se/sv/Antibiotika/Strategier-mot-resistens/. Hämtad: 2014-0501. van den Bogaard AE, Stobberingh EE. 2000. Epidemiology of resistance to antibiotics - links between animals and humans. International Journal of Animicrobial Agents, 14:327-335. Veldman K, van Tulden P, Kant A, Testerink J, Mevius D. 2013. Characteristics of cefotaxime-resistant Escherichia coli from wild birds in the Netherlands. Applied and Environmental Microbiology, 79:7556-7561. Vidaver AK. 2002. Uses of antimicrobials in plant agriculture. Clinical Infectious Diseases, 34:107-110. Viswanathan Roopa. 2006. Current anti-biogram of salmonella species-isolated from blood. Journal of the Association of Physicians of India, 54:666-667. Wessels S, Axelsson L, Hansen EB, De Vuyst L, Lauland S, Lähteenmäki L, Lindgren S, Mollet B, Salminen S, von Wright A. 2004. The lactic acid bacteria, the food chain, and their regulation. Trends in Food Science & Technology, 15:498-505. Wignall GR, Goneau LW, Chew BH, Denstedt JD, Cadieux PA. 2008. The effects of triclosan on uropathogen susceptibility to clinically relevan antibiotics. Journal of Endourology, 22:2349-2356. Wilke MS, Lovering AL, Strynadka NCJ. 2005. Beta-lactam antibiotic resistance: a current structural perspective. Current Opinion in Microbiology, 8:525-533. 16 World Health Organization. 2007a. The world health report 2007 - A safer future: global public health security in the 21st century. Genève, Schweiz. World Health Organization. 2007b. Critically important antimicrobials for human medicine: categorization for the development of risk management strategies to contain antimicrobial resistance due to non-human antimicrobial use. Genève, Schweiz. Yazdankhah SP, Scheie AA, Høiby A, Lunestad BT, Heir E, Fotland TØ, Naterstad K, Kruse H. 2006. Triclosan and antimicrobial resistance in bacteria: an overview. Microbial Drug Resistance, 12:83-90. Zhao S, Datta AR, Ayers S, Friedman S, Walker RD, White DG. 2003. Antimicrobialresistant Salmonella servoars isolated from imported foods. International Journal of Food Microbiology, 84:87-92. 17