Kurskompendium Läkarprogrammet - Ping Pong
advertisement

Kurskompendium Läkarprogrammet DSM2.1 Vårterminen 2017 INSTITUTIONEN FÖR FYSIOLOGI OCH FARMAKOLOGI INSTITUTIONEN FÖR MIKROBIOLOGI, TUMÖR- OCH CELLBIOLOGI 2 ALLMÄN INFORMATION DSM2.1 Momentansvariga Inger Johansson (farmakologi) E-post: [email protected] Tel. 524 877 54 Åsa Sjöling (medicinsk mikrobiologi) E-post: [email protected] Mikael Rhen (medicinsk mikrobiologi) E-post: [email protected] Tel. 517 712 13 Studieadministratörer Maximilian Carlsson Norlin (FyFa) E-post: [email protected] Tel. 524 879 69 Kursexpeditionen för Institutionen för fysiologi och farmakologi von Eulers väg 4a, 1tr, Solna Anne Eklöf (MTC) E-post: [email protected] Tel. 524 866 91 Kursexpeditionen för Institutionen för mikrobiologi, tumör- och cellbiologi Nobels väg 16, Solna Web-ansvarig John Sennett (MTC) E-post: [email protected] Tel. 524 862 48 Vart skall man vända sig? Studieadministratörerna Maximilian Carlsson Norlin och Anne Eklöf finns på respektive kursexpedition och hjälper dig till rätta eller talar om vart du kan vända dig. Momentansvariga lärare Inger Johansson, Åsa Sjöling och Mikael Rhen svarar för allmänna frågor som rör kursen, samt dispenser och tillgodoräknanden eller frågor vid längre frånvaro från kursen. FyFa – von Eulers väg 4A Öppettider: Mån – tors 09.30-11.00 samt 13.3014.30 MTC – Nobels väg 3 KURSWEBBEN http://courses.ki.se Kurswebben har en central roll och uppdateras regelbundet under kursen. Det innebär att du i princip dagligen behöver hålla dig à jour med Anslagstavlan. I PingPong krävs personliga inloggningsuppgifter. På kurswebben finner du bland annat synopsis över föreläsningar, kontaktuppgifter till föreläsare, frågor i anknytning till föreläsningarna. Det finns även länkar till ordlistor, overheadbilder från föreläsningar samt powerpoint-bilder. Du hittar också grundläggande instruktioner och bakgrundsmaterial för varje seminariegrupp, tid och plats för seminarierna här. Även detta kompendium finns här. Mål och framsteg och LADOK I PingPong finner du Mål och Framsteg där alla obligatoriska moment registreras av studieadministratörerna. När du är klar med alla moment registreras ditt betyg i LADOK. Om du efter avslutad kurs saknar poäng i LADOK kan du i ”Mål och Framsteg” se vad det är som saknas och därefter kontakta studieadministratören för det momentet. Har du frågor rörande LADOK eller Pingpong kontakta studieadministratören på den institutionen det gäller. 4 INNEHÅLLSFÖRTECKNING ALLMÄN INFORMATION ...................................................................................................... 3 DSM2.1 – BESKRIVNING ........................................................................................................ 8 KURSLITTERATUR ............................................................................................................... 11 MÅLBESKRIVNING FARMAKOLOGI .............................................................................. 13 MÅLBESKRIVNING MIKROBIOLOGI ............................................................................. 19 SEMINARIER – VT 2017 ........................................................................................................ 25 Parasitologi – 19 januari 2017 ............................................................................................. 25 Antibiotika och antiviraler – 6 februari 2017 ...................................................................... 30 Duggarättning – 8 februari 2017.......................................................................................... 32 Bakteriologi – 22 februari 2017 ........................................................................................... 33 Fall 1. Sårinfektion. ............................................................................................................ 33 Fall 2. Diarré pga matförgiftning. ........................................................................................ 34 Infektionsimmunologi* – 1 mars 2017 ................................................................................ 36 LABORATIONER – VT 2017 ................................................................................................. 37 Inverkan av farmaka på människoögat – 6 februari 2017 ................................................... 37 Jämförelse av olika lokalanestetikas effekter på människa – 24 februari 2017 .................. 44 GRUPPÖVNINGAR – VT 2017 .............................................................................................. 48 Farmakokinetik och receptorfarmakologi – 27 och 30 januari 2017 ................................... 48 Logaritmpapper (lin-log) .................................................................................................... 49 Neurotransmission och neuropsykofarmakologi – 1-2 februari 2017 ................................. 76 Kardiovaskulär farmakologi – 16 februari 2017 ................................................................. 84 LABORATIONER – Mikrobiologi…………………..……..Material delas ut under kursen. 5 LÄRARE DSM2.1 - LÄKARPROGRAMMET VT17 Institutionen för fysiologi och farmakologi Agalave, Nilesh, doktorand Akkad, Hazem, doktorand Barragan, Isabel, postdoc Bersillini Farinotti, Alex, doktorand Brodin, Ernst, professor Carlström, Mattias, forskare Engberg, Göran, professor Erhardt, Sophie, docent Faka, Anthi, doktorand Ferreira, Duarte, postdoc Hendriks, Delilah, doktorand Ingelman-Sundberg, Magnus, professor Jardemark, Kent, docent. Johansson, Inger, docent Jonsson-Fagerholm, Malin, leg läk, Med Dr Jurczak, Alexandra, doktorand Kehr, Jan, PhD Lei, Li, doktorand Lundberg, Jon, professor Lövdahl, Cecilia, forskningskoordinator Marcus, Monica, Med Dr Ohran, Funda, doktorand Peleli, Maria, doktorand Prakash, Varsha, doktorand Rudjito, Resti, doktorand Schulte, Gunnar, docent. Schwieler, Lilly, Med Dr Sundberg, Carl Johan, professor Svensson, Camilla, PhD Svensson, Torgny, professor Tiansheng, Shi, doktorand Valnohova. Jana, doktorand Venkat Nasmuduri, Arvind, doktorand Vuppalapati, Karuna Weitzberg, Eddie, överläkare, professor Wigerblad, Gustaf, doktorand Wright, Shane, doktorand [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] 6 Institutionen för mikrobiologi, tumör- och cellbiologi Albert, Jan, professor Brighenti, Susanna, forskare Giesecke, Johan, professor emeritus Giske, Christian, universitetslektor Flock, Jan-Ingmar, professor Kärre, Klas, professor Klingspor, Lena, forskare Mellroth, Peter, forskare Möllby, Roland, professor Nylén, Susanne, forskarassistent Rhen, Mikael, professor Rottenberg, Martin, professor Römling, Ute, professor Sjöling, Åsa, universitetslektor Sällberg, Matti, professor Ursing, Johan [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] [email protected] Jan Albert JA Susanna Brighenti SB Johan Giesecke JG Christian Giske CG Jan-Ingmar Flock JIF Klas Kärre KK Lena Klingspor LK Peter Mellroth PM Roland Möllby RM Susanne Nylén SN Mikael Rhen MR Martin Rottenberg MaR Ute Römling URö Åsa Sjöling ÅS Matti Sällberg MS Johan Ursing JU 7 DSM2.1 – BESKRIVNING UPPLÄGG Momentet omfattar: föreläsningar (frivilliga) laborationer (obligatoriska) fem seminarier (obligatoriskt vara med på minst fyra) tre gruppövningar (obligatoriska) skriftlig och muntlig dugga (frivillig) skriftlig tentamen (obligatorisk) diskussion i diskussionsforum PingPong (frivillig) Obligatoriska moment är gråmarkerade i schemat. Underlag för föreläsningar, seminarier och laborationer finns på kurswebben. FÖRELÄSNINGAR Föreläsningarna utgör inom flera avsnitt en utvidgning av stoffet, som presenteras i läroboken. Vissa avsnitt kommer att beröras översiktligt på föreläsningarna och måste kompletteras med självstudier. LABORATIONER Laborationer utgör obligatoriska kursmoment. I laborationshandledningen finns hänvisningar till de sidor i läroboken som du bör ha läst igenom innan laborationen. Vid laborationen kommer frågor att ställas på detta stoff. Efter laborationen sker gruppvisa genomgångar av laborationsresultatet. Om Du är tvungen att vara borta från laborationstillfället, måste Du meddela detta till kursexpeditionen. Du får då göra restlaboration. Observera att barn ej får vistas i kurslaboratorierna. Deltagande som försöksperson i humanlaborationerna rekommenderas varmt eftersom det är en förutsättning för laborationernas genomförande att tillräckligt antal försökspersoner anmäler sig. Deltagande som försöksperson är dock frivilligt och anmälan skall ske på särskild anmälningsblankett. Samtliga kursdeltagare (även de som ej önskar delta som försöksperson i någon humanlaboration) skall inlämna en ifylld anmälningsblankett. Vid tveksamhet tages kontakt med laborationsansvarig lärare i god tid före laborationen. Kursdeltagare, som tidigare visat överkänslighet vid användning av de medel som används vid laborationen (se laborationshandledning i detta kompendium), eller som är gravida, skall ej deltaga som försökspersoner vid humanlaborationerna. Laborationer i medicinsk mikrobiologi äger rum under fyra tillfällen enligt schemat. Laborationerna bygger bl.a. på studier av egen normalflora och karakterisering av funna bakterier, varför alla fyra tillfällen är obligatoriska. Före laborationerna kommer provmaterial att delas ut så att varje student kan ta prov på sin egen normalflora för analysen. Särskilda laborationskompendier kommer att delas ut och ett laborationsprotokoll ska fyllas i av varje student för godkännande av ansvarig amanuens. 8 GRUPPÖVNINGAR Samtliga gruppövningar är obligatoriska. Gruppövningarna utgör ett komplement och en utvidgning av föreläst stoff i farmakologi. Gruppövningarna tränar studenterna att själva aktivt söka information och ger möjlighet att tillsammans med institutionens lärare diskutera farmakologiska problem. Till gruppövningarna har Du stor nytta av att ha läst igenom följande sidor i läroboken, Rang, Dale, Ritter, Flower, Henderson: Rang and Dale’s Pharmacology, 8:e upplagan (2016): Gruppövning Farmakokinetik o receptorfarmakologi Neurotransmission o neuropsykofarmakologi. Kardiovaskulär farmakologi Sidor 1-66, 101-142, 692-702 143-211, 449-497, 536-614 247-307, 355-366, 380-401, 418-424 OBS! Glöm inte att ta med läroboken och eventuell ytterligare utdelad litteratur som behövs under gruppövningarna (se arbetsmaterialet till respektive gruppövning). SEMINARIER Mikrobiologidelen omfattar fem seminarietillfällen, varav det sista (infektionsimmunologi) är obligatoriskt. Av övriga fyra seminarier måste du deltaga i minst tre, helst alla. Seminarierna sker gruppvis (max 10 personer i gruppen) tillsammans med en lärare. Före seminariet ska studenten enskilt eller i grupp ha förberett svar på de frågor som finns i underlaget. Dessa svar diskuteras under seminariet. Glöm inte att skriva din namnteckning på seminariernas närvarolistor! Ingen namnteckning = ingen närvaro! GODKÄNT moment DSM2.1 För godkänt moment fordras: deltagande i laborationer och godkänt lab-protokoll deltagande gruppövningarna deltagande i seminarier (minst 4 av 5, se ovan). KUNSKAPSKONTROLL Duggan, som är frivillig, omfattar farmakologi och mikrobiologidelarna under DSM1 samt de delar av DSM2.1 som undervisas fram till och med 6 februari. Duggan består av en skriftlig del (mikrobiologi), en självrättningsdel (mikrobiologi) samt en muntlig del (farmakologi). De som uppnår godkänt resultat på både skriftlig och muntlig del av duggan får bonuspoäng att ta med till den skriftliga tentamen 6 mars (2 extra poäng för godkänd mikrobiologidugga och 2 extra poäng för godkänd farmakologidugga, dvs totalt max 2 + 2 poäng att addera till sluttentamens poäng). Den skriftliga duggan i mikrobiologi är 7 februari och den skriftliga restduggan i mikrobiologi sker 11 februari (föranmälan görs senast klockan 12 den 10 februari), och muntlig dugga i farmakologi sker den 8 februari (restdugga 15 februari). 9 Tentamen omfattar essäfrågor om vardera 4-8 poäng samt kortsvarsfrågor om vardera 1-4 poäng. Tentamen täcker farmakologi och mikrobiologidelarna under DSM1 samt momentet DSM2.1 (obligatorisk kurslitteratur, föreläsningar, seminarier, laborationer och gruppövningar). För betyget godkänd krävs 67 % rätt. Tentamensresultatet anslås på kurswebbens anslagstavla 24 mars kl 15. Eventuella klagomål på rättningen skall i skriftlig form inlämnas tillsammans med den aktuella skrivningen till kursledaren. Endast klagomål från de kursdeltagare som ligger under gränsen till godkänt kommer att behandlas. Omrättade skrivningar kan återsändes per post (frankerat kuvert med postadress inlämnas) eller hämtas på kursexpedition. Resttentamen, se Anslagstavlan på hemsidan. Anslagstavla finns på på kursens hemsida. 10 KURSLITTERATUR FARMAKOLOGI Obligatorisk litteratur Rang, H.P., Ritter, J.M., Flower.,R, and Henderson, G. "Rang and Dale´s Pharmacology" 2016 (8:e uppl.), Elsevier, Churchill Livingstone. Rekommenderad litteratur Brunton, L.L., "Goodman and Gilmans The Pharmacological Basis of Therapeutics" 2011 (12:e uppl.), Pergamon Press, Inc., New York. Finns elektroniskt tillgänglig via KI’s bibliotek Whalen, K., Lippincott’s Illustrated Reviews “Pharmacology” 2014 (6:e uppl., International edition) Lippincott Williams & Wilkins, Philadelphia Referenslitteratur Läkemedelsboken Läkemedelsverket (www.läkemedelsboken.se) FASS (Farmaceutiska specialiteter i Sverige), Läkemedelsinformation AB. (www.fass.se) Kompendier Läroboken kompletteras under kursen med arbetsmaterial till laborationer och gruppövningar (ingår i detta kompendium) samt vissa föreläsningskompendier som hittas på PingPong. 11 MEDICINSK MIKROBIOLOGI Brauner et al. Medicinsk Mikrobiologi och Immunologi Studentlitteratur 2015 Murray et al. Medical Microbiology Mosby, 7th edition 2013 För komplettering av immunologin: Abul K. Abbas, Andrew H. Lichtman Basic immunology: Functions and Disorders of the Immune System Saunders, 4th edition 2012 Annan möjlig litteratur: Peter Goering: Mims’ Medical Microbiology Mosley Elsevier, 5th edition 2012 Janeway et al. Immunobiology Blackwell, 8th edition 2011 Strohl et al. Microbiology Lippincott, Williams &Wilkins, 3rd edition 2013 Table of Bacteriology (under Mer material på kurswebben) Kurswebben innehåller information om basala tabeller och bilder länkar till användbara sajter föreläsningarnas innehåll (synopsis) powerpointpresentationer från föreläsningarna diskussionsforum kurskompendiet seminarierna. Populärlitteratur från MTC: Peter Benno m fl: Magen – Bakterier, buller och brak Karolinska Institutet University Press, 2012 Patrik Wahren, Britta Wahren: Framtidens farliga smitta – hur kan vi skydda oss? Karolinska Institutet University Press, 2007 12 MÅLBESKRIVNING FARMAKOLOGI Studenten skall skriftligen och muntligen kunna: 1. redogöra för grundläggande farmakologiska principer inom farmakokinetik och farmakodynamik 2. beskriva och förklara principer för central och perifer neurotransmission 3. redogöra för bakomliggande mekanismer för läkemedel inom områdena: neuropsykofarmakologi, narkosmedel, lokalanestetika, analgetika och antiinflammatoriska läkemedel, centralt verkande analgetika, kardiovaskulär farmakologi, lipidsänkande medel, medel vid koagulationsstörningar och anemier, diuretika, andningsorganens farmakologi, mag-tarmkanalens farmakologi, endokrinologi, medel mot infektioner. 4. ge exempel på generiska substanser samt preparatnamn, deras biverkningar och kontraindikationer inom områdena beskrivna i punkt 3. 5. beskriva behandlingsformer/alternativ för sjukdomar inom områdena beskrivna i punkt 3. 6. redogöra för interindividuella skillnader i läkemedelsmetabolism samt interaktioner mellan olika läkemedel. INNEHÅLL FARMAKOLOGI - DSM2.1 Studenten skall kunna och känna till: 1. Farmakokinetik - läkemedlens öde i organismen 1.1. Administreringsvägar, (huvudtyper, exempel - fördelar/nackdelar), membrantransport (typer - aktiva/passiva), absorption av läkemedel, faktorer som påverkar absorptionen, metoder för att erhålla fördröjd absorption, begreppet biologisk tillgänglighet, första passage metabolism, dosberoende biologisk tillgänglighet. 1.2. Distribuering av läkemedel, kroppens vätskerum, skenbar distribueringsvolym, faktorer som påverkar distribueringen (fettlöslighet, pH i kroppens vätskerum, regional genomblödning, plasmaproteinbindning, vävnadsbindning, lokala barriärer), betydelse av distribuering för effektduration av vissa läkemedel. 1.3. Metabolism av läkemedel, metaboliserande organ, syntetiska/icke syntetiska reaktioner (Fas I och II), involverade enzymsystem, faktorer som påverkar metabolismen (interindividuell variation, interaktioner, enzyminduktion, bioaktivering). 1.4. Utsöndring av läkemedel och läkemedelsmetaboliter, utsöndringsvägar, faktorer som påverkar utsöndringen via urin. 13 1.5. Mekanismer för interaktioner. 1.6. Farmakokinetiska grundbegrepp, absorptions-, distribuerings- resp elimineringsfas, enkompartment- och tvåkompartmentmodeller, 0:e och 1:a ordningens kinetik, halveringstid, ß resp Ke, dosberoende kinetik, ytan under kurvan (AUC), beräkning av skenbar distribueringsvolym, biologisk tillgänglighet, clearancebegreppet; låg- och högclearenceläkemedel, upprepad dosering, beräkning av jämviktskoncentration i plasma resp tid för uppnådd jämvikt vid konstant dosering, den farmakologiska effektens kinetik. 2. Farmakodynamik - receptorer 2.1. Receptorbegreppet, definition, receptormedierade och icke receptormedierade effekter, endogena och exogena ligander. 2.2. Receptorsubpopulationer, förekomst, fysiologisk betydelse och farmakologisk relevans. 2.3. Receptorlokalisation, pre- och postsynaptiska etc. 2.4. Typer av receptorer, membranbundna (G-proteinkopplade, jonkanaler, tyrosinkinaskopplade), intracellulära. 2.5. Metoder att direkt studera receptorbindning. 2.6. Receptorreglering, upp- resp. nedreglering av receptorer. 2.7. Signaltransduktionsmekanismer, intracellulära mediatorer, G-proteiner, cAMP, Ca2+, fosfatidylinositol etc, plasticitet. 2.8. Dos-effektsamband, grafisk framställning, massverkans lag, besättningsteorin och andra receptorteorier. 2.9. Definitioner och begrepp, inneboende aktivitet (efficacy), potens, affinitet, receptorreserv (spare receptors), partiella resp rena agonister, kompetitiva reversibla, kompetetiva irreversibla resp nonkompetitiva antagonister, inversa agonister, partiska ligander, ED50. 2.10. Terapeutiska effekter kontra biverkningar, terapeutisk bredd/terapeutisk index, olika typer av läkemedelsbiverkningar, dosberoende kontra icke dosberoende biverkningar, olika typer av allergiskt medierade biverkningar. 3. Neurotransmission (central och perifer) 3.1. Transmittorkriterier, neurotransmittorer/neuromodulatorer, farmakologiska angreppspunkter i transmissionsprocessen. 3.2. Pre- och postsynaptisk reglering, reglering av frisättning, syntes, fyrning. 3.3. Monoaminerg transmission, syntes, inaktivering, metaboliter, receptorer, effekter i olika organ vid stimulering resp hämning, farmaka som påverkar monoaminerg transmission. 14 3.4. Kolinerg transmission, syntes, inaktivering, receptorer, distribuering, effekter i olika organ vid stimulering resp hämning, farmaka som påverkar kolinerg transmission. 3.5. Icke depolariserande resp depolariserande perifert verkande muskelrelaxantia, effekt, duration, pseudokolinesteras, selektivitet för olika muskelgrupper. 3.6. Aminosyror som transmittorer (f f a GABA, glycin, glutamat och aspartat), farmaka som anses påverka dessa transmittorsystem. 3.7. Peptiderg transmission (enkefaliner, substans P, somatostatin, VIP, NPY, CGRP, CCK etc), coexistens och interaktion med klassiska signalsubstanser, farmakologiska angreppspunkter. 3.8. Kväveoxidens funktion och dess farmakologi. 4. Neuropsykofarmakologi 4.1. Medel vid Parkinsons sjukdom, mekanismer för biverkningar (hyperkinesier, on-off fenomenet), antikolinerga medel, övriga medel vid Parkinson, andra användningsområden för dopaminagonister. 4.2. Neuroleptika (klassiska och atypiska), aktuella teorier om neuroleptikas verkningsmekanismer vad gäller terapeutiska effekter, biverkningar, mekanismer, behandling. 4.3. Antidepressiva medel, monoaminhypotesen, evidens för och emot, akuta och kroniska effekter, tidsrelationer för terapeutisk effekt/återupptagsblockad/synteshämning/receptoradaptation, olika typer av preparat (läkemedelsgrupper), aktuella teorier om verkningsmekanismer, mekanismer för biverkningar, effekter vid överdos, kinetik. Farmakologisk behandling av bipolär depression, litium, alternativ till litium. 4.4. Sedativa/hypnotika/anxiolytika preparat (bensodiazepiner, barbiturater, SSRI, bensodiazepinbesläktade m fl), verkningsmekanismer, GABA-receptorer interaktion, farmakokinetik, skillnad i toxicitet mellan olika preparat, beroende, tolerans, abstinens. 4.5. Antiepileptika (karbamazepin, fenytoin, valproat, etosuximid m fl), verkningsmekanismer, farmakokinetik, biverkningar, läkemedelsinteraktioner, toxicitet. 4.6. Centralstimulerande medel, amfetamin som prototyp, analoger, kokain, farmakologiska effekter, verkningsmekanismer, missbruk av centralstimulantia, klinisk bild, akut förgiftning, abstinens, behandling, nikotin, farmakokinetik, farmakologiska effekter, verkningsmekanism, tolerans, abstinens, behandling, förgiftning. 4.7. Alkohols centrala och perifera effekter, verkningsmekanismer, teratogena effekter, interaktioner med läkemedel, akut förgiftning, alkoholism, farmakologisk behandling av alkoholberoende och abstinens. 4.8. Antiemetika 4.9. Opioidanalgetika och läkemedel vid neuropatisk smärta 15 4.10. Medel mot migrän, patofysiologi, medel vid profylaktisk resp akut behandling, biverkningar. 5. Narkosmedel Inhalationsmedel, intravenösa narkosmedel, verkningsmekanismer, lipidlöslighetsteorin, induktionstider, farmakokinetik för olika preparat 6. Lokalanestetika Jämförelser av olika preparat med olika induktionstid och duration, viktiga kemiska grupper, struktur och aktivitet, inverkan av vävnads-pH, verkningsmekanismer, administreringssätt, tillsats av kärlkontraherande medel, kardiovaskulära effekter, effekter på centrala nervsystemet. 7. Medel mot migrän Medel mot migrän, patofysiologi, medel vid profylaktisk resp akut behandling, biverkningar. 8. Centralt verkande analgetika Morfin som prototyp, strukturanaloger, centrala och perifera effekter, verkningsmekanismer, klinisk användning, kontraindikationer, akut förgiftning; symptomatologi, behandling, antagonister; abstinens, symptomatologi, behandling, övriga opioider, jämförelser beträffande farmakokinetik och farmakodynamik. 9. Kardiovaskulär farmakologi 9.1. Medel mot hjärtsvikt, patofysiologi, behandlingsprinciper, (ACE-hämmare, ßadrenoceptoragonister, diuretika, digitalispreparat, m.fl.), verkningsmekanismer. 9.2. Medel mot ischemisk hjärtsjukdom, patofysiologi, preparat, (organiska nitrater, ßreceptorblockerare, kalciumflödeshämmare), verkningsmekanismer, farmakokinetik, biverkningar, prevention mot infarkt, primär resp sekundär (post-infarktbehanling), aktuella medel. 9.3 Blodtryckssänkande medel, patofysiologi, preparatgrupper med olika angreppspunkter (transmittorsyntes/upplagring, receptoraktivering, ACE, kalciumkanaler etc), verkningsmekanismer, farmakokinetik, biverkningar, principiella användningsområden, kombinationsbehandling. 16 10. Lipidsänkande medel Kolesterol och arterioskleros, lipoproteiner, lipoproteinmetabolism, LDL-receptorn, hyperlipoproteinemier, preparat, mekanismer, biverkningar. 11. Medel vid koagulationsstörningar och anemier 11.1 Antikoagulantia, direkt resp indirekt verkande preparat, verkningsmekanismer, farmakokinetik, administreringssätt, lågdos/högdosförfarande (heparin), indikation, kontraindikation, antidoter, interaktioner. 11.2 Trombolytiska medel, trombocythämmande medel, medel som förbättrar hemodynamiken, preparat, verkningsmekanismer, indikationer. 11.3 Medel vid järnbrist resp megaloblastanemi, preparat, verkningsmekanismer, indikationer. 12. Diuretika Preparattyper, exempel på preparat, verkningsmekanismer, farmakokinetik, duration, effekt på elektrolytstatus, syra/basbalans, indikationer, biverkningar, interaktioner. 13. Endokrin farmakologi 13.1. Insulin; verkningsmekanism, typer, administration, biverkningar. Perorala antidiabetika; preparat, verkningsmekanismer, farmakokinetik, biverkningar, interaktioner, kontraindikationer. 13.2. Thyroideahormon och thyreostatika; preparat, indikationer, verkningsmekanismer, biverkningar 17 Följande delar ingick i farmakologiundervisningen under DSM1: Lätta analgetika och antiinflammatoriska läkemedel, medel mot migrän, medel mot gikt. Inflammatoriska mediatorer, NSAID-preparat, farmakokinetik, verkningsmekanismer, biverkningar, kontraindikationer, toxiska effekter (barn, vuxna). Kortikosteroider, naturligt förekommande glukokortikoider, syntetiska analoger, effekter i farmakologisk dos, användning som antiinflammatoriska och immunosuppressiva medel, preparat, indikationer, administreringsssätt, farmakokinetik, biverkningar, mineralkortikoider, effekter och användning. Symptomatisk och sjukdomsmodifierande behandling av reumatoid artrit. Behandling av ulcerös colit och Crohns sjukdom. Patogenes vid gikt, symptomatisk behandling, farmakologiska metoder att sänka urinsyrakoncentrationen i blod, preparat, verkningsmekanismer. Andningsorganens farmakologi, histamin, antihistamin Patofysiologi vid olika sjukdomar i luftvägarna, endogena mediatorer, expektorantia, antitussiva, avsvällande medel (lokal resp systematisk administration), glukokortikoider, antihistaminika, ß-agonister, dinatriumkromoglikat, leukotrienantagonister, xantinderivat, antikolinergika, (lokal, p.o. samt i.v. behandling vid astma), verkningsmekanismer, farmakokinetik, indikationer, biverkningar, interaktioner, behandling av anafylaktisk chock. Magtarmkanalens farmakologi Medel vid magsår och gastrit, preparattyper med exempel (protonpumpsblockare, H2receptorantagonister, antacida, slemhinneskyddande medel), verkningsmekanismer, biverkningar. Laxermedel och antidiarroika, preparat, verkningsmekanismer, biverkningar, risker. 18 MÅLBESKRIVNING MIKROBIOLOGI DSM2.1 All kunskap i detta delmoment baserar sig på tidigare erhållen kunskap i ämnet Infektion och försvar under DFM2.1 och DSM1. Studenten skall efter DSM2.1 känna till vanliga infektioner och kunna de mikrobiologiska agens som orsakar dessa, deras uppbyggnad, replikation, patogenetiska mekanismer, immunologi samt spridningsvägar och förekomst. kunna redogöra för hur kroppens immunförsvar skyddar oss mot infektioner kunna redogöra för betydelsen av kroppens normalflora (mikrobiota) kunna principerna för mekanismerna för och användning av olika antibakteriella och antivirala läkemedel och hur resistens mot dessa kan uppkomma och spridas kunna redogöra för begreppet immunoprofylax och de vanliga vaccinerna. Att kunna: Principer för klassificering av mikroorganismer i bakterier, svampar, protozoer och virus, samt de viktigaste skillnaderna i deras struktur och livscykel. Definition på följande koncept: patogen, virulens, infektionskälla, infektionsväg, smittsam dos, exogen- och endogen infektion, organotropism, klinisk- och sub-klinisk infektion, opportunistisk infektion, normalflora, persistens, kronisk och akut infektion. IMMUNOLOGI Att kunna: Immunsystemet vid infektion vilka immuneffektor-mekanismer som är viktigast för immunförsvaret mot olika mikroorganismer (intracellulära vs extracellulära bakterier vs virus vs maskar vs parasiter) grundprinciper för vaccination, vaccintyper (levande, levande-attenuerade, avdödade, subkomponent, DNA), adjuvans, administrationssätt, vacciner inom det svenska barnvaccinationsprogrammet. BAKTERIOLOGI Att kunna: Struktur och funktion Principerna för klassificering av bakterier i släkte, art, subtyper och kloner. Grundstrukturerna för en bakteriecell, särskilt strukturer viktiga för patogenes och virulens. Organisationen och kemiska strukturen av cellväggen för Gram-positiva och Gram-negativa bakterier samt dess relevans till virulens, värdförsvar och antibiotikakänslighet. Grundstruktur och funktion av fimbriae (pili), flageller, kapsel och sporer. 19 Genetik Huvudsaklig organisation av bakteriegenomet. Plasmider, bakteriofager, IS-element och transposoner. Upptag av DNA via transformation, konjugation och transduktion, såväl som dessa upptagsmekanismers relevans till antigenvariation, överföring av virulensgener och spridning av antibiotikaresistens. Patogenetiska mekanismer Huvudmekanismer för bakteriepatogenes och virulens: adhesion, kolonisering, invasion av celler och av vävnader, toxicitet, och de olika strategierna för att undvika värdens försvarsmekanismer. Effekterna av utsöndrade toxiner (hämolysin, enterotoxin, neurotoxin, cytotoxin, superantigen) och enzymer, samt deras betydelse och huvudsakliga sätt att agera. De biologiska effekterna av bakteriellt endotoxin (LPS). Normalflora (mikrobiota) Lokalisering och huvudsakliga komponenter av den normala floran. De vanligaste opportunisterna i den normala floran. Relevans av den normala floran för sjukdom och hälsa. Principerna för användning av pre- och probiotika. Läsanvisningar: Brauner et al. 2015: kapitel 3.1, 3.2, 3.3 Murray et al. 2013, 7:e utgåvan: kapitel 2, 12, 13, 14 Specifika bakterier Vissa specifika egenskaper för de medicinskt relevanta bakterierna. Exempel på sådana egenskaper är: Gramreaktion, morfologi, typ av cellvägg, sporbildning, förekomst, spridningsvägar och sjukdomstyp. Viktiga virulensfaktorer och patogenetiska mekanismer, t.ex., toxinbildning, invasivitet, intracellulär överlevnad, anti-fagocytär kapsel, antigen variation, och andra strategier för att undvika immunsystemet. Gram-positiva kocker: Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Streptococcus pyogenes, Streptococcus pneumoniae Gram-negativa kocker: Neisseria meningitidis, Neisseria gonorrhoeae, Moraxella catharralis Anaeroba gram-positiva stavar: Clostridium perfringens, Clostridium difficile, Clostridium botulinum, Clostridium tetani, Laktobaciller Anaeroba gramnegativa stavar: Bacteroides spp. Gram-negativa stavar: Salmonella enterica, Shigella spp., Campylobacter jejuni, Helicobacter pylori, Vibrio cholerae, Haemophilus influenzae Escherichia coli – ETEC, EPEC EHEC, EIEC, EAEC och UPEC, Pseudomonas aeruginosa. Klebsiella pneumoniae Syra-fasta stavbakterier: Mycobacterium tuberculosis Intracellulära: Chlamydia trachomatis Bakterie som inte har cellvägg: Mycoplasma pneumoniae Spirocheter: Borrelia burgdorferi, Treponema pallidum Läsanvisningar: Brauner et al. 2015 Kapitel 3.5; 3.6 s.187-193; 3.7; 3.12; 3.13 s. 227-230; 3.14; 3.15 s. 250-253; 3.16; 3.17; 3.18 s. 262-264; 3.23; 3.24; 3.26 s. 296-300; 3.27 s. 302-309; 3.28; 3.31; 8:17 vad som gäller bakterier. 20 Murray et al. 2013, 7:e utgåvan Kapitlen 18 s. 174-185; 19 s. 188-194, s. 199-203; 25 s. 235-239; 26 s. 248-256; 27; 28 s. 273277; 29; 30 s. 288-292, 295; 31 s. 296-300; 36 s. 327-337, 37 s. 343-344, M38, s. 345-348; 32 s. 381-387; 39 s. 350-359; 40 s. 364-366 Grundläggande innehåll och funktion av följande bakterievacciner: Stelkramp, difteri, kikhosta, Haemophilus influenzae typ b (Hib), tuberkulos, pneumokocker. Antibiotika Principer för antibiotisk verkan inklusive definitioner för selektiv toxicitet, bakteriostatiska och bakteriocida antibiotikas definition och mekanismer, den minsta hämmande koncentrationen (MIC), bred- och smal-spektrumantibiotika. Antibiotikagruppernas huvudsakliga sätt att verka: hämmare av cellväggsyntes: olika typer av beta-laktam antibiotika (penicilliner, cefalosporiner och karbapenemer) och glykopeptider (vankomycin, teikoplanin) hämmare av proteinsyntes: tetracykliner, makrolider, klindamycin, aminoglykosid, kloramfenikol, fusidinsyra, linezolid hämmare av DNAsyntes: fluorokinoloner hämmare av RNAsyntes: rifampicin hämmare av folsyresyntes: sulfonamid och trimetoprim. Mekanismer för antibiotikaresistensutveckling genom spontan mutation eller spridning och upptag av resistensgener, och relationen mellan användning av antibiotika och utveckling av resistens. Olika resistensmekanismer: t.ex. enzymer som bryter ner eller förändrar antibiotika, hindrande av intag av antibiotika i bakteriecellen, uttransport av antibiotika från bakteriecellen, modifikation av målmolekyler i bakterien, bildande av alternativa målmolekyler. Bestämning av antibiotikaresistens. Kunskap om de vanligaste anmälningspliktiga resistenserna inklusive deras relativa förekomst. Känna till begreppet framgångsrik klon, principer för screening av resistenta bakterier, begreppen epidemiologisk typning av bakterier och plasmider. Brauner et al. 2015 Kapitel 3.4 Murray et al. 2013 7:e utgåvan Kapitel 11 s. 100-103; 17 Att känna till : Principerna för bakterieanpassning till miljöförändringar. Bakteriernas utveckling, förökning, ämnesbehov, syre-beroende (aeroba, obligat anaeroba, fakultativt anaeroba, mikroaerofila), temperatur och pH. Odling på agarplattor, koloniformer och mikroskopiskt utseende. Diagnostiska principer. Specifika bakterier: viridansstreptokocker, Fusobakterier, Klebsiella spp., Proteus spp. 21 PARASITOLOGI och MYKOLOGI Brauner et al. Kapitel: 5, 6.1, 6.2, 6.3 Murray et al. 7:e utgåvan Mykologi: s. 605-711 Parasitologi: s. 715-833 Att kunna: Skillnaden mellan virus, bakterie, protozo, svamp, mask, leddjur Uppbyggnaden av en typisk protozo och svampcell Ge exempel på svampar med de olika typiska morfologierna jäst (t.ex. Candida spp) och mögel (t.ex. Aspergillus spp) Förstå följande termer: flagellat, ciliat, cestod, nematod, trematod, cysta, ägg, spor, hyf, septa, artropod, endoparasit, ektoparasit De generella egenskaperna hos protozoer, svampar och helminter jämfört med andra infektiösa agens Vissa patogener ska studenten ha särskild kunskap om: Protozoer: Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae, Plasmodium knowlesi, Toxoplasma gondii, Giardia intestinalis, Leishmania spp, Trypanosoma cruzi, Trypanosoma brucei, Entamoeba histolytica, Entamoeba dispar, Cryptosporidium parvum. Svamp: Candida spp, Aspergillus spp, Pneumonocystis jiroveci Mask: Ascaris lumbricoides, Schistosoma mansoni, Schistosoma haematobium, Taenia spp, Filaria spp För dessa agens ska studenten kunna följande: hur de sprids geografisk spridning (i stora drag) vilken vävnad som infekteras/var uppstår patologi är parasiten intracellulär/extracellulär kliniska symptom individuella egenskaper som ökar/minskar risken för att drabbas av sjukdom. Om spp står angivet ska studenten kunna för släktet generella karakteristika. Om samma släkte orsakar olika former av sjukdom ska man känna till dessa t.ex. för Leishmania: Kutan, mukokutan, visceral. Livscykler i stora drag, dvs vektorer – huvudvärd- mellanvärd/ smittkälla, infekterad vävnad/celltyp. För t ex malaria: Sprids via myggor Parasiten infekterar leverceller där den utan att orsaka symptom multiplicerar sig i hepatocyter. Efter minst en vecka lämnar parasiten levern för att infektera röda blodkroppar. Parasiten har sedan en symptomatisk livscykel i röda blodkroppar. Vissa av malariaparasiterna bildar sexuella stadier i blodet. Dessa sugs upp av myggan och kan inne i myggan blida en ny livsform som kan spridas vidare till människa. Att känna till: Echinococcus, Dermatofyter. 22 hur parasiter/svampar/maskar undviker och interagerar med immunsystemet epidemiologin hos protozoer, svampar och helminter jämfört med andra infektiösa agens. VIROLOGI Kursen bygger vidare på den virologi som introducerades på kursen DSM1 Mikrobiologi dvs. föreläsningarna: Introduktion till virologi Virus uppbyggnad och klassificering Patogenes, spridning och immunitet vid virusinfektioner. Att kunna: Virus uppbyggnad, klassificering, och familjer Vad skiljer virus från andra organismer? Uppbyggnad och principiella strukturer (ikosahedral eller helikal kapsidsymmetri, hölje eller icke-hölje, RNA eller DNA, plus eller minus-strängat, etc.). Namn på de humanpatogena virusfamiljerna, samt grundprincipen för hur varje humanpatogen virusfamilj är uppbyggd avseende kapsidstruktur, typ av genom, andra komponenter. Principer för virusklassificering. Virusreplikation De olika stegen från adhesion till och med utträde och/eller mognad och skillnader mellan virusfamiljer. Virusgenetik Typ av arvsmassa (RNA eller DNA), vad denna betyder för replikation och egenskaper. Genomreplikation och virusevolution. Punktmutationer, rekombination och omsortering. Principer för immunselektion och antiviral resistens. Interaktion med cellen, patogenes, immunitet och spridning Hur virusreplikationen kan påverka cellens funktioner. Hur denna påverkan kan leda till sjukdom. Lytisk infektion, latens och transformation. Principer för och exempel på cancerutveckling hos olika virusfamiljer. Cell- och organtropism. Spridning och patogenes för olika virus, samt betydelsen av immunologiska faktorer. Betydelsen av värdfaktorer, såsom genetisk predisposition. Vaccin, antiviraler, resistens Principer för virusvacciner. Virusinfektioner som kan förebyggas (eller behandlas) via vaccination. Mekanismer för och exempel på antiviraler. Resistensutveckling mot antiviraler. Specifikt om olika DNA virusfamiljer Struktur, replikation och patogenes och möjliga virusspecifika faktorer som inverkar på patogenes och spridning: herpesvirusfamiljen, papovavirusfamiljen (fr.a. papillomvirus), hepadnavirus, parvovirus (översiktligt), adenovirus (översiktligt), och poxvirus (översiktligt). Specifikt om olika RNA virusfamiljer Betydelse av negativ och positivsträngade, enkelsträngade RNA virus och de med segmenterat genom. Struktur, replikation och patogenes och möjliga virusspecifika faktorer som inverkar på patogenes och spridning: speciellt picornavirus, flavivirus, ortomyxovirus, paramyxovirus, retrovirus. 23 Specifikt om virusorsakade sjukdomar Luftvägsvirus, gastroenteritvirus, hepatitvirus, CNS-virus, zoonotiska virus, virus kopplade till barnsjukdomar och mor-barn smitta, tumörframkallande virus, HIV. Rekommenderad läsning Brauner et al., Medicinsk Mikrobiologi och Immunologi Generella delar, dvs. kapitel 4.1 och 4.2 Specifika virusfamiljer enligt ovan Murray et al., Medical Microbiology, 7th edition. Generella delar, dvs. kapitel 44-46, 48. Specifika virusfamiljer enligt ovan. 24 SEMINARIER – VT 2017 Parasitologi – 19 januari 2017 Ansvarig: Susanne Nylén Plats: Hus 75, Retzius väg 13 A-B Tid 13.00-14.30 Rum 203 204 206 207 209 213 220 222 Grupp 1 2 3 4 5 6 7 8 Tid 14.45-16.15 Rum 203 204 206 207 209 213 220 222 Grupp 9 10 11 12 13 14 15 16 Mål Vi ska diskutera parasiter och svampar som påverkar olika delar av kroppen. Du får möjlighet till djupare insikt om hur dessa överförs, orsaken till sjukdomen och lära dig om intressanta mikroorganismer som du inte har hört talas om förut. Instruktioner Vi förväntar oss att var och en ska kunna presentera varje fall, ge en analys om det och kunna diskutera det tillsammans med läraren. Detta innebär att du behöver läsa kursböcker och leta upp information på nätet. Diskutera bland er i gruppen och i Ping Pong med era lärare. Seminariet kan ges på engelska, var förberedd på detta. Generally, for each case: Define the most likely causative agent. Describe in short the life cycle of the causative agent. Define what host cells it attaches to and infects, and where the pathogen eventually ends. Also, describe means to state diagnosis and a potential treatment. Case 1. A Swedish female student in the medical program just came back to Uppsala after spending 6 months in a rural hospital (Hospital San Ignacio) in La Toya close to Lima, the capital of Peru. While healthy during her stay in Lima, she did record a few skin lesions. Five weeks after coming back to Sweden she noted a skin lesion that did not heal; a lesion in her right part of the face, around 2 to 5 cm in size, with clearly defined edges. Upon questioning, she also recorded that her colleges from France and the US recorded similar lesions. Upon arrival in Sweden she visited the general practitioner and received antibiotic treatment (e.g. Flukloxacillin), antibiotic therapy took away the soreness of the lesion, but the lesion remained. In your opinion, what would be the most likely cause of the apparent infection (A; B or C) and what examinations would you suggest? A. Staphylococcus aureus B. Leishmania spp. C. Histoplasma 25 Case 2 A mother of two sons (Karl 3, and Johan, 4 years of age) have two children in day-care Both have started to become restless, they don´t sleep well and have started to scratch their rumps and complaint about itch in anus. What would be a likely infectious cause for the condition of the boys? A. Enterobius vermicularis B. Schistosoma mansoni C. Ascaris lumbricoides What kind of diagnostic procedure/s can be done to determine the cause of the itch, and how come that both of the boys ended up with the very same symptoms? Case 3 Hugo, a 59-year old immigrant from Argentina had to be taken to the hospital at Lindesberg due to severe intestinal congestion. A radiological examination revealed colonic expansion (megacolon). In addition, damage to the cardiac conduction system was noted. In this case, what would be the most likely cause of the condition? A. Trypanosoma cruzi B. Trypanosoma brucei C. Rotavirus Case 4 A male, 28 years of age, from Solna has recently spent 3 weeks in a rural area in Mexico, where he trained in bullfighting. He has been back in Sweden for a week and has suffered from diarrhoea since then. The last two days he has also noted blood in his faeces. What could be the cause of his symptoms? How could a correct diagnosis be made? What does the life cycle of tentative agents look like, and how do they spread? Case 5 Bengt, a male of 37 years, suffers from a relapse of his leukaemia. He was treated with high doses of anticancer drugs, which eventually resulted in leukopenia and trombocytopenia. A thorax X-ray shows nodular damage in both lungs. Bacterial blood cultures were negative. Microscopic examination of his sputum showed septated branched hyphae with an approximate diameter of 10 micrometers and some 100 micrometers in length. Growth revealed white fungilike colonies that eventually developed a darker grey tone. What is the most likely etiologic factor that caused this infection? A. Mycobacterium spp. B. Aspergillus spp. C. Pneumocystis spp. Case 6 26 Anna-Carin Waldemar works as a secretary at the Swedish embassy in Kampala, Uganda. She has just returned back to the capital after a long trip to the Gulu district located in the northwest part of the country where she has supervised the development of a new university. On her way back she became ill with stomach pain and diarrhoea. Back at Kampala she started feeling weak as well. The symptoms got worse in the coming days, and she developed fever, backpain, and difficulties with breathing. Anna-Carin can not record eating anything that would cause such symptoms; she only eats boiled, pealed or deep-fried food when she feels unsure about the food stuffs at hand. Discuss possible etiological causes to her condition, as well as the life cycle of the potential causative agents. Case 7 A 45-year old consultant, who has not been travelling abroad within the last months, went on a company kick-off in a spa at Dalarna. About a week after his return he became ill with diarrhoea, stomach pain, vomiting and mild fever. Many of his colleagues experienced similar symptoms. He attended the local welfare centre for his symptoms and leaves faeces samples for testing of bacteria and viruses. Still, all analyses turned out negative. A. What additional faeces analyses would you suggest? B. Any sensible diagnosis? C. Any probable source of the disease? 27 Virologi – 23 januari 2017 Ansvarig: Jan Albert Plats: Hus 75, Retzius väg 13 A-B Tid 13.00-14.30 Rum 203 204 206 207 209 213 220 222 Grupp 9 10 11 12 13 14 15 16 Tid 14.45-16.15 Rum 203 204 206 207 209 213 220 222 Grupp 1 2 3 4 5 6 7 8 Rekommenderad läsning Brauner et al., Medicinsk Mikrobiologi och Immmunologi, fr.a. kapitel 4.1 Murray et al., (2013) Medical Microbiology, 7th edition, fr.a. kapitel 44. Mål Målet med virologiseminariet är att ge en fördjupad förståelse för vad virus är och hur de är uppbyggda och fungerar. Seminariet tar upp grundläggande begrepp inom virologi och ger även en fördjupad kunskap om några viktiga virus som framkallar sjukdomar hos människa. Instruktioner Seminariet ges i små studentgrupper och leds av lärare med kompetens inom antingen basal eller klinisk virologi. Diskussionerna baseras på nedanstående frågor och fallbeskrivningar. För att seminariet ska bli meningsfullt måste varje student vara väl förberedd och inställd på att aktivt bidra till diskussionen. En eftermiddag är därför avsatt för individuell inläsning som bör göras med hjälp av föreläsningsanteckningar, kurslitteraturen och extern information på internet. Några användbara länkar All the Virology on the WWW Folkhälsomyndigheten Frågor och diskussionspunkter 1. Beskriv viruspartikelns struktur. a. Vilka är komponenterna och hur de skiljer sig åt mellan olika virusfamiljer? b. Vilken storlek har viruspartikeln (i nm) och arvsmassan (i baspar) för olika virusfamiljer? 2. I samband med ”svininfluensan” 2009 sågs en ordentlig minskning av antalet förskolebarn som var sjuka av andra skäl. Bättre handhygien tros vara en viktig orsak. Se bl.a. http://www.sydsvenskan.se/sverige/article639880/Farre-allvarliga-sjukdomarpa-Skanes-forskolor.html. Diskutera tänkbara orsakar till detta. Diskutera även skillnader i stabilitet och smittvägar mellan icke-höljebärande och höljebärande virus. 28 3. En 20-årig man som rest i Sydostasien drabbas cirka en månad efter hemkomsten av trötthet, aptitlöshet, gulfärgning i ögon och hud, avfärgad avföring och mörk urin. Vilken/vilka virusinfektion(er) skulle kunna vara orsaken? Diskutera utifrån fallet vilka virala egenskaper som är av betydelse för virus-värd interaktion inklusive cell- och organtropism. Diskutera hur dessa egenskaper används för att klassificera virus samt även andra system för virusklassificering. 4. Vilka är de viktigaste stegen i virusets livscykel, inklusive de cellkomponenter som är inblandade och de vanligaste mekanismerna för in- och utträde ur cellen? Diskutera följande exempel för att illustrera skillnader mellan olika virusfamiljer: a. En viktig skillnad i livscykeln mellan poliovirus (picornavirus, ickehöljebärande) och rubellavirus (togavirus, höljebärande) som båda är RNA virus. b. En viktig skillnad i livscykeln mellan poxvirus och herpesvirus som båda är dsDNA virus. c. De flesta höljebärande virus avknoppas genom plasmamembranet. Vilka andra cellmembran kan virus använda för att förvärva ett hölje? Ge exempel. 5. En 48-årig kvinna genomgår vanlig gynekologisk hälsokontroll och visar sig ha CIN3 cellförändringar. Vilket virus är troligen orsaken till dessa? Diskutera olika sätt som en virusinfektion kan påverka funktionen hos den infekterade cellen? Ge exempel på och diskutera mekanismerna för: a. Virus som kan orsaka celltransformation b. Virus som orsakar celldöd 6. En 52-årig man insjuknar på julafton snabbt med hög feber, allmän sjukdomskänsla, torrhosta, huvudvärk och muskelvärk. Vilket virus orsakar troligtvis sjukdomen? Mannen hade samma virussjukdom 1968. Hur kommer det sig att han inte har immunologiskt skydd mot nyinsjuknande? Diskutera utifrån fallet skillnader i genetisk variation och ”immune escape” mellan RNA virus och DNA virus. Diskutera även genom vilka mekanismer genetisk variation kan uppstå. 7. I en familj med två dagisbarn insjuknar bägge barnen hastigt med kraftiga kräkningar, illamående och lite feber som håller i sig i cirka två dagar. Två dagar senare insjuknar mamman, men inte pappan. Vad kan det ha varit för virussjukdom och varför insjuknade inte pappan? Diskutera utifrån fallet varför sjukdomsbilden vid en och samma virusinfektion kan variera från subklinisk till livshotande. Vilka faktorer kan påverka allvarligheten av virusinfektioner? Ge några ytterligare exempel på virusinfektioner där det finns stora variationer i sjukdomsbild. 29 Antibiotika och antiviraler – 6 februari 2017 Ansvariga: Jan Albert och Åsa Sjöling Plats: Hus 75, Retzius väg 13 A-B Tid 10.30-12.00 Rum BZ 406 BZ 408 BZ 410 BZ 412 BZ 414 BZ 416 Grupp 6 7 8 9 10 11 Tid 14.45-16.15 Rum BZ 406 BZ 408 BZ 410 BZ 412 BZ 414 Grupp 1 2 3 4 5 Tid 13.00-14.30 Rum BZ 406 BZ 408 BZ 410 BZ 412 BZ 414 Grupp 12 13 14 15 16 Rekommenderad läsning Brauner et al., Medicinsk Mikrobiologi och Immmunologi Bakteriologi; kapitel 3.4. Virologi: fr.a. kapitel 4.2 Murray et al., (2013) 7th edition Bakteriologi: Kapitel 17. Virologi: Kapitel 48 samt delar av kapitel 44 Mål Syftet med detta seminarium är att ge grundläggande kunskaper om antibiotika och antivirala läkemedel, samt mekanismer och orsaker till resistensutveckling mot dessa läkemedel. Instruktioner och bakgrund Seminariet ges i små studentgrupper och leds av lärare med bakgrund i antingen preklinisk eller klinisk mikrobiologi. Diskussionerna baseras på nedanstående frågor och fallbeskrivningar. För att seminariet ska bli meningsfullt måste varje student vara väl förberedd inställd på att aktivt bidra till diskussionen. En eftermiddag är därför avsatt för individuell inläsning som bör göras med hjälp av föreläsningsanteckningar, kurslitteraturen och extern information på internet. Multiresistenta bakterier ger upphov till återkommande alarmerande rubriker i både allmän och vetenskaplig press. Som läkare kommer du säkert möta detta problem och uppmanas att använda antibiotika på ett rationellt sätt. För att göra dessa avvägningar så är det viktigt att förstå de molekylära och epidemiologiska mekanismer bakom antibiotikaresistens. Virus skiljer sig väsentligt från bakterier och andra cellulära organismer och är bland annat mer beroende av cellulära funktioner. Antivirala medel skiljer sig därför från antibiotika, men resistens förekommer även för antiviraler. Vid seminariet diskuteras likheter och skillnader mellan angreppspunkter för antibiotika och antiviraler. Resistensutveckling kommer också att belysas. Några användbara länkar Referensgruppen för antiviral terapi Folkhälsomyndigheten 30 Frågor och diskussionspunkter 1. 2. 3. 4. 5. 6. Vilka är de främsta angreppspunkterna för: a) Antivirala läkemedel b) Antibiotika Ge exempel. Spekulera om andra potentiella angreppspunkter. Diskutera vilka förändringar som sker hos virus respektive bakterier när resistens utvecklas, dvs. vilka resistensmekanismer patogenerna utnyttjar. Diskutera hur antibiotikaresistens och antiviral resistens kan ha utvecklats från början och vilka faktorer som är viktiga för uppkomsten av antibiotikaresistens och antiviral resistens hos patienter med pågående behandling. Hur sprids antibiotikaresistens respektive antiviral resistens mellan patogener och i samhället? Finns det några begränsningar för denna spridning? Försvinner resistenta stammar av bakterier och virus från patienten om vi sätter ut behandlingen eller från samhället om vi minskar den totala användningen? Föreslå sätt att minska problemen med antibiotikaresistens och antivirala resistens. Fall 7. Varför bör du slutföra antibiotikabehandlingen (7-10 dagar) även om du är frisk efter bara några dagar? För- och nackdelar? 8. Vad säger du till herr Johansson som absolut vill ha "penicillin" till sin 5-årige son som har verkar ha en bihåleinflammation med grönaktigt slem, men som för övrigt verkar okej? (Speciellt eftersom dagiset inte tillåter honom vara där med denna snuva) 9. Fru Svensson berättar att hon tidigare haft infektion med ESBL-bakterier och har nu symtom som vid akut cystit. Vad innebär begreppet ESBL och vilken konsekvens har detta för den behandling som du ger henne? 10. En man som diagnostiseras med en HIV-1 infektion har ett CD4-celltal på 300 celler/µl och en virusmängd 75 000 kopior/mL. Han startar antiretroviral behandling med Kivexa (abakavir + lamivudin) + Stocrin (efavirenz). Efter 6 månader har han virusmängd < 20 kopior/mL och oförändrat vid följande kontroller. Vid 2-års kontrollen har patienten mätbara virusnivåer ca 1000 kopior/mL i plasma. Diskutera tänkbara orsaker till detta. Vilken ytterligare information skulle du vilja ha för den fortsatta handläggningen? 11. En kvinna med en svår herpesinfektion i underlivet i samband med levertransplantation långtidsbehandlas med acyclovir. Behandlingen har initialt bra effekt, men patienten får nya symtom på samma ställe efter ett år. Vad kan vara orsaken till det? Efter ny behandling blir hon symtomfri igen men efter ett par månader kommer det nya symtom. En HSV-1 resistenstest visar mutationer i tymidinkinasgenen. Diskutera varför viruset kan ha blivit resistent hos denna kvinna samtidigt som risken för resistens vid topikal acyklovirbehandling anses vara så låg att läkemedlet är receptfritt på denna indikation. 31 Duggarättning – 8 februari 2017 Ansvarig: Mikael Rhen Plats: Hus 75, Retzius väg 13 A-B Tid 13.00-14.30 Rum BZ 406 BZ 408 BZ 410 BZ 412 BZ 414 BZ 416 BZ 418 BZ 420 Grupp 1 2 3 4 5 6 7 8 Tid 14.45-16.15 Rum BZ 406 BZ 408 BZ 410 BZ 412 BZ 414 BZ 416 BZ 418 BZ 420 Grupp 9 10 11 12 13 14 15 16 Rättning och diskussion sker kl. 13.00-16.15. Studenterna rättar i grupp tillsammans med seminarielärare. Studenter rättar sina egna duggor och ska närvara vid rättningen för att få poäng. Insamling av rättade duggor kl. 14.30 respektive kl. 16.15. Studenter med godkänd dugga i mikrobiologi erhåller 2 poäng som ”bonus”poäng till sluttentamen. Restdugga ges lördag 11 februari och föranmälan görs senast klockan 12.00 den 10 februari. Observera att studenter som skrivit duggan måste vara med på duggarättningen. Studenter som inte skrivit duggan får gärna delta i duggarättningen 32 Bakteriologi – 22 februari 2017 Ansvarig: Åsa Sjöling Plats: Hus 75, Retzius väg 13 A-B Tid 10:30-12.00 Rum BZ 601 BZ 602 BZ 603 BZ 604 BZ 605 BZ 605 BZ 606 BZ 606 Grupp 1 2 3 4 5 6 7 8 Tid 13.00-14.30 Rum BZ 601 BZ 602 BZ 603 BZ 604 BZ 605 BZ 605 BZ 606 BZ 606 Grupp 9 10 11 12 13 14 15 16 Cases Mål Att förstå patogenesen vid två vanliga bakteriella infektioner Instruktioner Varje grupp skall analysera två olika kliniska fall. Under seminariet kommer varje student att bli ombedd att analysera någon av frågorna kopplade till varje fall. Svaren diskuteras med övriga studenter i gruppen och läraren. Studenterna uppmanas att ta upp andra frågor relaterade till kliniska fall eller andra frågor från bakteriologidelen av kursen. Fall 1. Sårinfektion. (Glas i foten) Kim är en 25-årig finsk läkarstudent. Han deltar i en sommarkurs i immunologi i Stockholms skärgård. En ledig eftermiddag tar han ett dopp i havet och simmar till en ö. När han går i land kliver han på en bit glas från en trasig flaska på botten och får ett djupt skärsår. Han lyckas dra ut glasbiten själv och lägger ett bandage runt foten med hjälp av en Första Hjälpen-utrustning . Fyra dagar efter olyckan har han dock fortfarande en pulserande smärta i foten och såret är kraftigt inflammerat på grund av en infektion. Så Kim uppsöker en läkare, det vill säga dig, som är ensam AT-läkare på Läkarbåten, vilken kryssar omkring i skärgården under sommaren. Du tar ett bakteriologiskt prov och skickar det till laboratoriet, men tyvärr dröjer det minst tre dagar innan du får svar. Foten är nu röd och ordentligt svullen och var läcker ut från såröppningen. Kim har ordentligt ont, kan inte använda foten alls, har förhöjd kroppstemperatur och känner sig allmänt dålig. 33 Frågor 1. Vilka är den troligaste bakteriearten att orsaka en sårinfektion av den här graden? Vilka andra bakterier skulle man kunna tänka sig orsaka en dylik sårinfektion i det här läget? Några särskilda skäl att misstänka någon viss art? 2. Detta är en allvarlig infektion från ett litet sår – betyder det att Kims immunsvar är defekt på något sätt? 3. Vilka komplikationer kan möjligen tillstöta om infektionen inte behandlas korrekt? 4. Det är hårt att behöva vänta på provsvaret i minst tre dagar – finns det någon snabbtest för sårinfektionen som kan underlätta beslut om åtgärder? 5. Skall infektionen behandlas omedelbart på båten? a. Om så är fallet, vad är de viktigaste åtgärderna förutom antibakteriell medicinering? b. Om antibakteriell medicinering – vilket antibiotikum är lämpligast? c. Kim deltar i en sommarkurs i skärgården om fördjupade kunskaper i mikrobiologi – kan han skickas tillbaka till kursen eller behöver han läggas in på sjukhus? Annat alternativ? Kim får sin behandling och foten blir långsamt bättre. Efter tre dagar får du veta att det växte Staphylococcus aureus i stora mängder i såret. 6. Hur påverkar det ditt val av antibiotikum? 7. Nämn några virulensmekanismer hos bakterien vilka troligen var av betydelse för uppkomsten av den svåra infektionen? Kims sår läker till slut. Kim kan åter vara ute i skärgården och segla och simma som förut. 8. Innebär det faktum att han haft och blivit frisk från denna infektion att han nu har en större eller mindre risk att få en liknande infektion igen? a. Jämfört med före infektionen? b. Jämfört med sina studentkollegor? 9. Kan Kim ta något vaccin eller förebyggande medicinering för att minska risken? Fall 2. Diarré pga matförgiftning. (Håll maten varm eller kall!) Utbrott 1 Torsdag 14 februari 2002 serverades ärtsoppa och pannkakor till lunch som vanligt på fem olika äldreboenden och en geriatrisk klinik i Tierp utanför Gävle. Under kvällen och under natten insjuknade ett antal av de boende med diarré och några led också av illamående och kräkningar. Totalt insjuknade 66 äldre personer och fyra personer avled i samband med detta utbrott av matförgiftning. Ärtsoppan hade tillagats med långkok i ett kök gemensamt för flera institutioner på tisdagen och serverades i en lokal skola utan att några problem uppstod. Emellertid erbjöds också risgrynsgröt, vilken var ett populärare val hos skoleleverna, varför en avsevärd mängd ärtsoppa 34 blev över. Den nedkyldes och förvarades nedkyld till torsdagen, när den värmdes upp igen och förvarades i elektriska värmeskåp. Värmeskåpen distribuerades med bil vid 10 tiden till de olika institutionerna, där vid ankomsten värmeskåpen anslöts till elektricitet igen. Ärtsoppan konsumerades vid 12-tiden. I de två närmast belägna institutionerna insjuknade ingen av de inneboende medan vid de andra fyra institutionerna insjuknade bortåt 90 % av de inneboende. Odling av prov från ärtsoppan visade höga antal av Clostridium perfringens. Också flera av patienternas avföringsprover visade växt av denna bakterie. Chefen för centralköket åtalades. Hon dömdes för att ha orsakat fyra dödsfall och för att ha riskerat livet på övriga insjuknade på grund av olämplig hantering av maten. Utbrott 2 26 juli samma år insjuknade 32 äldre personer med samma symtom efter att ha konsumerat kalvkött innehållandes samma bakterie. Kalvköttet hade tillagats i ett centralkök i Hudiksvall. En person avled. Frågor 1. Är Clostridium perfringens verkligen en möjlig orsak till diarrén i detta fall? Vad innebär det att man hittade ’höga antal’ av Clostridium perfringens i ärtsoppan och att man hittade Clostridium perfringens i avföringen hos vissa av de insjuknade? 2. Om Clostridium perfringens var orsaken – vad var fel i behandlingen av ärtsoppan? Hur kunde bakterierna finnas i en kokt soppa? 3. Vad är patogenesen för denna sjukdom? 4. Vad var inkubationstiden i Tierp-utbrottet? Diskutera hur en känd inkubationstid kan påverka din diagnos och prognosbedömning vid diarrésjukdom. 5. Vad är egentligen ’matförgiftning’? Orsakade ärtsoppan/kalvköttet en matförgiftning eller en ’livsmedelsburen infektion’? 6. Vilka bakterier kan orsaka matförgiftning? Beskriv deras toxiner. Vilka egenskaper har de? 7. Vilka andra bakterier producerar enterotoxin(er)? Beskriv dessa, likheter och olikheter. 8. Hur kan bakterier som inte producerar enterotoxin(er) orsaka diarrésjukdom? 9. En särskild typ av diarré orsakas av Clostridium difficile. Hur kan man få denna sjukdom och vad är patogenesen här? 10. Vad är förhållandet mellan diarrésjukdom och allvarlig gasgangrän, vilken också orsakas av Clostridium perfringens. Kunde någon av de äldre fått gasgangrän också? 11. Vilka är de vanligaste orsakerna till ”matförgiftning” i Sverige? Är Clostridium perfringens vanlig? 35 Infektionsimmunologi* – 1 mars 2017 Ansvarig: Martin Rottenberg Plats: Hus 75, Retzius väg 13 A-B Tid 13.00-14.30 Rum 202 203 206 207 209 213 220 222 Grupp 9 10 11 12 13 14 15 16 Tid 14.45-16.15 Rum 202 203 206 207 209 213 220 222 Grupp 1 2 3 4 5 6 7 8 Läsning Brauner et al.: kapitel 2.1 – 2.6 Janeway, Immunobiology: kapitel 1-3 och 9-11. Abbas, Basic Immunology: kapitel 3-4. Mål Att sammanfatta de grundläggande reglerna som styr interaktionen mellan immunsystemet och mikroorganismer. Instruktioner Med hjälp av seminarieläraren ska ni redogöra för rollen av de olika immunsystemdelarna vad gäller reglering av olika mikroorganismer i olika organ och vävnader. Du ska kunna beskriva olika effektor-mekanismer av immunsystemet (komplement, fagocyter, antikroppar, cytotoxiska T-celler, NK-celler, interferoner, lysozym, mm.). Du ska också kunna ge exempel på ”immune escape” mekanismer som olika mikroorganismer använder. Tänk igenom följande frågor I. Vad är relevansen av olika typer av medfödda immunmekanismer för skydd mot olika typer av mikroorganismer? II. Vad har antikroppar för roll kontra cellulär immunitet i reglering av bakterie-, virus-, protozo- eller svampinfektioner? III. Ange de olika CD4T hjälparceller-undergrupper som finns och varför endast vissa undergrupper svarar mot en viss typ av patogen och hur de medverkar till infektionskontrollen. Beskriv olika sätt där CD8+ T celler kan vara inblandade vid kontroll av intracellulär infektion. Varför tror du att vi behöver effektor- respektive centrala minnes T celler? IV. Beskriv medfödda och förvärvade immundefekter och ange vilka komponenter av immunsystemet som påverkas och vilka de respektive konsekvenserna är. V. Varför kan flera typer av smittsamma ämnen orsaka sjukdom i flera omgångar under ens livstid medan andra infektioner leder till livslång immunitet? VI. Varför blir vissa infektioner kroniska (latent/slumrande)? VII. Vilka smittsamma sjukdomar är lätta eller svåra att hantera genom vaccination? Vilka smittsamma sjukdomar kan hanteras med vaccination? Vilka risker och svårigheter medför vaccination? 36 LABORATIONER – VT 2017 Inverkan av farmaka på människoögat – 6 februari 2017 Ansvarig lärare: Delilah Hendriks Ansvarig läkare: Studenter som deltar som försökspersoner bör ej köra bil eller cykla hem från laborationen. Syfte Laborationens syfte är att visa farmakologisk påverkan på autonoma nervsystemets funktioner i ögat. Fysiologisk bakgrund Pupillens storlek regleras av tonus i två antagonistiska muskler i iris, den parasympatiskt innerverade M. sphincter pupillae och den sympatiskt innerverade M. dilator pupillae. Ögats brytningskraft regleras av linsens elasticitet och av tonus i M. ciliaris, som innerveras av parasympatiska trådar i N. oculomotorius. Kontraktion av M. ciliaris förskjuter ciliarkroppen framåt, varvid spänningen i linsligamenten minskar, vilket tillåter linsens främre kurvatur att öka och därmed också ögats brytningskraft (ackommodation). Omvänt minskar linsens brytningskraft vid sänkt tonus i M. ciliaris (anpassning för seende på långt håll). Farmaka o Pilokarpin 2 % Kolinergikum Agonist på acetylkolinreceptorer i glattmuskel o Tropicamid 0.5 % Antikolinergikum Antagonist på acetylkolinreceptorer i glattmuskel o Fysostigmin 0.1 % Kolinergikum Acetylkolinesterashämmare o Fenylefrin 10 % Adrenergikum Agonist på adrenerga alfareceptorer Pilokarpin och fysostigmin används vid glaukom. Tropicamid mydriatikum (pupillvidgare) används vid oftalmoskopering. Fenylefrin (metaoxedrin) används för oftalmoskopering samt vid iridocyklit (inflammation av iris och corpus ciliare). 37 Utförande Laboration sker i ordinarie laborationsgrupper. Alla bör delta. All indroppning av substanser utföres av försöksledaren. Nedanstående parametrar registreras med kamraters assistans och införes i protokollet. a) Pupillstorlek. Uppmätes med hålskiva och anges som hål nr 1, 2, ...9. Kom ihåg att vid varje undersökningstillfälle inta samma läge i förhållande till fönster eller andra ljuskällor. b) Närpunkt. Uppmätes med förskjutbar Jäger-tavla. Tavlans måttstock sättes mot proc. zygomaticus och kortaste avståndet i cm, då den finstilta texten kan läsas tydligt, anges som närpunkt. c) Fjärrpunkt. Bestämmes med Monoyers tavla. Det längsta avståndet i meter, på vilket försökspersonen kan läsa den minsta stilen tydligt, tages som ett approximativt värde på fjärrpunktens läge. d) Ljusreflex. Prövas med ficklampa. Anges som (-) om pupillsamman-dragningen är långsammare eller mindre uttalad i experimentögat än i kontrollögat. Om båda ögonen lika anges (n) för normal. Om experiment-ögats ljusreflex är livligare än kontrollögats anges (+). Observera De försökspersoner, som använder korrektionsglas, skall bära dessa under försökets gång, då ju deras refraktionsrubbning härigenom bör vara rättad och ögat alltså kan anses som normalt. Kontaktlinser bör däremot ej användas under laborationen. Kursdeltagare med andra ögonsjukdomar än refraktionsrubbningar bör ej deltaga i laborationen som försökspersoner. Effekterna av här nämnda koncentrationer pilokarpin, fysostigmin och tropikamid på ackommodationsapparaten försvinner vanligen efter ett par timmar men kan i sällsynta fall sitta kvar något dygn. Under denna tid är läsning försvårad. Viss individer kan bli ljuskänsliga under några timmar (solglasögon kan minska dessa besvär). Vidare blir avståndsbedömningen nedsatt. Det är således olämpligt att framföra fordon efter laborationen. 38 Farmaceutiska specialiteter o Pilokarpin IsoptoR-Pilokarpin, Pilokarpin CCS o Tropikamid MydriacylR o Fysostigmin (ex tempore) o Fenylefrin Phenylephrine hydrochloride Chauvin Varje grupp måste gå igenom laborationen med en lärare innan den avslutas! Instuderingsfrågor för ögonlaborationen 1. Vilka indikationer finns för de i labben använda preparaten? 2. Vilken är den viktigaste kontraindikationen för tropikamid? Varför? 39 Laboration – Ögon Försöksprotokoll Namn: Grupp: Administrerad substans: Tippad substans: Tidpunkt Pupillstorlek (hålnummer) Förändring av pupill-storlek (± hålnr) Fjärrpunkt (m) Förändring av fjärrpunkt (± %) Närpunkt (cm) Förändring av närpunkt (± %) Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. Tidpunkt Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. 40 Ljusreflex jämfört med andra ögat (ökad, minskad eller, utslagen) Laboration - Ögon Försöksprotokoll Namn: Grupp: Administrerad substans: Tippad substans: Tidpunkt Pupillstorlek (hålnummer) Förändring av pupill-storlek (± hålnr) Fjärrpunkt (m) Förändring av fjärrpunkt (± %) Närpunkt (cm) Förändring av närpunkt (± %) Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. Tidpunkt Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. 41 Ljusreflex jämfört med andra ögat (ökad, minskad eller, utslagen) Laboration - Ögon Försöksprotokoll Namn: Grupp: Administrerad substans: Tippad substans: Tidpunkt Pupillstorlek (hålnummer) Förändring av pupill-storlek (± hålnr) Fjärrpunkt (m) Förändring av fjärrpunkt (± %) Närpunkt (cm) Förändring av närpunkt (± %) Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. Tidpunkt Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. 42 Ljusreflex jämfört med andra ögat (ökad, minskad eller, utslagen) Laboration - Ögon Försöksprotokoll Namn: Grupp: Administrerad substans: Tippad substans: Tidpunkt Pupillstorlek (hålnummer) Förändring av pupill-storlek (± hålnr) Fjärrpunkt (m) Förändring av fjärrpunkt (± %) Närpunkt (cm) Förändring av närpunkt (± %) Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. Tidpunkt Före adm. 5 min efter adm. 15 min efter adm. 30 min efter adm. 45 min efter adm. 43 Ljusreflex jämfört med andra ögat (ökad, minskad eller, utslagen) Laboration Jämförelse av olika lokalanestetikas effekter på människa – 24 februari 2017 Ansvarig lärare: Funda Orhan Ansvarig läkare: Syfte Laborationen avser att visa duration och utbredning hos nedanstående substanser vid intrakutan administration. o o o o Mepivacain Lidokain Lidokain + Adrenalin Fysiologisk NaCl lösning (CarbocainR) (XylocainR) (XylocainR-Adrenalin) Utförande På varje försöksperson injicerar en kurskamrat 0,2 ml av respektive substans intrakutant på underarmens volarsida. Vid ymnig hårväxt - raka först. Tidpunkt för injektion noteras i protokollet. Varje kvaddels omkrets markeras med kulspetspenna och numreras. Därefter testas känsligheten för ytlig beröring med en bomullstuss och för smärta med en knappnål. Testa var 10:e minut. Följande variabler skall undersökas för varje injicerat ämne: 1. Duration, med vilket avses den tid anestesi föreligger utanför det för kvaddeln markerade området. 2. Utbredning, med vilket avses anestesins maximala utbredning i armens längd- och tvärriktning. Anges som längd + bredd. Duration och utbredning skall undersökas både för beröring och smärta! Försökspersonerna får ej veta vilket ämne som injicerats på de olika ställena utan skall med ledning av de erhållna värdena för duration och utbredning sluta sig till vilket ämne som injicerats på de respektive platserna. Resultaten antecknas i protokollen. Varje grupp måste gå igenom laborationen med en lärare innan den avslutas! OBS! I följande fall skall du ej delta som försöksperson: o o o Om du tidigare uppvisat allergisk reaktion vid administrering av lokalanestetika (t ex vid tandläkarbesök). Om du använder tricykliska antidepressiva. Om du har hypertyreos. 44 Laboration - lokalanestetika Försöksprotokoll Lokalanestetika Substans 1 2 3 4 Injektionstid Utbrednin g Smärta Berörin g Smärta Berörin g Smärta Berörin g Smärta Berörin g 5 min 10 min 20 min 30 min 40 min 50 min 60 min 70 min 80 min mm mm mm mm mm mm mm mm min min min min min min min min Max Utbrednin g Max Duration Substans 45 Laboration - lokalanestetika Försöksprotokoll Lokalanestetika Substans 1 2 3 4 Injektionstid Utbrednin g Smärta Berörin g Smärta Berörin g Smärta Berörin g Smärta Berörin g 5 min 10 min 20 min 30 min 40 min 50 min 60 min 70 min 80 min mm mm mm mm mm mm mm mm min min min min min min min min Max Utbrednin g Max Duration Substans 46 Instuderingsfrågor för lokalanestetikalaborationen 1. Vilken anses vara verkningsmekanismen för lokalanestetika? Vad menas med "use-dependence"? 2. Varför får man en vasodilatation av lokalanestetika utan vasokonstriktortillsats? 3. Hur kan pH påverka lokalanestetikas effekt? Nämn en klinisk situation där detta kan ha betydelse. 4. Varför använder man vasokonstriktortillsats? Finns det något lokalanestetiskt verkande medel där man inte behöver någon sådan tillsats? I vilka situationer och varför är det kontraindicerat med vasokonstriktortillsats? 5. Vilka administrationsformer förekommer vid klinisk användning av lokalanestetika? 6. Preparatet lidokain används även i andra sammanhang än vid lokalanestesi. Ange två. 47 GRUPPÖVNINGAR – VT 2017 Farmakokinetik och receptorfarmakologi – 27 och 30 januari 2017 Ansvarig lärare: Inger Johansson Målsättning Avsikten är att med konkreta och relevanta exempel belysa olika principer för läkemedels upptag, fördelning och eliminering samt att illustrera vissa basala begrepp vad gäller läkemedelseffekter. Förutsättning Gruppövningen förutsätter att Du läst på det som förelästs i allmän farmakologi och receptorfarmakologi (speciellt grundläggande begrepp och termer) och orienterat Dig i motsvarande kapitel i läroboken (Rang and Dale´s Pharmacology, 2016, sid 1-66, 101-142, 692-702). Utförande Varje grupp diskuterar och löser arbetsmaterialets uppgifter under två pass (gruppövning 1a respektive 1b). Varje grupp arbetar så långt man hinner under första passet och fortsätter sedan med resten vid andra tillfället. Lärare finns närvarande under gruppövningen. Hjälmedel Läroboken och Läkemedelsboken Miniräknare med log-funktioner (ett mindre antal finns att låna). Millimeterpapper (lin-lin) – finns i detta kompendium. Logaritmpapper (lin-log) – finns i detta kompendium. Varje grupp måste gå igenom gruppövningen med en lärare innan dagen avslutas (gäller båda dagarna). 48 Logaritmpapper (lin-log) 49 50 1. Absorption av läkemedel och biologisk tillgänglighet Med biologisk tillgänglighet vid peroral administrering menas den andel av tillförd dos läkemedel som når systemkretsloppet i oförändrad form. Den biologiska tillgängligheten kan beräknas från arean under kurvan (area under the curve, AUC) för den perorala dosen jämfört med AUC för den intravenösa dosen enligt: Bioavailability(%) AUC po AUCiv (Vill man ange den biologiska tillgängligheten i % av given dos multipliceras kvoten ovan med 100) Tre olika -blockare får belysa olika orsaker till variationer i biologisk tillgänglighet. . 1a. -blockaren alprenolol (en oselektiv β-blockerare med egenstimulerande effekt, dvs. egentligen en partiell agonist, som tidigare såldes på den svenska marknaden), absorberas till nästan 100% av tarmslemhinnan. Trots detta skiljer sig plasmakoncentrationen av läkemedlet efter peroral och intravenös administrering av samma dos enligt figuren nedan. Förklara mekanismen. Time (hours) 51 1b. Nedan visas plasmakoncentrationen av pindolol (en oselektiv β-blockare med viss egenstimulerande aktivitet, dvs. egentligen en partiell agonist) efter peroral och intravenös tillförsel av samma dos. I båda fallen återfinns totalt 40% av given dos i urinen i form av oförändrat läkemedel. Time (hours) Gör en uppskattning av storleken på den biologiska tillgängligheten? Vad säger urinutsöndringsdata om den biologiska tillgängligheten vid p.o. tillförsel. 1c. Nedan visas plasmakoncentrationen av en tredje β-blockare, atenolol (som är β1 – selektiv och utan egeneffekt) efter peroral och intravenös administrering av samma dos. Två dygn efter administrering av den orala dosen hade patienten utsöndrat 43% av dosen i urinen och 52% i faeces. Efter intravenös administrering utsöndrades 85% av dosen via urinen och 10% i faeces. (Siffrorna avser summan av oförändrat läkemedel och metaboliter.) Time (hours) 52 Diskutera olika alternativ beträffande orsaken till den låga biologiska tillgängligheten. 53 2. Distribuering av läkemedel. Distribueringen av läkemedel från blodbanan till olika organ är många gånger av stor betydelse för läkemedlens effekt och biverkningar. Detta förhållande illustreras nedan med två exempel. 2a. Tiopental är ett ”ultrakortverkande” lipidlösligt narkosmedel. Efter en intravenös dos somnar patienten nästan omedelbart (efter 30-40 s). Förklara varför medlet når CNS så snabbt. Blodkoncentrationen av tiopental sjunker snabbt och patienten vaknar upp inom 10 min. När detta läkemedel började användas antog man allmänt att den korta verkningsdurationen berodde på en snabb metabolism. Detta visade sig dock felaktigt. Tiopental metaboliseras och utsöndras långsamt (10-15% per timme). Förklara varför effekten blir så kortvarig och ”vart medlet tar vägen”. Diskutera även vad som händer vid upprepad administrering av detta medel. (Ledning: Rang & Dale’s, 2016) 2b. Amfetamin är en bas med pKa 9.9. Finns det någon risk att medlet ansamlas i modersmjölken och därmed överföres till ammade barn? (Bröstmjölkens pH är 6.6 och blodets 7.4.) Förklara mekanismen. (Ledning: Rang & Dale’s, 2016) 54 Sammanfattning av begreppen 0:te och 1:a ordningens kinetik, dosberoende kinetik samt clearance Vid 0:te ordningens kinetik (då enzymsystemen är mättade) elimineras en konstant mängd per tidsenhet och plasmakoncentrationen sjunker följaktligen med ett visst konstant värde per tidsenhet (t ex ca 0.15 promille/timme för alkohol). Multipliceras detta värde med den skenbara distribueringsvolymen (Vd) för läkemedlet, får man den mängd som elimineras per tidsenhet. Vid 1:a ordningens kinetik är det en konstant andel av kroppens läkemedelsinnehåll som elimineras per tidsenhet. Konstanten ke är den hastighet med vilken plasmakoncentrationen för läkemedlet minskar och ke har enheten ”per tidsenhet” (1/tidsenhet, t.ex. h-1). Om konstanten ke, vid 1:a ordningens kinetik, multipliceras med den skenbara distribueringsvolymen för läkemedlet ifråga erhålles värdet på clearance för läkemedlet. Dosberoende kinetik talar man om när man vid en kliniskt relevant dosökning får en övergång från 1:a till 0:te ordningens kinetik pga. enzymmättnad. Teoretiskt sett skulle alla läkemedel kunna uppvisa denna typ av kinetik om dosen ökades tillräckligt, men vid de doser som används kliniskt inträffar detta endast för mindre antal läkemedel. Clearance (Cl) för ett läkemedel är den teoretiska volym som helt renas från läkemedlet per tidsenhet (och oberoende av plasmakoncentrationen). Egentligen är det en större volym som delvis (ofullständigt) renas varje tidsenhet. För läkemedel med samma clearance är halveringstiden direkt proportionell mot Vd, dvs ju större volym läkemedlet är fördelat på desto längre tid tar det att bli av med det. Man bör skilja på clearance i olika organ (t.ex. leverclearance) och plasmaclearance, som avser kroppens totala clearance. Ser man till elimineringen i ett visst organ kan man även använda begreppet extraktionsgrad. Det avser den fraktion av läkemedelsinnehållet i plasma som elimineras vid en passage genom organet och den maximala extraktionsgraden är 1. Läkemedel brukar klassas som låg- respektive högclearanceläkemedel (alt. låg- resp. högextraktionsläkemedel). Vanligtvis har högclearanceläkemedel en hög metabolismhastighet i levern. För läkemedel inom lågclearancegruppen anses endast den fria andelen av läkemedlet i plasma vara tillgänglig för metabolism och den begränsande faktorn för metabolismhastigheten är leverns enzymkapacitet. För läkemedel inom högclearancegruppen (med extraktionskvoter närmare 1) däremot, anses såväl plasmaproteinbundet som fritt läkemedel vara tillgängligt för metabolism (pga. snabb dissociation av bundet läkemedel) och den begränsande faktorn för elimineringen är då mängden läkemedel som förs till det eliminerande organet (vanligen levern) per tidsenhet. Ett liknande förhållande gäller för de läkemedel som snabbt utsöndras i njurarna genom aktiv tubulär sekretion (se Rang & Dale’s, 2016). 55 3. Eliminering av läkemedel Alkoholens kinetik är av stor rättsmedicinsk betydelse. Alkohol elimineras ur blodet enligt nollte ordningens kinetik, vilket framgår av följande exempel: En försöksperson som väger 90 kg intar på fastande mage 10 cl 50% (w/v) alkohol. Koncentrationer av alkohol i blod (uttryckta i mg/ml, dvs. promille) uppmätes och ritades in i en graf: 1.1 Concentration of Ethanol (mg/ml) 3a. 1.0 0.9 Fasting 0.8 With food 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.0 0 50 100 150 200 250 300 Time (min) Markera i figuren: - Absorptionsfas - Distribueringsfas - Elimineringsfas Bestäm följande parametrar (vid intag av alkohol på fastande mage är F nära100%) och ange sorten noga. - Koncentrationsminskningen av alkohol i blod per tidsenhet (promille per timme) - Den ”teoretiska” blodkoncentrationen vid tiden 0 (C0) - Den skenbara distributionsvolymen (Vd) (anges både i l och l/kg) - Total mängd alkohol som elimineras från kroppen per tidsenhet (g per timme) Är det meningsfullt att bestämma T1/2 vid denna typ av kinetik? 56 Samma person som i exemplet ovan intog, vid ett annat och något festligare tillfälle, samma mängd alkohol, de blodalkoholkoncentrationer som då uppmättes finns inritade i grafen på förra sidan. Diskutera vilka orsakerna kan vara till den långsammare absorptionen och den minskade biologiska tillgängligheten för alkohol vid detta tillfälle. Bestäm C0 och beräkna F vid intag av alkohol i samband med måltid: Vilken är orsaken till att uträknat F blir annorlunda i detta fall jämfört med det tidigare exemplet? (Ledning: Rang and Dale’s Pharmacology, 2016) 57 3b. Fenobarbital (molekylvikt 232 g/mol) är ett barbitursyraderivat (pKa 7.3), som bl.a. höjer kramptröskeln och som sedan lång tid används vid behandling av epilepsi. Medlet utgör ett alternativ efter diazepam vid status epilepticus. Terapeutiskt intervall: 40-130 µmol/l. Fenobarbital elimineras enligt första ordningens kinetik. Följande exempel gäller en pojke (kroppsvikt 10 kg) som gavs 100 mg fenobarbitalal intravenöst för att kupera ett epilepsianfall. Blodkoncentrationen av fenobarbitol mättes var 10:e timme. Time after inj. (hours) 10 20 30 40 50 60 70 Phenobarbitone conc (mol/l) 56 49 43 37 33 29 24 Time after inj. (hours) 80 90 100 110 120 130 140 Phenobarbitone conc (mol/l) 22 19 17 14 12.5 11 9.5 Åskådliggör dessa värden i två diagram, ett lin-lin-diagram på vanligt ”millimeterpapper” (skala: 1 cm = 10 tim på x-axeln och 1 cm = 2.5 µmol/l på y-axeln) och ett lin-log-diagram på semilogaritmiskt papper (skala: 1 cm = 10 tim på x-axeln (lin-skala) och koncentrationen avsättes på log-skalan). Alternativt kan diagrammet göras i Excel där man kan jämföra linjär respektive logaritmisk skala för y-axeln. Bestäm följande parametrar och ange sorten noga: - Den ”teoretiska” blodkoncentrationen vid tiden 0 (C0) - Den skenbara distributionsvolymen (Vd) (anges både i l och l/kg) - T½ - Ke (Ledning: bestäm halveringstiden grafiskt och utnyttja sambandet mellan t½ och ke, se Rang & Dale’s, 2016) Hur länge kvarstår den terapeutiska blodkoncentrationen av fenobarbitaldosen? Eliminering av fenobarbital kan påverkas genom att ändra urinens pH. Detta används vid behandling av fenobarbitalintoxikationer. Hur skall urinens pH ändras för att påskynda elimineringen av fenobarbital? Förklara mekanismen. (Ledning. Rang & Dale’s, 2016) Ange något sätt att förändra urinens pH i önskad riktning. 58 Varför är inte denna metod generellt användbar vid intoxikation med alla sura föreningar? Naturläkemedel som innehåller extrakt från johannesört inducerar en rad läkemedelsmetaboliserande enzymer och bör inte kombineras med fenobarbital och en del andra läkemedel. Hur påverkar denna interaktion fenobarbitals kinetik och vilka risker innebär det vid behandling med fenobarbital? 3c. Fenytoin är ett antiepileptikum som används vid grand mal. Fenytoin uppvisar s.k. dosberoende kinetik. Fenytoin metaboliseras i levern till 95% och leverns metaboliserande enzymer kan mättas, vilket förklarar fenytoins kinetik. Terapeutiskt intervall: 40-100 mol/l. Nedan visas koncentrationen av fenytoin i plasma efter intag av 400 mg peroralt. Antag att absorptionen av fenytoin är avslutad inom 15-20 timmar efter intaget. Definiera vad som menas med dosberoende kinetik. Var på kurvan elimineras fenytoin efter 1:a respektive 0:te ordningens kinetik? Diskutera betydelsen av denna dosberoende kinetik vid fenytoinbehandling av epilepsi. Förklara varför det är så vanligt med koncentrationsbestämningar av just fenytoin. 59 60 3d. Hur kan en enzyminduktion förväntas påverka metabolismhastigheten för lågrespektive högclearanceläkemedel? 3e. Kan man ur nedanstående figur utläsa om lidokain är ett låg- eller högclearanceläkemedel? 61 4. Läkemedelskoncentrationen vid upprepad dosering 4a. En patient (60 kg) med förmaksflimmer står på underhållsbehandling med digoxin (0.375 mg dagligen). Halveringstiden (t½) för digoxin hos patienten är 40 tim, den biologiska tillgängligheten (F) är 50% och den skenbara distribueringsvolymen (Vd) är 6 l/kg. Beräkna jämviktskoncentrationen (Css) av digoxin hos denna patient och avgör om den ligger inom det terapeutiska området (1-2 ng/ml). Vilket samband råder under ”steady state” mellan den per tidsenhet tillförda dosen och den per tidsenhet eliminerade mängden läkemedel? Diskutera hur det kan komma sig att ett läkemedel har en skenbar distribueringsvolym som är flera gånger större än kroppsvolymen? (Ledning: nedanstående formler och Rang & Dale’s, 2016) C ss FD Cl T Css FD Vd ke T Css F D t½ Vd T ln 2 F = bioavailability, D = dose, T = dosing interval 4b. Samtidigt födointag har rapporterats fördröja digoxinets perorala absorption, men den mängd som absorberas förblir oförändrad. Diskutera om denna typ av interaktion kan ha någon klinisk relevans för ett läkemedel som digoxin, som endast ges i upprepad dosering under lång tid. 4c. Digoxin elimineras huvudsakligen (90%) renalt, vilket betyder att njurfunktionen spelar stor roll för digoxins halveringstid. I en studie av patienter med grav njurinsufficiens (creatininclearance c:a 10 ml/min) fann man att digoxin hade en halveringstid på 84 tim mot normalt 40 tim. Vilket värde skulle Css anta om patienten i uppgift 4a hade en fördubblad halveringstid pga. njurinsufficiens. Ligger denna nya koncentration inom det terapeutiska området? Vilka åtgärder skulle du vidta? 62 Vad är viktigt att tänka på vid dosering av digoxin till äldre patienter? ( Ledning: Rang & Dale’s, 2016) 4d. En annan hjärtglykosid, digitoxin (som används i många länder, dock inte i Sverige), skiljer sig från digoxin vad gäller farmakokinetiken, medan farmakodynamiken (verkningsmekanismen) är densamma. - Biologisk tillgänglighet: 100 % t½: 100-200 tim Plasmaproteinbindningsgrad: 97 % (för digoxin 20 %) Terapeutisk plasmakoncentration: 20-30 ng/ml Elimineringssätt: huvudsakligen metabolism i levern, endast ett par procent lämnar kroppen via urinen i oförändrad form. Den normala underhållsdosen för digitoxin (0.1 mg/dygn) är mycket lägre än för digoxin men den terapeutiska plasmakoncentrationen för digitoxin mångfaldigt högre. Diskutera orsakerna till detta. Vilken effekt skulle en nedsatt njurfunktion ha på jämviktskoncentrationen av digitoxin? Hur lång tid efter, insatt behandling, skulle det ta att nå jämviktskoncentration med digoxin respektive digitoxin? Finns det något sätt att snabbare nå upp till denna koncentration? 63 Sambandet mellan läkemedelskoncentration och farmakologisk effekt. Vanligtvis är effekten av ett läkemedel ej linjärt relaterad till läkemedelskoncentrationen i biofasen (dvs. det/de vätskerum där effekten utövas), men däremot är effekten proportionell mot logaritmen av läkemedelskoncentrationen inom ett stort dosområde. Detta förhållande gäller i princip både in vitro, på isolerade organ, och in vivo, men är oftast lättare att påvisa in vitro, eftersom läkemedel ofta framkallar flera olika effekter in vivo (direkt eller indirekt) som tillsammans bestämmer ”nettoresultatet”. Dessutom är koncentrationen läkemedel i biofasen oftast okänd. Grafen nedan visar koncentrations-effektkurvan (semilogaritmisk) av adrenalininducerad kontraktion av kaninaorta in vitro. 100 Contraction (% of max) 5. 90 80 70 60 50 40 30 20 10 0 0.1 1.0 10.0 100.0 1000.0 Concentration of adrenaline (nM) Hur skulle kurvan se ut om den var ritad i en linjär graf? 64 6. Interaktioner mellan agonister och antagonister 6a. Figuren nedan visar sambandet mellan noradrenalinkoncentration och kontraktion av ett blodkärl in vitro. Log Concentration of Noradrenaline Rita in i figuren hur koncentrations-effektkurvan skulle kunna se ut om noradrenalin tillsattes i närvaro av en konstant koncentration av: I) Den reversibla kompetitiva α-blockeraren fentolamin. II) Den irreversibla kompetitiva α-blockeraren fenoxybenzamin (förutsätt att spare receptors saknas). 65 6b. Figuren nedan visar koncentrations-effektkurvan för muskarin på kontraktion av isolerad tunntarm. Muskarin är en full agonist medan pilokarpin är en partiell kolinerg agonist. I detta system har pilokarpin en inneboende aktivitet som är ca 60% av muskarinets. Tröskeldosen för pilokarpin är ca 100 ggr högre än för muskarin. Rita i figuren nedan hur koncentrations-effektkurvan skulle kunna se ut för : I) Pilokarpin ensamt II) Ökande koncentration pilokarpin i närvaro av 10-6 M muskarin (muskarinet finns redan i bufferten runt organet) III) Ökande koncentration pilokarpin i närvaro av 10-5 M muskarin 66 67 7. Att läsa och granska en forskningsartikel Instruktion: Läs artikeln ”A unique mechanism of -blocker action: Carvedilol stimulates -arrestin signaling ” (Gruppövning 1 – Vetenskaplig artikel). Fundera och resonera i form av receptorfarmakologiska termer. 1. Vad är den inneboende aktiviteten (efficacy) för en full agonist, en partisk agonist, en antagonist och en invers agonist? 2. Vad är skillnaden mellan en antagonist och en invers agonist? 3. Hur gjorde författarna för att klassificera de olika substanserna som neutrala antagonister respektive inversa agonister? 4. Vad är en partisk ligand? (definition) 5. Vad innebär det att det finns partiska ligander för G-protein-receptorer? Förklara betydelsen. 6. Hur visade författarna att carvedilol, till skillnad från de andra testade substanserna, är en partisk ligand för beta-arrestin på b2-adrenerga receptorer? 7. Förklara vilka fördelar som kan finnas med att använda substanser som är partiska ligander vid utvecklandet av nya effektiva läkemedel. 68 A unique mechanism of -blocker action: Carvedilol stimulates -arrestin signaling James W. Wisler*, Scott M. DeWire†, Erin J. Whalen*, Jonathan D. Violin‡, Matthew T. Drake†§, Seungkirl Ahn†, Sudha K. Shenoy*, and Robert J. Lefkowitz*†‡¶ Departments of *Medicine and ‡Biochemistry and †Howard Hughes Medical Institute, Duke University Medical Center, Durham, NC 27710; and §Division of Endocrinology, Mayo Clinic College of Medicine, 200 First Street SW, Rochester, MN 55905 Contributed by Robert J. Lefkowitz, August 22, 2007 (sent for review July 11, 2007) -adrenergic receptor 兩 antagonist 兩 ERK 1/2 兩 scaffold 兩 internalization S even transmembrane receptors (7TMRs), are one of the most important target classes of therapeutic agents, accounting for ⬎30% of all prescription medications (1). Traditionally, ligands for such receptors have been classified as agonists, which promote signaling through activation of heterotrimeric G proteins and generation of second messengers such as cyclic adenosine monophosphate (cAMP), or antagonists that block such stimulation (2). Recent work, however, has suggested that this simple classification is inadequate and that receptors may exist in multiple active conformations, each of which could display a distinct signaling profile (3–6). Moreover, it has recently been appreciated that, in addition to signaling through G proteins, 7TMRs can also use the multifunctional adaptor proteins -arrestins 1 and 2 to activate cellular pathways (7, 8). These proteins were originally discovered to bind to activated GRK-phosphorylated receptors and thus block or ‘‘desensitize’’ further receptor-stimulated G protein activation (9). Consequently, -arrestins exist as bifunctional cellular mediators: even as they terminate G protein signaling, they can function as scaffolds for signaling networks such as mitogen-activated protein kinases (MAPK) including ERK 1/2 (10, 11), cJun N-terminal kinase (JNK3) (12), and p38 kinase (13) as well as phosphatidylinositol 3 kinase (PI3K) and Akt (14–16). Recent work also suggests that -arrestin may have significant antiapoptotic roles within the cell (10, 14, 17), alwww.pnas.org兾cgi兾doi兾10.1073兾pnas.0707936104 though the exact mechanisms behind this regulation are largely unknown. Ligands targeting 7TMRs such as AR antagonists are used therapeutically in numerous conditions. By virtue of their ability to block the deleterious G protein-mediated effects of excess catecholamine stimulation in the heart and other organs, AR antagonists have become important therapeutic tools for a variety of cardiovascular conditions including hypertension (18), angina (19), post-acute myocardial infarction (AMI) (20) and heart failure (21). The AR antagonist carvedilol recently was demonstrated to significantly reduce morbidity and mortality in heart failure and in post-AMI patients (22–25). Moreover, although controversial, some evidence suggests carvedilol may possess unique survival advantages in heart failure over other AR antagonists (23). The mechanisms of such advantages are currently unknown but have been variously ascribed to ancillary properties of carvedilol including antioxidant (26), antiinflammatory (27), antiproliferative (28), and antiarrhythmic abilities (29) as well as its capacity to serve as an ␣1 adrenergic receptor antagonist (30). Given recent advances in understanding 7TMR signaling and regulation, we examined a subset of 16 known AR antagonists for both AC and ERK 1/2 efficacy at the 2AR in simple cellular systems. This subset encompassed a wide range of clinically used agents including both nonselective and subtype-selective ligands. The results suggest a unique profile of activities for carvedilol that might explain, in part, its positive therapeutic attributes and promote development of 2AR ligands that antagonize Gsmediated signaling while stimulating  -arrestin-mediated signaling. Results cAMP Accumulation. Typically, receptor ligands have been classi- fied as either agonist (full or partial) or antagonist with respect to G protein-coupling efficiency. Work over the last 20 years has expanded this classification to include the concept of inverse agonism, and it has been observed that numerous classical neutral antagonists actually act as either partial agonists or inverse agonists (2). Here, we used the live-cell biosensor ICUE2 to assess Gs-dependent cAMP efficacy at the 2AR (31). Acebutolol, alprenolol, atenolol, labetalol, oxprenolol, pindolol, and practolol displayed weak partial agonism for Gs-dependent Author contributions: J.W.W., S.M.D., E.J.W., J.D.V., M.T.D., S.A., S.K.S., and R.J.L. designed research; J.W.W., S.M.D., E.J.W., J.D.V., and M.T.D. performed research; J.W.W., S.M.D., E.J.W., J.D.V., and S.K.S. analyzed data; and J.W.W. and R.J.L. wrote the paper. The authors declare no conflict of interest. Freely available online through the PNAS open access option. Abbreviations: AR, -adrenergic receptor; 7TMR, 7 transmembrane receptor; GRK, G protein-coupled receptor kinase; 2ARTYY, 2ART68F,Y132G,Y219A; AC, adenylyl cyclase; ERK 1/2, extracellular-regulated kinase 1/2; NS, nonstimulated. ¶To whom correspondence should be addressed. E-mail: [email protected]. This article contains supporting information online at www.pnas.org/cgi/content/full/ 0707936104/DC1. © 2007 by The National Academy of Sciences of the USA PNAS 兩 October 16, 2007 兩 vol. 104 兩 no. 42 兩 16657–16662 MEDICAL SCIENCES For many years, -adrenergic receptor antagonists (-blockers or AR antagonists) have provided significant morbidity and mortality benefits in patients who have sustained acute myocardial infarction. More recently, -adrenergic receptor antagonists have been found to provide survival benefits in patients suffering from heart failure, although the efficacy of different -blockers varies widely in this condition. One drug, carvedilol, a nonsubtypeselective AR antagonist, has proven particularly effective in the treatment of heart failure, although the mechanism(s) responsible for this are controversial. Here, we report that among 16 clinically relevant AR antagonists, carvedilol displays a unique profile of in vitro signaling characteristics. We observed that in 2 adrenergic receptor (2AR)-expressing HEK-293 cells, carvedilol has inverse efficacy for stimulating Gs-dependent adenylyl cyclase but, nonetheless, stimulates (i) phosphorylation of the receptor’s cytoplasmic tail on previously documented G protein-coupled receptor kinase sites; (ii) recruitment of -arrestin to the 2AR; (iii) receptor internalization; and (iv) activation of extracellular regulated kinase 1/2 (ERK 1/2), which is maintained in the G protein-uncoupled mutant 2ART68F,Y132G,Y219A (2ARTYY) and abolished by arrestin2 siRNA. Taken together, these data indicate that carvedilol is able to stabilize a receptor conformation which, although uncoupled from Gs, is nonetheless able to stimulate -arrestinmediated signaling. We hypothesize that such signaling may contribute to the special efficacy of carvedilol in the treatment of heart failure and may serve as a prototype for a new generation of therapeutic 2AR ligands. Fig. 1. cAMP responses monitored by ICUE2. HEK-293 cells stably expressing 2AR and the cAMP biosensor ICUE2 were treated for 2 min with a panel of ligands described as 2AR antagonists. (A) cAMP agonism was measured as the rate of change of the ICUE2 FRET ratio corresponding to the rate of cAMP accumulation. Ligands that did not induce cAMP generation were tested for inverse agonism in the same cells. (B) These cells exhibit constitutive 2AR activity that, although too weak to generate high basal cAMP, causes a rapid increase in cAMP when phosphodiesterases are inhibited with isoxybutylmethylxanthine (IBMX). This effect is receptor-specific, because there is no IBMX-induced cAMP increase in cells lacking overexpressed receptor (data not shown). We measured inverse agonism by pretreating cells with ligand for 5 min and quantifying the rate of cAMP increase for 30 sec after IBMX treatment. Inverse agonists are those ligands that do not stimulate cAMP accumulation on their own and decrease the rate of IBMX-induced cAMP accumulation caused by constitutive receptor activity. Data represent mean ⫾ SE from five independent experiments. **, P ⬍ 0.001 vs. nonstimulated cells (NS). AC activation (Fig. 1A). Ligands that did not stimulate significant cAMP generation were further analyzed for inverse agonism. Each of these (betaxolol, bisoprolol, carvedilol, ICI 118,551, metoprolol, nadolol, propranolol, sotalol, and timolol) decreased constitutive cAMP accumulation and are thus inverse agonists (Fig. 1B). As described (2), we found no neutral antagonists, indicating that this classification may be an artifact of low assay sensitivity and that most if not all AR ligands have some level of efficacy. ERK 1/2 Activation. Recent work has demonstrated that -arrestins can serve as scaffolds that activate signaling networks including ERK 1/2 (10, 11) independent of G protein activity (25). Although none of the AR antagonists we tested led to ERK1/2 activation in untransfected HEK-293 cells, we observed that in HEK-293 cells stably expressing 2 pmol/mg 2AR, a wide range of ERK 1/2 activation responses can be elicited by different AR antagonists (Fig. 2A). Acebutolol, atenolol, alprenolol, carvedilol, labetalol, oxprenolol, pindolol, practolol, and propranolol all activate ERK to varying degrees. To define the role of G protein stimulation in these ERK1/2 responses, we used a mutant 2AR that does not couple to G proteins but maintains the ability to stimulate MAP kinases: 2ARTYY (25). In cells stably expressing the mutant 2ARTYY, only carvedilol stimulated a significant ERK1/2 response (Fig. 2B). Through either receptor, 16658 兩 www.pnas.org兾cgi兾doi兾10.1073兾pnas.0707936104 Fig. 2. ERK activation in 2AR and 2ARTYY stable cells. HEK-293 cells stably expressing 2AR (A) or 2ARTYY (B) were stimulated with the panel of 2AR ligands used in Fig. 1 at 10 M for 5 min, and cell lysates were analyzed for pERK and ERK by Western blot. pERK was normalized to total ERK protein. Data represent mean ⫾ SE of at least three independent experiments done in duplicate. Quantification of pERK bands is as a percentage of maximal activity observed for isoproterenol. *, P ⬍ 0.05 vs. NS, **, P ⬍ 0.001 vs. NS. carvedilol-stimulated pERK was insensitive to pertussis toxin pretreatment, excluding a role for Gi coupling in carvedilolstimulated pERK [supporting information (SI) Fig. 6]. Furthermore, carvedilol-stimulated pERK was completely blocked by pretreatment with the 2AR selective antagonist ICI 118,551 (data not shown), demonstrating 2AR specificity. 2AR Phosphorylation. We then focused our screen on carvedilol and propranolol, which were the only AR antagonists that functioned as inverse agonists for Gs-dependent AC activation but stimulated ERK 1/2 activation. Previous work demonstrated that the 2AR cytoplasmic tail must be phosphorylated by GRKs in order for -arrestin to be recruited to the receptor (32). Using both a phospho-specific antibody identifying GRK phosphorylation sites and 32P metabolic labeling, we observed that carvedilol but not propranolol can stimulate significant 2AR phosphorylation. A 30-min treatment with carvedilol stimulated a 1.9 ⫾ 0.09-fold increase in receptor phosphorylation at the known GRK sites, serine 355/356 (Fig. 3A) and a 1.9 ⫾ 0.1-fold increase in global receptor phosphorylation (Fig. 3B). Carvedilol-mediated receptor phosphorylation was blocked by propranolol pretreatment (data not shown). -Arrestin Recruitment. The 2AR exhibits a transient, low- affinity interaction with -arrestins and undergoes rapid recycling to the plasma membrane after internalization, a pattern known as ‘‘Class A’’ recruitment. ‘‘Class B’’ receptors such as the vasopressin V2 receptor (V2R) have a more prolonged interaction with -arrestin and recycle to the plasma membrane slower than Class A receptors (33). One method for increasing -arrestin affinity, and therefore assay sensitivity, is to construct chimeric Class A receptors that possess a Class B receptor Wisler et al. Fig. 3. 2AR phosphorylation stimulated by carvedilol. HEK-293 cells stably expressing 2AR were stimulated with 10 M of ligand for 30 min, and cell lysates were either analyzed for receptor phosphorylation by Western blot (A) or immunoprecipitated with anti-FLAG beads and analyzed by 32P metabolic labeling (B). Data represent mean ⫾ SE of at least five independent experiments. ***, P ⬍ 0.0001 vs. NS. 2AR Internalization. Previous studies have demonstrated that -arrestins can serve as adaptors for AP-2 and clathrin (35–37), which bring activated receptors to clathrin-coated pits for endocytosis and facilitate receptor internalization. Carvedilol, but not propranolol, induces receptor internalization as assessed by f luorescence-activated cell sorting. Carvedilol stimulated 5.5% ⫾ 1.7 receptor internalization, whereas the full agonist isoproterenol stimulated 38.7% ⫾ 3.5 receptor internalization (Fig. 4B). -Arrestin2-Mediated ERK Activation. To test the potential role of -arrestin in carvedilol-stimulated cell signaling, we analyzed ERK 1/2 activation after depletion of -arrestin2 by siRNA in HEK-293 cells stably expressing 2AR. For isoproterenol, pERK was reduced by 42.3 ⫾ 2.2% at 5 min, whereas for carvedilol, pERK was reduced by 71.0 ⫾ 4.5% (Fig. 5A). In HEK-293 cells stably expressing 2ARTYY, pERK for isoproterenol was reduced by 38.5 ⫾ 5.2% at 5 min, whereas for carvedilol, pERK was reduced by 70.1 ⫾ 4.4% after -arrestin2 silencing (Fig. 5B). Both of these results correlated with the overall efficiency of the -arrestin2 siRNA to lower cellular levels of -arrestin2 by ⬇70% (data not shown). A second siRNA sequence targeting -arrestin2 gave similar results, demonstrating specificity of the silencing effect (data not shown). Of Wisler et al. Fig. 4. -arrestin2-GFP translocation to the 2AR-V2R and receptor internalization stimulated by carvedilol. HEK-293 cells transiently expressing the 2AR-V2R chimera were stimulated for 2 min with either isoproterenol (Iso), carvedilol (Carv), or propranolol (Prop). (A) -arrestin2-GFP translocation to the 2AR-V2R was then monitored by confocal microscopy. Images are representative of six independent experiments. (B) HEK-293 cells stably expressing 2AR were stimulated with 10 M of ligand for 30 min and assayed for internalization by fluorescence-activated cell sorting. Data represent mean ⫾ SE of five independent experiments done in duplicate. *, P ⬍ 0.05 vs. NS, ***, P ⬍ 0.0001 vs. NS. note, isoproterenol-stimulated ERK activation seen in cells expressing 2ARTYY after siRNA silencing of -arrestin2 was due to G protein-stimulated ERK activation from endogenous 2ARs in HEK-293 and is not mediated by the mutant receptors (25). Discussion Here, we report that among 16 AR antagonists, a diverse spectrum of efficacies was observed for both Gs-dependent and -arrestin-dependent cellular signaling (SI Table 1). Additionally, we identify one compound, carvedilol, that possesses the unique signaling profile of negative efficacy for Gs-dependent AC activation but positive efficacy for -arrestin-dependent ERK 1/2 activation. Moreover, carvedilol stimulates phosphorylation of the 2AR, -arrestin translocation to the receptor, and receptor internalization, all of which are characteristic of arrestin-mediated cellular processes. Thus, carvedilol acts as a ‘‘biased’’ ligand (38) signaling via -arrestin-dependent ERK 1/2 activation in the absence of G protein activation. We hypothesize PNAS 兩 October 16, 2007 兩 vol. 104 兩 no. 42 兩 16659 MEDICAL SCIENCES cytoplasmic tail, such as the 2AR-V2R receptor chimera (34). As visualized by confocal microscopy, both isoproterenol and carvedilol stimulated recruitment of -arrestin2-GFP to the 2AR-V2R receptor chimera, whereas propranolol did not (Fig. 4A). Alprenolol, labetalol, and ICI 118,551 were also unable to stimulate -arrestin2–GFP recruitment (data not shown). Furthermore, carvedilol-stimulated -arrestin recruitment was blocked by pretreatment with either ICI 118,551 or propranolol (data not shown), demonstrating 2AR specificity. Fig. 5. Carvedilol-stimulated ERK 1/2 phosphorylation is abolished by siRNA targeting -arrestin2. HEK-293 cells stably expressing 2AR (A) or 2ARTYY (B) were stimulated with 10 M isoproterenol (Iso) or carvedilol (Carv) in the presence of either control siRNA (CTL) or siRNA targeting -arrestin2 (arr2) for 5 min, and cell lysates were analyzed for pERK, ERK, and -arrestin 1/2 by Western blot. Data represent mean ⫾ SE of four independent experiments done in duplicate. Quantification of pERK bands is as a percentage of maximal activity observed for isoproterenol. **, P ⬍ 0.01; *** P ⬍ 0.001. that this bias may help explain carvedilol’s unique clinical effectiveness in heart failure and other cardiovascular diseases. The concept of ligand bias challenges the traditional paradigm of 7TMR ligand characterization based on ‘‘intrinsic efficacy,’’ the amount of stimulus per receptor molecule elicited by a ligand upon binding (39). Implicit in this classification is the assumption that a given ligand should be equally effective at stimulating all cellular responses for a given receptor (39, 40). However, much work over the last 15 years has demonstrated that a single ligand can have differential intrinsic efficacies for various effector systems downstream of a given receptor (3, 39, 41–43). Consequently, a given ligand’s pharmacologic efficacy, or its ability to produce a desired therapeutic effect, may not be fully explained by its ability to stimulate a single receptor-mediated signaling pathway. The recognition that pharmacologic efficacy cannot be encompassed by the simple agonist/antagonist classification has not, to date, been correlated with insight into associated clinical outcomes of biased ligands. Recently, it has been appreciated that many receptors including the 2AR can exist in multiple ‘‘active’’ conformations after ligand binding (3–6). These variable conformations may lead to widely differing cellular outcomes and may help explain the diverse signaling profiles we observed with a variety of AR antagonists. Viewed in the context of this report, it seems likely that carvedilol stabilizes distinct receptor conformations from other AR antagonists. Thus, it is perhaps not surprising that these compounds range in their clinical efficacy as well (21). We postulate that the diverse signaling profiles observed in this study indicate that ligand bias may play a role in determining the effectiveness of pharmacologic agents targeting 7TMRs. One of the major paradigm shifts in cardiovascular medicine was the innovation that AR antagonists could be an effective therapy for the treatment of heart failure (44). This originated from the observation that activation of the sympathetic nervous system may be fundamental to the progression of heart failure (45). Consequently, it was hypothesized that pharmacologic blockade of the sympathetic nervous system, in particular of the 1AR and 2AR, could slow the progression of heart failure (46). It was recognized quite early that different AR antagonists possessed differing clinical efficacies in heart failure, and their effectiveness could not simply be attributed to a class effect (47, 48). Currently, only three agents, carvedilol, metoprolol succinate, and bisoprolol are approved for the treatment of heart 16660 兩 www.pnas.org兾cgi兾doi兾10.1073兾pnas.0707936104 failure in the United States (48). Although their relative efficacies are unknown, some evidence suggests that carvedilol may possess survival advantages over other AR antagonists (23). Survival advantages observed with carvedilol treatment in cardiovascular diseases including heart failure (23) and postAMI (20) have been ascribed to a multitude of ancillary properties of carvedilol as outlined earlier (26–30). However, controversy still exists over whether any of these properties can sufficiently explain carvedilol’s clinical efficacy. We hypothesize that the unique signaling profile exhibited by carvedilol may, in part, explain its distinctive clinical efficacy. This hypothesis is supported by recent animal work demonstrating that -arrestindependent signaling can be cardioprotective in the presence of chronic catecholamine stimulation, as is the case in heart failure, whereas G protein-dependent signaling may be cardiotoxic under these same conditions (49). These in vivo experiments revealed that, in these conditions, the loss of -arrestin-mediated signaling through the 1 adrenergic receptor resulted in increased apoptosis and cardiac deterioration. This work provides strong evidence that a biased ligand such as carvedilol, which antagonizes G protein-mediated signaling while simultaneously stimulating -arrestin-mediated signaling, may have increased therapeutic potential over conventional AR antagonists. In our studies, only carvedilol possessed this unique profile of inverse agonism for Gs-dependent AC activation while concurrently stimulating -arrestin-dependent ERK 1/2 activation. One possible caveat, however, is that all experiments were carried out by using exogenously expressed receptors because of the difficulty in detecting responses with endogenous receptors in our assays. Propranolol, which also acted as an inverse agonist for Gs-dependent AC activation, was able to weakly activate ERK 1/2 as observed by others (41–43). In our system, however, propranolol was unable to activate several characteristic processes of -arrestin-dependent signaling. These observations suggest the possibility of yet another signaling pathway to ERK 1/2 activation that is both G protein- and -arrestin-independent and that can be stimulated by propranolol. The functional consequences of such a pathway are unknown but likely differ from both the G protein- and -arrestin-dependent pathways. In the current report, we monitored only ERK 1/2 activation as a readout for -arrestin-dependent signaling. Because arrestin is known to signal via a range of other signaling pathways, -arrestin-biased ligands likely also stimulate Wisler et al. Materials and Methods Materials. Acebutolol, alprenolol, atenolol, betaxolol, ICI 118,551, isoproterenol, labetalol, metoprolol, nadolol, pindolol, propranolol, sotalol, and timolol were obtained from Sigma (St. Louis, MO). Bisoprolol and practolol were obtained from Mutual Pharmaceutical (Philadelphia, PA) and Ayerst Laboratories (Madison, NJ), respectively. Racemic carvedilol was generously provided by Dr. Richard Bond (University of Houston, Houston, TX). Plasmids. FLAG-2AR/pcDNA3 (25) and -arrestin2-GFP (25) were generated in our laboratory. The 2AR-V2R chimera receptor was a generous gift from Dr. Marc Caron (Duke University) (34). ICUE2 cAMP Assay. HEK-293 cells stably overexpressing both the human 2AR (25) and the cAMP biosensor ICUE2 (31) were generated and validated as described (31). Intracellular cAMP concentrations were measured as a FRET ratio: the CFP intensity (438/24 excitation and 483/32 emission bandpass filters; Semrock, Rochester, NY) over FRET intensity (542/27 emission filter). Experiments were performed on a NOVOstar plate reader (BMG, Durham, NC). Data shown are the change in FRET ratio before and after addition of ligand or, for the inverse agonism experiments, addition of isobutylmethylxanthine (IBMX). IBMX was used at 250 M to inhibit PDE activity and allow detection of constitutive 2AR activity. Immunoblotting. Phospho-ERK and phospho-2AR immuno- blotting were carried out as described (25). pERK antibody was anti-phospho-p44/42 MAPK (1:3,000; Cell Signaling Technology, Beverly, MA) for Western blot. Total ERK1/2 was detected with anti-MAPK 1/2 (1:6000; Upstate Biotechnology, Lake Placid, NY) for Western blot. Antibodies recognizing the 2AR and phospho-2AR (on S355/6) were purchased from Santa Cruz Biotechnology, Santa Cruz, CA. Rabbit polyclonal arrestin antibody (A1CT) was generated in our laboratory (51). Metabolic Labeling and -Arrestin Translocation Assays. Metabolic labeling and -arrestin translocation assays were accomplished according to previously described protocols (25). For -arrestin translocation, HEK-293 cells were transiently transfected with the 2V2R chimera (34) and -arrestin-2-GFP by using FuGENE (Roche, Indianapolis, IN). Images were taken at 1-min intervals for 10 min after stimulation. Internalization and siRNA Silencing of Gene Expression. Internalization and siRNA gene silencing were carried out with previously described siRNAs and methods (25), except for the addition of a second siRNA targeting  -arrestin2, which was 5⬘CCAACCUCAUUGAAUUUGA-3⬘. To determine -arrestin 2 protein silencing, endogenous -arrestin 1/2 were detected with A1CT (1:3000) antibody, as described (52). Only experiments with validated silencing were analyzed; average silencing of -arrestin2 was 69.9 ⫾ 1.6%. Statistical Analysis. Statistical analyses performed were one-way ANOVA with post hoc Bonferroni tests, or Student’s paired t tests. A P value of ⬍0.05 was considered statistically significant. Cell Culture. HEK-293 lines stably expressing 2 pmol/mg 2AR or 2ARTYY were generated in our laboratory (25) and were maintained in MEM supplemented with 10% FBS, 1% penicillin/streptavidin, and 400 g/ml G418 (Sigma). We thank Donna Addison and Elizabeth Hall for excellent secretarial assistance, Dr. Richard Bond for providing carvedilol, and Dr. Marc Caron for providing 2AR-V2R plasmid. This work was supported in part by National Institutes of Health Grants HL16037 and HL70631. J.W.W. was supported by a fellowship from the Sarnoff Cardiovascular Research Foundation, J.D.V. was supported by a fellowship from the American Heart Association, and R.J.L. is an Investigator with the Howard Hughes Medical Institute. Hopkins AL, Groom CR (2002) Nat Rev Drug Discov 1:727–730. Kenakin T (2004) Trends Pharmacol Sci 25:186–192. Kenakin T (1995) Trends Pharmacol Sci 16:232–238. Ghanouni P, Steenhuis JJ, Farrens DL, Kobilka BK (2001) Proc Natl Acad Sci USA 98:5997–6002. Swaminath G, Deupi X, Lee TW, Zhu W, Thian FS, Kobilka TS, Kobilka B (2005) J Biol Chem 280:22165–22171. Granier S, Kim S, Shafer AM, Ratnala VR, Fung JJ, Zare RN, Kobilka B (2007) J Biol Chem 282:13895–13905. Lefkowitz RJ, Shenoy SK (2005) Science 308:512–517. DeWire SM, Ahn S, Lefkowitz RJ, Shenoy SK (2007) Annu Rev Physiol 69:483–510. Benovic JL, Kuhn H, Weyand I, Codina J, Caron MG, Lefkowitz RJ (1987) Proc Natl Acad Sci USA 84:8879–8882. DeFea KA, Zalevsky J, Thoma MS, Dery O, Mullins RD, Bunnett NW (2000) J Cell Biol 148:1267–1281. 11. Luttrell LM, Roudabush FL, Choy EW, Miller WE, Field ME, Pierce KL, Lefkowitz RJ (2001) Proc Natl Acad Sci USA 98:2449–2454. 12. McDonald PH, Chow CW, Miller WE, Laporte SA, Field ME, Lin FT, Davis RJ, Lefkowitz RJ (2000) Science 290:1574–1577. 13. Sun Y, Cheng Z, Ma L, Pei G (2002) J Biol Chem 277:49212–49219. 14. Povsic TJ, Kohout TA, Lefkowitz RJ (2003) J Biol Chem 278:51334–51339. 15. Goel R, Phillips-Mason PJ, Raben DM, Baldassare JJ (2002) J Biol Chem 277:18640–18648. 16. Beaulieu JM, Sotnikova TD, Marion S, Lefkowitz RJ, Gainetdinov RR, Caron MG (2005) Cell 122:261–273. 17. Revankar CM, Vines CM, Cimino DF, Prossnitz ER (2004) J Biol Chem 279:24578–24584. 18. Williams B, Poulter NR, Brown MJ, Davis M, McInnes GT, Potter JF, Sever PS, Thom SM (2004) Br Med J 328:634–640. 19. Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, Ferguson TB, Jr, Fihn SD, Fraker TD, Jr, Gardin JM, et al. (2003) Circulation 107:149–158. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Wisler et al. PNAS 兩 October 16, 2007 兩 vol. 104 兩 no. 42 兩 16661 MEDICAL SCIENCES arrestin-dependent, G protein-independent signaling via JNK3, p38 kinase, PI3K, or Akt. Biased ligands also possibly stimulate multiple levels of specificity such as GRK subtype-specific receptor phosphorylation and/or stabilization of specific arrestin conformations coupled to distinct functional outcomes. Furthermore, compounds could also be biased in the opposite direction from carvedilol, activating G protein-mediated pathways while simultaneously antagonizing -arrestin-dependent signaling pathways (50). The physiological and clinical profiles of such agents might be distinct from those currently available. Ultimately these biased ligands may possess even greater efficacy in the treatment of various diseases while reducing undesirable effects and would represent a model for the development of 7TMR-targeted therapeutics. The recognition that intrinsic efficacy is not simply a function of G protein-coupling efficacy and can vary greatly depending on the observed effector system has changed the definition of pharmacologic efficacy. Here, we have identified a signaling profile unique to carvedilol that may correlate with, or be responsible for, its unique clinical efficacy. In our study, carvedilol stimulates only very weak activation of -arrestindependent signaling processes. Consequently, we propose that carvedilol could serve as a prototype for the design of compounds that, although possessing no efficacy for G protein stimulation, could nevertheless stimulate -arrestin-dependent signaling to a greater extent than carvedilol. Biased ligands of this type would represent a new generation of therapeutic agents that could be targeted for any number of receptors. Although the therapeutic potential of these biased ligands remains to be demonstrated, the data presented herein suggest a potential direction in the treatment of cardiovascular disease and, in particular, of heart failure. 20. Kopecky SL (2006) Am J Cardiol 98:1115–1119. 21. Bristow MR (2000) Circulation 101:558–569. 22. Packer M, Bristow MR, Cohn JN, Colucci WS, Fowler MB, Gilbert EM, Shusterman NH (1996) N Engl J Med 334:1349–1355. 23. Poole-Wilson PA, Swedberg K, Cleland JG, Di Lenarda A, Hanrath P, Komajda M, Lubsen J, Lutiger B, Metra M, Remme WJ, et al. (2003) Lancet 362:7–13. 24. Dargie HJ (2001) Lancet 357:1385–1390. 25. Shenoy SK, Drake MT, Nelson CD, Houtz DA, Xiao K, Madabushi S, Reiter E, Premont RT, Lichtarge O, Lefkowitz RJ (2006) J Biol Chem 281:1261–1273. 26. Yue TL, Cheng HY, Lysko PG, McKenna PJ, Feuerstein R, Gu JL, Lysko KA, Davis LL, Feuerstein G (1992) J Pharmacol Exp Ther 263:92–98. 27. Packer M (1998) Prog Cardiovasc Dis 41:39–52. 28. Ohlstein EH, Douglas SA, Sung CP, Yue TL, Louden C, Arleth A, Poste G, Ruffolo RR, Jr, Feuerstein GZ (1993) Proc Natl Acad Sci USA 90:6189–6193. 29. Naccarelli GV, Lukas MA (2005) Clin Cardiol 28:165–173. 30. Bristow MR, Larrabee P, Minobe W, Roden R, Skerl L, Klein J, Handwerger D, Port JD, Muller-Beckmann B (1992) J Cardiovasc Pharmacol 19(Suppl 1):S68–S80. 31. DiPilato LM, Cheng X, Zhang J (2004) Proc Natl Acad Sci USA 101:16513– 16518. 32. Lohse MJ, Andexinger S, Pitcher J, Trukawinski S, Codina J, Faure JP, Caron MG, Lefkowitz RJ (1992) J Biol Chem 267:8558–8564. 33. Oakley RH, Laporte SA, Holt JA, Caron MG, Barak LS (2000) J Biol Chem 275:17201–17210. 34. Oakley RH, Laporte SA, Holt JA, Barak LS, Caron MG (1999) J Biol Chem 274:32248–32257. 35. Goodman OB, Jr, Krupnick JG, Santini F, Gurevich VV, Penn RB, Gagnon AW, Keen JH, Benovic JL (1996) Nature 383:447–450. 16662 兩 www.pnas.org兾cgi兾doi兾10.1073兾pnas.0707936104 36. Krupnick JG, Goodman OB, Jr, Keen JH, Benovic JL (1997) J Biol Chem 272:15011–15016. 37. Laporte SA, Miller WE, Kim KM, Caron MG (2002) J Biol Chem 277:9247–9254. 38. Violin JD, Lefkowitz RJ (2007) Trends Pharmacol Sci, in press. 39. Urban JD, Clarke WP, von Zastrow M, Nichols DE, Kobilka B, Weinstein H, Javitch JA, Roth BL, Christopoulos A, Sexton PM, et al. (2007) J Pharmacol Exp Ther 320:1–13. 40. Benovic JL, Staniszewski C, Mayor F, Jr, Caron MG, Lefkowitz RJ (1988) J Biol Chem 263:3893–3897. 41. Baker JG, Hall IP, Hill SJ (2003) Mol Pharmacol 63:1312–1321. 42. Azzi M, Charest PG, Angers S, Rousseau G, Kohout T, Bouvier M, Pineyro G (2003) Proc Natl Acad Sci USA 100:11406–11411. 43. Galandrin S, Bouvier M (2006) Mol Pharmacol 70:1575–1584. 44. Waagstein F, Hjalmarson A, Varnauskas E, Wallentin I (1975) Br Heart J 37:1022–1036. 45. Bristow MR (1984) N Engl J Med 311:850–851. 46. Fowler MB, Bristow MR (1985) Am J Cardiol 55:120D–124D. 47. Cruickshank JM (2007) Int J Cardiol 120:10–27. 48. Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, Jessup M, Konstam MA, Mancini DM, Michl K, et al. (2005) Circulation 112:e154–e235. 49. Noma T, Lemaire A, Naga Prasad SV, Barki-Harrington L, Tilley DG, Chen J, Le Corvoisier P, Violin JD, Wei H, Lefkowitz RJ, Rockman HA (2007) J Clin Invest 117:2445–2458. 50. Groer CE, Tidgewell K, Moyer RA, Harding WW, Rothman RB, Prisinzano TE, Bohn LM (2007) Mol Pharmacol 71:549–557. 51. Attramadal H, Arriza JL, Aoki C, Dawson TM, Codina J, Kwatra MM, Snyder SH, Caron MG, Lefkowitz RJ (1992) J Biol Chem 267:17882–17890. 52. Ahn S, Shenoy SK, Wei H, Lefkowitz RJ (2004) J Biol Chem 279:35518–35525. Wisler et al. cAMP inverse agonist, ERK activation via β-arrestin Carvedilol cAMP inverse agonist, no ERK activation Betaxolol Bisoprolol ICI 118,551 Metoprolol Nadolol Sotalol Timolol cAMP partial agonist, ERK activation Acebutolol Alprenolol Atenolol Labetalol Oxprenolol Pindolol Practolol Propranolol cAMP inverse agonist, ERK activation via unknown mechanism Table S1: Classification of Signaling Efficacies of a subset of β-blockers GRUPPÖVNING Neurotransmission och neuropsykofarmakologi – 1-2 februari 2017 Ansvarig lärare: Kent Jardemark Målsättning Nedanstående frågor och diskussionspunkter syftar till att med föreläsningarna i neurotransmission och neurofarmakologi som bakgrund öka förståelsen av de farmakologiska mekanismerna bakom olika effekter av neurofarmaka. Huvudmålet är inte att finna det rätta svaret, utan snarare att förstå varför detta svar är det rätta. Hjälpmedel Till hjälp vid detta grupparbete finns kurslitteraturen Rang and Dale´s Pharmacology, 2016, sid 143-211, 449-497, 536-614, Läkemedelsboken och FASS. Fundera, resonera och diskutera i gruppen! Varje grupp måste gå igenom gruppövningen med en lärare innan den avslutas. 76 Dopaminerg transmission 1. Parkinsons sjukdom beror på en degeneration av de nigrostriatal dopaminneuronen och behandlingen syftar till att öka den dopaminerga transmissionen. 1a. Ange i synapsskissen på nästa sida följande för dopamin: Syntesvägen, samt det hastighetsreglerande steget Receptorer som finns beskrivna. Fungerar någon av receptortyperna som autoreceptor och var är de lokaliserade? Vilken funktion fyller denna typ av receptor? Beskriv hur dopamin elimineras. Vilken mekanism är viktigast för eliminering av dopamin från synapskyftan? 1b. Hur kan man på olika sätt öka dopaminerg transmission? Ange alla sätt du kan komma på, samt exempel på farmaka. Vilka av dessa används vid behandling av Parkinsons sjukdom? 2. Den ursprungliga s.k. dopaminhypotesen för schizofreni postulerade en överaktivitet i det mesolimbiska dopaminsystemet som förklaring till de positiva symptomen vid sjukdomen, men denna patofysiologiska dopaminrelaterade teori har numera utvecklats i flera avseenden. 2a. Hur har den ursprungliga dopaminhypotesen modifierats för att förklara även de negativa symptomen och de kognitiva problemen vid schizofreni? Var i hjärnan anses dessa ha sitt ursprung och vilka andra transmittorsubstanser har föreslagits vara inblandade? 2b. Antipsykotiska läkemedel vanligen delas upp i typiska och atypiska preparat. På vilka grunder baseras denna indelning? 2c. Klozapin är ett atypiskt antipsykotikum som trots, eller snarare tack vare, sin breda receptorbindningsprofil är det läkemedel som har störst effektivitet vid behandling av schizofreni. Diskutera betydelsen av olika antipsykotiska medels receptorbindningsprofil för deras terapeutiska effekt respektive biverkningar. 2d. Vilka andra indikationer förutom schizofreni finns för antipsykotiska läkemedel? 77 Återupptagspump Receptor 78 Mitokondrie Kolinerg transmission 3. Farmakologisk modulering av kolinerg neurotransmission både i det perifera och det centrala nervsystemet har en rad viktiga kliniska tillämpningar. Ange minst tre kliniska områden där kolinerga läkemedel används, ge exempel på farmaka för respektive områden och förklara deras verkningsmekanismer med hjälp av synapsskissen nedan. 79 Serotonerg och noradrenerg transmission 4. Monoaminhypotesen Den s.k. monoaminhypotesen för depression innebär att det föreligger en funktionell brist på monoaminer fr.a. serotonin och noradrenalin 4a. Vilka orsaker har man att kalla det en ”funktionell” brist? Vad baseras hypotesen på och vilka argument stöder inte hypotesen? 4b. Redogör med hjälp av synapsskissen nedan för hur följande antidepressiva läkemedel påverkar serotonerg och/eller noradrenerg transmission: citalopram, klomipramin, venlafaxin, moklobemid och mirtazapin. 4c. Ange de vanligaste biverkningarna för selektiva serotoninåterupptagshämmare (SSRI) och tricykliska antidepressiva (TCA). Venlafaxin hämmer i liket med TCA både 5-HT- och NA-upptag, men ger inte lika mycket besvärande biverkningar som TCA. Förklara varför. Noradrenergt neuron Serotonergt neuron 80 Beroendeframkallande medel 5. Diskutera vad som menas med tolerans på farmakokinetisk och farmakodynamisk nivå. Vilken mekanism har störst betydelse vid t.ex. alkoholism? 6. Vad innebär korstolerans? Ge exempel. 7. Beroendepotential 7a. Vilket samband råder mellan tillslagstiden för effekten av ett medel och dess beroendepotential? 7b. Ge exempel på hur beroendepotentialen för ett medel kan variera mellan olika administrationsformer 7c. Hur utnyttjas denna princip i behandlingen av beroende? 8. Abstinens 8a. Definiera begreppet abstinens 8b. Vilken egenskap hos läkemedlet avgör graden av abstinens? 9. Beroendeframkallande medel kan framkalla en upplevelse av belöning (eufori) vilket anses bero på stimulering av det mesolimbiska dopaminsystemet. Beskriv med hjälp av figuren på nästa sida hur olika beroendeframkallande medel som amfetamin, kokain, opiater och nikotin kan öka dopaminerg transmission. 81 10. Redogör för vilka läkemedel som finns tillgängliga för behandling av alkoholberoende, samt deras verkningsmekanismer. 11. Vilka läkemedel kan användas vid behandling av alkoholabstinens och delirium tremens? Anxiolytika och hypnotika 12. Hur verkar bensodiazepiner på cellulär nivå? Vilka är deras huvudsakliga centrala effekter? Vilka kliniska användningsområden har bensodiazepiner. 13. Diskutera varför bensodiazepiner är olämpliga vid långtidsbehandling av ångestsyndrom såsom t.ex. paniksyndrom och tvångssyndrom. Vad används istället? 14. Ange olika principiella verkningsmekanismer som kan utnyttjas för att förhindra ett epileptiskt anfall. Ge exempel på läkemedel samt ange vilka som kan användas för behandling av tonisk-kloniska anfall respektive absenser. 82 Opioider 15. Redogör för opioiders centrala och perifera effekter. Vilka kan utnyttjas kliniskt och vilka ger upphov till biverkningar? 16. Var i kroppen - och hur – utövar morfin och andra opioider sin smärthämmande effekt? Beskriv med utgångspunkt från bilden på nästa sida lokalisationer och mekanismer (berörda transmittorsubstanser och effekter). 83 GRUPPÖVNING Kardiovaskulär farmakologi – 16 februari 2017 Ansvarig lärare: Inger Johansson Målsättning Nedanstående frågor och diskussionspunkter syftar till att med föreläsningarna i kardiovaskulär farmakologi som bakgrund öka förståelsen av de farmakologiska mekanismerna bakom effekterna av farmakologisk behandling av hypertoni, ischemisk hjärtsjukdom, hjärtsvikt, hyperlipidemi och trombo-embolism. Huvudmålet är inte att finna det rätta svaret, utan snarare att förstå varför detta svar är det rätta. Hjälpmedel Till hjälp vid detta grupparbete finns kurslitteraturen Rang and Dale´s Pharmacology, 2016, sid 247-307, 355-366, 380-401, 418-424, Läkemedelsboken och FASS. Fundera, resonera och diskutera i gruppen! Varje grupp måste gå igenom gruppövningen med en lärare innan den avslutas. 84 Hypertoni 1. Antihypertensiva läkemedel framkallar blodtryckssänkning genom påverkan på olika organ. Ange i nedanstående figur i vilka organ följande läkemedel utövar sina effekter och beskriv medlens verkningsmekanismer; ß-blockerare, tiaziddiuretika, kalciumflödeshämmare, ACE-hämmare, angiotensinreceptorblockerare (ARB). Brain Heart Kidney Resistance vessels Renin/angiotensin /aldosterone 85 2. Patienter med hypertoni har ofta även andra riskfaktorer för ischemisk hjärtsjukdom, bl.a. diabetes, atheroskleros i perifera kärl och mångårig rökning. Vilka särskilda aspekter bör tas i beaktande vid hypertonibehandling av patienter med ovanstående riskfaktorer och varför? Vilka preparatgrupper kan vara lämpliga respektive olämpliga? 3. Så kallade ”rebound” effekter är en risk vid utsättande av behandling med ßblockerare. Förklara vad begreppet innebär. Vad är den troliga mekanismen? Hur bör man förfara för att undvika detta? 4. Beskriv skillnader mellan loop- och tiaziddiuretika med avseende på verkningsmekanism, effekter på diures (anslagstid, duration) samt effekter på elektrolytbalans. Vilket av dessa preparat bör användas vid försämrad njurfunktion och/eller hjärtsvikt? 5. Långvarig diuretikabehandling kan orsaka elektrolytrubbningar. Klinskt är kaliumrubbningar särskilt framträdande då dessa ofta ger CNS-påverkan och arytmier. Hur kan denna elektrolytrubbning förebyggas? Diskutera för- och nackdelar med olika alternativ. 86 Ischemisk hjärtsjukdom 6. Redogör för profylaktisk behandling vid stabil angina pectoris a) Vilka effekter på hjärtat vill man uppnå? b) Redogör för olika positiva effekter på pre- och afterload av ß-blockerare, kalciumflödeshämmare, samt låg- respektive högdos nitrater. c) Hur minskas risken för hjärtinfarkt? 7. Vid anfall av angina pectoris brukar nitroglycerinpreparat ges, vanligen sublingualt för att få akut smärtlindring. a) Vilka fördelar har detta jämfört med att ge medlen peroralt? b) Vilka sorters nitratpreparat kan med god effekt ges peroralt? Vad är den farmakokinetiska skillnaden mot de sublingualt administrade preparaten? c) Behandling med långverkande nitrater är förenat med ett särskilt problem. Vilket? Hur kan detta åtgärdas? 8. Redogör för farmakologisk behandling vid hjärtinfarkt a) i det akuta skedet b) sekundärprofylaktiskt? Vilka läkemedel kan ges till de allra flesta patienter och vilka ges bara till särskilda patientgrupper? 87 Hjärtsvikt 9. a) Vad menas med hjärtsvikt? b) Farmakologisk behandling vid hjärtsvikt innefattar i första hand ACE-hämmare, diuretika och β-blockerare. Ytterligare en preparatgrupp som ofta används (f.f.a vid samtidigt förmaksflimmer) är digitalisglykosider. Diskutera hur ACE-hämmare, diuretika och digitalis påverkar pre- och afterload samt hjärtminutvolym vid hjärtsvikt. Skilj på akut och kronisk diuretikabehandling. Ange vilken parameter som påverkas först av respektive preparat. 10. -blockerare har tidigare ansetts kontraindicerade vid hjärtsvikt, men är idag helt centrala vid behandling av kompenserad hjärtsvikt. Diskutera a) varför -blockad kan vara farligt för ett sviktande hjärta? b) positiva effekter av -blockad vid hjärtsvikt. 11. a) Vilka symptom kan uppträda hos patienter med digitalisöverdosering? b) Behandling med tiaziddiuretika kan leda till hypokalemi och hyperkalcemi. Dessa elektrolytrubbningar leder till ökad risk för biverkningar vid samtidig digitalisbehandling. Varför? c) Åtgärd vid misstänkt digitalisbiverkan/-intoxikation? 88 Trombo-embolism 12. Varför har acetylsalicylsyra liten eller ingen effekt på djup ventrombos? 13. Vid venösa tromboser påbörjas ofta samtidigt behandling med perorala antikoagulantia (warfarin) och lågmolekylärt heparin. Varför? 14. I stort sett alla patienter blir insatta på acetylsalicylsyra-preparat om de har kärlkramp eller i efterförloppet till en hjärtinfarkt. Vilka behandlingsalternativ eller and trombocythämmande läkemedel finns för patienter som lider av upprepade magsår? 15. Redogör för det fibrinolytiska (=trombolytiska) preparatet t-PA med avseende på verkningsmekanism, biverkningar och indikationer. 16. Behandling med antikoagulantia eller fibrinolytiska preparat kan orsaka blödning, vilken dock kan motverkas med antidoter och andra substanser som påverkar koagulationen. Redogör för dessa och deras verkningsmekanismer. 89 17. Många patienter har flera hjärt/kärlsjukdomar samtidigt. Ibland kan ett tillstånd ge ett annat som komplikation. Det är dock viktigt att förstå vilket grundtillstånd som i första hand behandlas. Markera i tabellen (kryssa i) lämpliga farmakologiska behandlingsmöjligheter vid respektive kardiovaskulära sjukdom. Hypertoni Hjärtsvikt β-blockare Diuretika Kalciumblockare ACE-hämmare Nitroglycerin Digitalis Antikoagulantia Trombolytika Trombocythämmare Statiner 90 Angina Pectoris Hjärtinfarkt Tromboembolism



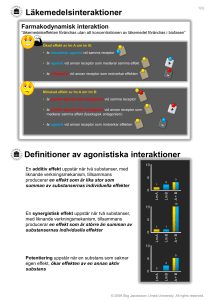
![(Microsoft PowerPoint - stressHT11 [Kompatibilitetsl\344ge])](http://s1.studylibsv.com/store/data/000065069_1-bd84f9c97bd1963063358a6117031b45-300x300.png)