CANCER
advertisement

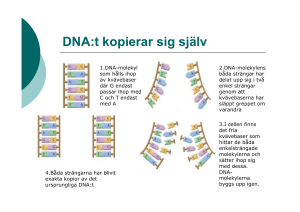
CANCER Cancer • var tredje svensk drabbas av cancer någon gång under livet • 45 000 nya fall i Sverige • 20 000/år dör till följd av cancer i Sverige • genetiska faktorer och miljöfaktorer 1 Cancerincidens i % Män Kvinnor prostata tjocktarm hud trachea/lunga urinvägar malignt lymfom 32.6 11,3 11,0 7,4 6,8 3,9 bröst 28,7 tjocktarm hud livmoder trachea/lunga övrigt 11,7 8,9 5,8 5,6 4,7 övrigt 3,2 äggstock 4 nervsystem 2,5 malignt lymfom 3,2 Definitioner • tumör = abnorm proliferation av celler – benign: respekterar vävnadsgränser – malign: invasiv o/e metastaserande • ursprung – vävnad • carcinom – epitelvävnad • sarkom – bindväv • Leukemi – blodet (benmärg) – celltyp (tex. fibrom – fibroblaster, lymfomlymfocyter) – organ (tjocktarmscancer 2 Bening resp. malign Bukspottskörtel cancer 3 Cancer är “klonal” Cancer är klonal! 4 ORSAKER • genetiska – BRCA1, BRCA2, hereditär colonpolypos – predisponerande resp. skyddande gener • Miljöfaktorer – Mutagena, – Proliferations-stimulerande • Medicinsk behandling (sekundär Ca.) – Strålning, cellgift, immun-hämmande Genetisk predisposition - ena gen-kopian skadad i det befruktade ägget. 5 Miljöfaktorer • rökning (25% av cancerfall) – – – – – – lungcancer matstrupe struphuvud urinblåsa livmoderhals bukspottkörtel Miljöfaktorer • kost • alkohol – Mun, svalg, matstrupe, lever • • • • • • • hormoner Virus, bakterier UV-ljus, radioaktiv strålning Arbetsmiljö, kemikalier (någon %) luftföroreningar (1%) inflammation immunosuppression 6 Miljöfaktorer: carcinogener • skadar DNA => mutationer • Stimulerar cellproliferation = tumörpromotor – Phorbolestrar, hormon-liknande, mm Tillväxtstimulering - klon med icke reparerad DNA skada hinner hinner få fäste * (* Upprepade DNA skador ökar chansen till ”two hits i samtidigt tillväxt och apoptosgen 7 Inflammation som promoter magsår (magcancer), inflammatorisk tarmsjukdom (koloncancer),hepatit (levercancer) • Uppreglering av TNFα (cytokin) • Binder TNFα receptor hos omgivande celler – NFκΒ aktiveras, • Transkription av proliferationsgener • hämmad apoptos • Farlig ”promotor” om samtidigt DNA är skadat hos dessa. CANCER-UTVECKLING mutationer i gener som styr: • proliferering – (svar på tillväxtsignaler) • cellcykelkontroll • differentiering • apoptos • DNA: korrekturläsning och reparation kan ge icke-reglerad tillväxt 8 Cancerutveckling • Initiering (initial mutation) – onormal proliferation, ”normal” i övrigt • Progression (ytterligare mutation) – tillväxthastighet och adaptionsförmåga ökar – Förändras jmf med normal celltyp (”utseende”) – invasivitet och förmåga till metastasering – De-differentiering – ”skenande vagn”, instabil Stadier i cancerutveckling 2. Progression 1. Initiering 9 Metastasering (animation) ”Multiple hit” – fler än en gen/en mekanism måste vara skadad => Mer än en mekanism påverkad • • • • • • Onormal tillväxt (signalering, expression) Defekt kontroll/proof-reading av DNA Icke fungerande DNA reparation Defekt ”broms” Defekt apoptos Undgår immunförsvaret 10 Cancercellers egenskaper • • • • • • • • okontrollerad tillväxt Minskat beroende av tillväxtfaktorer defekt cell-cell eller cell-matrix kontakt inhibition Apoptos-reglering rubbad eller utslagen defekt differentiering (även de-differentiering) sekretion av proteaser – bryter ner extracellulärmatrix sekreterar tillväxtfaktorer – inducerar angiogenes Genetiskt instabila – Många cancerceller går i nekros men några ”mer adapterade” överlever och tar snabbt över n= Cancerceller är genetiskt instabila - inte bara en fördel 11 Konskekvens av genetisk instabilitet • Ackumulering av defekt DNA, – Strängbrott, – Polyploidi, Aneuploidi (kromosom-antal rubbat) – Kromosom translokationer, förluster, kopieringar – ofta ej kompatibla med cellöverlevnad – cancerceller ofta i nekros Egenskaper hos cancerceller • Okänsliga för externa signaler • Undgår apoptos • Undviker: – programmerade proliferations-begränsningar • Utrycker bl.a. telomeras – Åldras inte normalt – Utebliven differentiering (ibland de-differentiering, ”backar”) • Genetiskt instabila • Invasiva, ”bryter sig loss” och sprids • Överlever och prolifererar på fel ställen 12 Defekt kontakt-inhibition Defekt densitets-beroende inhibition (animation) 13 Onormal autokrin tillväxtstimulering Onormal receptorsignalering (utan ligand) 14 Störd intracellulär signalering (Ras är muterat i många cancerformer) 15 Defekt apotos initering eller ökad inhibition av apoptos Bcl-2 – hindrar cytokrom c-utsläpp Defekt differentiering Leukemi 16 TUMÖRVIRUS • kan orsaka cancer i försöksdjur eller människa • virus från olika virusfamiljer • olika mekanismer för olika virus Hepatit B- och Hepatit C-virus • kronisk leverinfektion • kontinuerlig proliferation av hepatocyter • > 100 ggr risk för levercancer 17 SV40, polyoma och adenovirus • TransformationvirusDNA integreras i värdcellens genom • Early genes stimul. Cell-proliferation • Binder, inaktiverar p53, Rb Papillomavirus • ~60 olika humana papillomavirus • infekterar epitelceller • benigna (vårtor, kondylom) och maligna (livmoderhalscancer m.fl.) tumörer • Hemuppgift förra föreläsningen 18 Herpesvirus • • • • 100-200 kB Orsakar cancer Kaposi´s sarkomassocierat herpesvirus Epstein-Barr virus Retrovirus •cancer i många djurarter •HTLV-1 (T-cells leukemi) ONKOGENER • gener som kan inducera celltransformering (=omvandling från normal cell till cancercell) • virala och cellulära onkogener • studier av virala onkogener gav information om cellulära onkogener • onkogena retrovirus - typexempel 19 RSV – Rous sarcoma virus • onkogent retrovirus • den först identifierade onkogenen från RSV Retrovirala onkogener • nyckelprotein i signalöverföring, cellproliferation • src, ras, raf, m.fl (>30 identifierade) • härstammar från proto-onkogener nu inkorporerade i virusets genom (förändrade) 20 Proto-onkogener • De ursprungliga normala cellulära generna till virala onkogener • Normal roll: viktiga cell-regulatoriska gener • abnormalt uttryckt eller muterat => onkogener Onkogener i cancer • förändrade proto-onkogener – punktmutation – kromosomtranslokation – amplifiering • ~100 identifierade • endast ena allelen behöver vara muterad – Över-uttryckt eller överaktivt protein 21 Punktmutation • rasH, rasK, rasN – punktmuterade ras-gener • förekommer i 20% av all mänsklig cancer • permanent aktivt Ras-protein Exempel på kromosomtranslokation 22 Filadelfia-kromosom • abl protoonkogen translokeras – N-terminal byts ut • icke-reglerbart Abl protein tyrosinkinas • Konstant signalering, en = konstant proliferation • kronisk myeloisk leukemi Genamplifiering – ökat antal kromosomala gen- kopior 3-5 kopior D cyklin per cell (head and neck cancer cells) • Ökad genexpression!! • ökad N-myc i snabbt växande aggressiva tumörer • Ökad erbB-2 tyrosinkinas-receptor i bröst, äggstock-cancer • Ex: D cyklin - driver på cellcykeln förbi R point i G1 23 Funktion hos onkogenprodukter • Komponenter i signalvägar som reglerar – celltillväxt – Överlevnad Som svar på tillväxtfaktorer 24 Blockerad apoptos => ökad cellöverlevnad Bcl-2 (antiapoptotisk) TUMÖR-SUPPRESSORGENER • anti-proliferationsgener (Rb, P53, PTEN,..) • Genförändring (inaktivering) av bägge alleler/genkopior krävs vanligen för cancerutveckling 25 Tumörsuppressorgener Tumörsuppressorgener 26 Repetition: Cellcykelreglering med Rb och E2F 27 Induktion av p21 av DNA-skada 28 P53 ofta muterad i cancer Tumörutveckling • rubad kontroll av celltillväxt • Stegvis utveckling => gradvis malignitet • Defekt kontroll av DNA => med tiden fler mutationer i dottercellerna – Om mutationer ger överlevnadsfördelar => cellen delar sig snabbare än granncellerna, tar över • tumörceller blir mer och mer maligna • cancerceller de-differentierar – – liknar mindre och mindre ursprunglig normal cell – ”minns” sämre sitt ursprung • Mindre nogaräknade avs. omgivning 29 Progressiv utveckling Från benign tumör till invasiv cancer coloncancer 30 Tjocktarmspolyp Coloncarcinom 31 Prognos beror på när förändring hittas Benign polyp (tidigt stadium). Hittas ofta med koloskopi Coloncarcinom, invaderar underliggande muskellager – kräver radikal kirurgi Metastasering– flera barriärer Därför sent steg i cancerutveckling, multipla genetiska förändringar 32 Metastasering – inte helt lätt Varför vissa tumörtyper oftare är benigna/lokala (hypofysadenom …) Genetisk instabilitet en förutsättning Genetisk instabilitet – möjliggör uppkomst av mer maligna celler med bättre metastaserande potential (för instabila celler överlever inte) 33 Molekylärbiologisk diagnostik • gentester (anlagsbärare?) – dessa kan följas mer noga (ev. förebyggande operationer) • hereditär nonpolyposis coloncancer • BRCA1, 2 – gener muterade i ärftlig bröstcancer • detektera mutationer i cancermaterial – – – – diagnosticera, välja behandling, följa behandlingseffektivitet Bcr/Abl => Glivec behandling (Tyrosinkinase hämmare) CD20 => Mabthera (monoklonal antikropp mot CD20) Anticancer behandling • • • • • • • kirurgi strålning cellgifter hormoner – antihormon immunterapi benmärgstransplantation specialdesignad behandling (specifika molekylära targets och mekanismer) 34 Targets för cytostatika • • • • • • • • • DNA skadande (addukter, gör det svårreplikerat Topoisomeras-hämmare Microtubuli hämmande (mitosen!) Cytoskelett skada Antimetaboliter (metotrexate) DNA syntes (DNA polymerase skadande) Proteinsyntes hämmande Nukleotid syntes Många verkar genom att inducera apoptos – Defekt apoptos reglering del i cytostatika resistens • … Cellgiftbehandling • resistens uppkommer ofta (köper tid, sällan bot med enbart cellgift) – Primär resistens (svarar inte på första behandlingen) – Sekundär res. • mutationer selekteras fram under pågående behandling) • Induktion av Multidrug resistande protein (membranpump) - • Kombinationsbehandling (flera cytostatika och upprepad tät behandling) ger: – mindre risk för överlevnad av klon som kan utveckla resistens – detta genom att slå mot flera mekanismer samtidigt och ofta 35 Moderna och kommande behandlingsstrategier: högre specificitet, mindre toxicitet för normala celler • Proteasomhämmare • Tyrosinkinase hämmare – (riktad mot den specifika förändringen) • Antikroppar mot specifika ytmolekyler – (riktad mot specifik celltyp, slår inte ut andra celler) • Hämmare av multipla signalsteg – Ibland verksamma enbart på celler med spec. mutation • • • • Immunoterapi Angiogenes-hämmare (”neurosedyn”), anti-VEGF RNA silencing Gen-terapi • 1. NFκΒ aktiveras av anti-apoptotiska signaler utifrån • 2. IκΒ (inhiberande) degraderas via proteasomer – NFκΒ kan nu importeras till kärnan, – inducerar expression av anti-apoptotiska och proliferations stimulerande proteiner Velcade hämmar proteasomer => ingen NFκΒ till kärnan => ingen apoptoshämning => maligna celler kan gå i apoptos 1 2 Velcade – en proteasome hämmare Behandling vid multiple myeloma - Hämmar NFκΒ aktivering bl.a. 36 Riktad molekylär terapi mot bakomliggande rubbing! Abl protein tyrosinkinas ur kontroll konstant proliferation 37 Riktad terapi - Glivec (tyrosinkinase-hämmare mot Bcr/Abl (filadelfiakromosomen) Riktade terapier på gång! 38 Future: Virtual screeningdesigning drugs in the desktop computer SAMMANFATTNING • • • • • • • • CELLDÖD och apoptos CANCER orsak till cancer cancerutveckling tumörvirus och virusonkogener proto-onkogener och onkogener tumörsuppressorgener tumörutveckling, diagnos och behandling 39