Testa dig själv frågor
advertisement

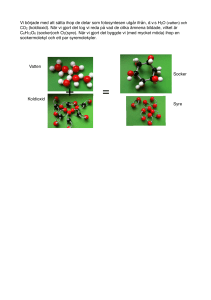
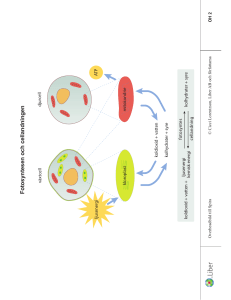
Testa dig själv frågor TESTA DIG SJÄLV 2.1 1. Vad menas med ett ämnes egenskaper? 2. Hur kan du skilja mellan socker och salt? 3. Ge exempel på en egenskap som du kan upptäcka med dina sinnen och en som du behöver hjälpmedel till. 4. Vilka egenskaper är likadana för salt och socker? Vilka är olika? 5. Ge några exempel på hur du till vardags använder egenskaper hos ämnen för att skilja dem åt. Kemisterna känner till ungefär 20 miljoner olika ämnen. Tror du att de kan ha hittat två ämnen som har exakt samma egenskaper? Motivera varför. Facit 2.1 1. Egenskaper beskriver hur ett ämne uppför sig i olika situationer. Om det brinner, luktar eller vilken färg det har. Om det är fast, flytande eller en gas. Allt som är speciellt för just det ämnet. 2. Socker och salt smakar olika. 3. Exempel på egenskaper som man kan upptäcka med sina sinnen är smak, lukt, färg, om ämnet är i fast, flytande eller gasform, om ämnet är hårt eller mjukt. Exempel på egenskaper man behöver hjälpmedel för att upptäcka är ledningsförmåga för ström, densitet, smältpunkt och kokpunkt. 4. Båda är vita, består av kristaller och är lösliga i vatten. Men smaken och vissa andra egenskaper är olika. 5. Med hjälp av lukten eller smaken kan du avgöra om det är fruktsoda eller mineralvatten. Med hjälp av synen kan du se om en medalj är av guld eller silver. Genom att känna tyngden kan du märka om en mugg är gjord av plast eller porslin. • Nej, alla ämnen har olika egenskaper. Om ämnena hade haft exakt samma egenskaper hade det varit exakt samma ämne. Om det ändå skulle finnas två ämnen som hade precis samma egenskaper skulle vi inte veta om det, för kemisterna skulle inte kunna upptäcka att det var olika ämnen. TESTA DIG SJÄLV 2.2 1. Vad är en atom? 2. Ungefär hur många olika atomslag finns det? 3. Vilka är de fem vanligaste atomslagen i din kropp? 4. Varför kan atomer liknas vid legobitar? 5. Vem bevisade att atomerna finns? 6. Vad är en molekylmodell? 7. Förklara på några olika sätt hur liten en atom är. 8. Varför finns det flera olika sorters molekylmodeller? Atomer, bokstäver och legobitar är tre sorters byggstenar som kan bygga upp större saker. Vilka andra byggstenar kan du komma på? På vilka sätt är de lika atomer? På vilka sätt är de annorlunda? Facit 2.2 1. En atom är en liten partikel, en byggsten. Alla ämnen runtomkring oss är byggda av atomer. 2. Det finns ungefär 100 olika atomslag. 3. De vanligaste atomerna i din kropp är syreatomer, kolatomer, väteatomer, kväveatomer och kalciumatomer. 4. Med hjälp av några få sorters legobitar kan man bygga upp många olika saker. På samma sätt kan de ungefär 100 olika atomslagen bygga de miljontals olika ämnen som finns omkring oss. 5. Den engelske kemisten John Dalton bevisade att atomerna finns. 6. Det är en modell som visar hur atomer är sammankopplade i en molekyl. 7. 10 miljoner atomer i rad är en millimeter. En människa består av femtusen kvadriljoner atomer. 8. En modell ska vara praktisk att använda och är därför en förenkling av verkligheten. Den ena modellen kan passa bättre än den andra i vissa sammanhang, och ibland tvärtom. Med • pinnmodeller ser man lätt alla atomerna. Men kalottmodeller visar tydligare att atomerna hakar i varandra. Andra exempel på byggstenar är levande celler, tegelstenar, noter ... TESTA DIG SJÄLV 2.3 1. Vad är ett grundämne? 2. Vad är en kemisk förening? 3. Grundämnena kan delas in i två grupper. Vilka? 4. Nämn ett ämne som är en kemisk förening. 5. Beskriv några viktiga egenskaper hos metaller. 6. Berätta vad du vet om fyra olika grundämnen. 7. Förklara kort vad periodiska systemet är. Facit 2.3 1. Ett grundämne är ett ämne som består av en enda sorts atomer 2. En kemisk förening är ett ämne där varje molekyl innehåller minst två olika slags atomer. 3. Grundämnena kan delas in i metaller och icke-metaller 4. Ett exempel på en kemisk förening är vatten – två väteatomer är sammankopplade med en syreatom. 5. Metaller leder ström och värme och har metallglans. 6. Till exempel: Syre är en osynlig gas som vi behöver andas. Helium är en lätt gas som används i ballonger. Järn är en metall som vi bygger många saker av. Den leder värme och elektricitet och kan smidas. Guld är en gulglänsande metall som vi gör smycken av. Det leder också värme och elektricitet och kan smidas. 7. Periodiska systemet är en tabell över alla atomslag och grundämnen. TESTA DIG SJÄLV 2.4 1. Vad kallas en blandning av syrgas och vätgas? 2. Vad händer när du tänder eld på knallgas? Förklara så noga du kan. 3. Vad menas med en kemisk reaktion? 4. Om du tänder eld på ett papper brinner det upp nästan helt och hållet. Vad tror du händer med atomerna som finns i pappret? Försök komma på några kemiska reaktioner som du har varit med om idag. Facit 2.4 1. En blandning av syre och väte kallas knallgas. 2. När du tänder eld på knallgas sker en explosion. Det sker en snabb reaktion mellan väte och syre som då bildar vatten. Väte- och syremolekylerna tas isär och sätts ihop till vattenmolekyler. 3. En kemisk reaktion är en ”förvandling” där det bildas nya molekyler, och därmed nya ämnen. 4. Atomerna i pappret bildar nya molekyler tillsammans med syret i luften. Det blir då nya ämnen som inte fanns före reaktionen, till exempel gasen koldioxid. • Maten i din kropp förvandlas, luften du andas in förvandlas, frukostägget förvandlades när du kokade det. TESTA DIG SJÄLV 2.5 1. Vad är en molekylformel? 2. Vad betyder siffran två i molekylformeln för vätgas, H2? 3. Vad betyder siffran tre i 3 H2O? 4. Skriv molekylformlerna för vätgas, syrgas och kvävgas. 5. Vad är en reaktionsformel? 6. Hur ser reaktionsformeln ut när syrgas och vätgas bildar vatten? Förklara de olika delarna av formeln. 7. Svavel kan brinna och bilda svaveldioxid, SO2. Hur bör reaktionsformeln se ut? Facit 2.5 1. En molekylformel är en beskrivning av en molekyl med hjälp av kemiska tecken. Molekylformeln visar vilka atomer som sitter ihop i molekylen. 2. Siffran två visar att det finns två väteatomer i vätemolekylen. 3. Siffran tre visar att man har tre vattenmolekyler. 4. Vätgas - H2, syrgas - O2 och kvävgas - N2. 5. En reaktionsformel visar vilka ämnen som deltar i reaktionen och vilka ämnen som bildas. 6. 2 H2 + O2 2 H2O. Två molekyler vätgas reagerar med en molekyl syrgas och bildar två molekyler vatten. 7. När svavel regerar med syre sker reaktionen S + O2 SO2 TESTA DIG SJÄLV 2.6 1. Vilka är de tre former som nästan alla ämnen kan ha? 2. Vad menas med att ett ämne kondenserar? 3. Vad menas med att ett ämne förångas? 4. Vad menas med fysikaliska omvandlingar? 5. Vad är värme för någonting? 6. Förklara vad som händer med molekylerna när is värms från –10 °C till +110 °C. Facit 2.6 1. De tre formerna är fast, flytande och gas. 2. Kondensering är när ett ämne övergår från gasform till vätska. 3. Förångning är när ett ämne går från vätska till gas. 4. En fysikalisk omvandling innebär att ämnet endast ändrar form, till exempel när is smälter till vatten. Men det är fortfarande samma molekyler; det sker alltså ingen kemisk förvandling. 5. Värme är när byggstenarna – atomerna och molekylerna – i ett ämne rör sig. Snabbare rörelse mäter vi som högre temperatur. 6. Vid –10 °C ligger vattenmolekylerna nästan helt stilla i ett speciellt mönster. De darrar lite fram och tillbaka. Vid 0 °C börjar de röra sig lite mer och glida runt varandra – isen övergår till en vätska. Molekylernas rörelser ökar mer och mer upp till 100 °C. Då får de en sådan fart att de kan ta sig loss och lämna vattnet och bilda vattenånga. TESTA DIG SJÄLV 3.1 1. Vilket är vanligast, rena ämnen eller blandningar? 2. Nämn några olika lösningsmedel. 3. Vad menas med en mättad lösning? 4. Förklara vad som händer med socker som du löser upp i te. 5. Hur framställer man salt ur havsvatten? 6. Ge exempel på skillnaderna mellan uppslamningar, lösningar och emulsioner. 7. Mjölk är både en lösning och en emulsion. Kan du komma på någon annan blandning som är blandad på flera sätt? Facit 3.1 1. Blandningar är vanligast. 2. Vatten, lacknafta och aceton är olika lösningsmedel. 3. I en mättad lösning har det lösts så mycket av ett ämne att det inte går att lösa mer. Om man ändå försöker lösa upp ännu mer blir det en rest kvar på botten. 4. Sockret delar upp sig i små partiklar, sockermolekyler, som blandar sig med tevattnet. Sockermolekylerna fördelar sig jämt i hela koppen. 5. Man leder in havsvatten i bassänger och låter vattnet avdunsta. Kvar blir saltet. 6. Kalkvatten är en uppslamning där man kan se bitar av ämnet, det ser grumligt ut. Socker i vatten är en lösning. Därför är det en klar vätska. En emulsion är en finfördelad vätska i en annan vätska, som exempelvis vispgrädde (en emulsion av fett och vatten). 7. Vårt blod är ett exempel på en vätska som både är lösning och emulsion. TESTA DIG SJÄLV 3.2 1. Vilka metoder passar bra för att separera uppslamningar? 2. Vilken metod passar bra för att separera ämnena i en lösning? 3. Vad händer om du filtrerar en lösning? 4. Hur fungerar destillation och vad kan den användas till? 5. Varför kan man inte enkelt dela upp en kemisk förening i grundämnen? 6. Hur fungerar kromatografi och vad kan den användas till? 1. Hur tror du att man bör göra om man vill dela upp mjölk i så många olika delar som möjligt? Facit 3.2 1. Uppslamningar kan separeras genom dekantering, filtrering eller centrifugering. 2. Ämnen i en lösning kan separeras genom destillation. 3. Ingenting, både det lösta ämnet och vätskan passerar genom filterpapperet. 4. Man upphettar lösningen så att vätskan kokar bort och kvar får man det lösta ämnet. Ångan kyls ner så att man får tillbaka ren vätska. Metoden kan användas för att separera olika ämnen i en lösning, exempelvis de olika ämnena i råolja. 5. De metoder man använder för att separera blandningar fungerar inte när man vill dela upp atomslagen i en kemisk förening. För att göra det krävs kemiska reaktioner. 6. Man har en fast del och en rörlig del som vandrar förbi den fasta. Vissa ämnen följer lättare med den rörliga delen, som till exempel kan vara vatten. Andra ämnen fastnar lätt i den fasta delen, som till exempel kan vara papper. Om man gör kromatografi på en färg delas färgen upp i sina komponenter. • Man kan centrifugera mjölken i en mjölkseparator för att separera bort fettet. Om man får bort allt fett får man kvar skummjölk, som är en lösning. Den kan man destillera för att separera vattnet från de lösta ämnena. Man kan också använda kromatografi som separerar fram mjölkprotein, mjölksocker, kalcium, vitaminer, med mera. TESTA DIG SJÄLV 4.1 1. Ge exempel på fyra gaser i luften och ungefär hur mycket det finns av dem. 2. Vilken gas finns det mest av i luften? 3. Hur stor del av luften är syre? 4. Ungefär på vilken höjd tar atmosfären slut? 5. Vad menas med att luften är tunnare på hög höjd? 6. Hur kan du ta reda på om en gas är ren syrgas? 7. Hur ser molekylerna och molekylformlerna ut för syre och kväve? 8. Ge några exempel på vad vi använder syrgas och kvävgas till. 9. Hur gör man för att separera de olika gaserna i luften? På vilka sätt tror du det skulle vara annorlunda på jorden om luften bestod av 100 % syre? Facit 4.1 1. Luft består av kväve 78 %, syre 21 %, koldioxid 0,04 % och ädelgaser 0,93 %. 2. Kväve är den gas som det finns mest av i luften, 78 %. 3. 1/5, eller 21 %, av luften består av syre. 4. Atmosfären tar slut på cirka 100 km höjd. 5. Luftens densitet minskar ju högre upp man kommer. Det blir alltså glesare mellan molekylerna ju högre upp man kommer. 6. Stoppa ner en glödande sticka i gasen som ska testas. Om det är syre börjar stickan brinna. 7. I kvävgas- och syrgasmolekylerna sitter atomerna ihop två och två. Därför skriver man formlerna N2 respektive O2. 8. Syrgas används bland annat vid järnframställning och papperstillverkning, i syrgasmasker och vid svetsning. Kväve används exempelvis till kylning och i handelsgödsel. 9. Först kyler man ner luften så att den blir flytande. Sedan utnyttjar man luftgasernas olika kokpunkter för att skilja dem åt genom destillation. • Eftersom saker brinner bättre ju mer syre det finns så skulle det vara gott om explosionsartade bränder. Om några djur överhuvudtaget skulle överleva alla eldar så skulle de ha mindre lungor än nu eftersom det skulle vara lättare att få tillräckligt med syre ur luften. Om det utvecklades människor, skulle de ha svårt att utnyttja elden på ett reglerat sätt, eftersom allt skulle brinna fortare och lättare. TESTA DIG SJÄLV 4.2 1. Beskriv ozonmolekylen. Vad har den för molekylformel? 2. Vad används freoner till? 3. Hur bildas marknära ozon och hur påverkar det oss? 4. Vad är ozonskiktet och varför är det så viktigt? 5. Varför har ozonskiktet blivit tunnare? 6. Berätta hur ozonbalansen uppkommer. Du är uppfinnare och har hittat på ett nytt kemiskt ämne. Vad bör du tänka på för att undvika att det skadar miljön? Facit 4.2 1. Ozonmolekylen består av tre syreatomer och skrivs O3. 2. Freoner används bland annat som drivgas i sprayburkar och som kylmedel. Nu är de dock förbjudna i Sverige. 3. Ozon vid marken bildas när bilavgaser utsätts för solljus och vid elektriska urladdningar. Det är skadligt för växter och djur. Hos människor orsakar ozon lungskador. 4. Ozonskiktet är ett lager av ozon som finns på flera mils höjd i atmosfären. Där tar ozonet bort det mesta av det skadliga ultravioletta ljuset från solen. 5. Ozonlagret förstörs av freonutsläpp och av de avgaser som jetplan släpper ut. 6. Solljuset slår sönder syremolekyler till fria syreatomer som sedan kan slå sig ihop med en annan syremolekyl och bilda ozonmolekyler med tre syreatomer, O3. Men solljuset bryter också sönder ozonmolekyler i samma takt. På det viset blir det balans i mängden ozon. • Redan när man tillverkar olika produkter måste man tänka på vart ämnena som vi använder tar vägen och vilken effekt de har på naturen. Inga atomer försvinner, de sprids bara eller dyker upp i nya kemiska föreningar. De nya föreningarna kan ibland vara giftigare än ursprungsämnena. TESTA DIG SJÄLV 4.3 1. Vad heter de fyra vanligaste ädelgaserna? 2. Vad menas med att ädelgaserna är ”ädla”? 3. Berätta om tre saker som man använder ädelgaser till. 4. Vad menas med skyddsgaser? Kan du själv komma på några tillfällen när de kan vara användbara? Den första ädelgasen som upptäcktes var argon. Argon betyder ”trög” och ”lat” på grekiska. Försök förklara varför gasen fick det namnet. Facit 4.3 1. Helium, neon, argon och krypton är de vanligaste ädelgaserna. 2. Ädelgaser vill inte bilda kemiska föreningar med andra ämnen. Det är därför de kallas ädla. 3. Neon används i neonskyltar, argon i glödlampor och helium i ballonger. 4. Skyddsgaser kan exempelvis användas vid svetsning och tillverkning av läkemedel, då materialet inte tål syre och kväve. • Gasen bryr sig inte om att reagera med andra ämnen. Man kan jämföra det med att människor som är lata och tröga inte "orkar" reagera. TESTA DIG SJÄLV 4.4 1. Vad menas med oxider? 2. Ge exempel på några oxider i luften. 3. Vad menas med förbränning? 4. Ge exempel på några tillfällen när det bildas koldioxid. 5. Vad är fotosyntes? 6. Varför ökar koldioxidhalten i atmosfären och vad kan det leda till? 7. Vad är biobränslen och varför är de bra? När Markus körde 20 mil med sin nya bil gick det åt 12 liter bensin. Bensinen vägde 9 kg. Vägde avgaserna från bilen lika mycket, mer eller mindre? Facit 4.4 1. Oxider är föreningar som innehåller syreatomer. 2. Koldioxid, kväveoxider och svaveloxid finns i luften. 3. En förbränning är en kemisk reaktion där ett ämne förenar sig med syre. 4. Koldioxid bildas när ämnen som innehåller kol får brinna – till exempel ved, olja, stenkol och papper. Koldioxid bildas också när vi förbränner maten i våra kroppar. 5. Gröna växter kan omvandla koldioxid till socker och syre med hjälp av solljuset. Den processen kallas fotosyntes. 6. Koldioxidmängden ökar eftersom vi förbränner stora mängder kol och olja. Dessa fossila bränslen har legat dolda i jordskorpan och ingår inte i det naturliga kretslopp vi har idag. Det ställer till bekymmer trots att koldioxid inte är giftigt. Koldioxiden ökar nämligen växthuseffekten. Det betyder att klimatet kan komma att förändras på jorden. 7. Biobränslen är bränslen som är tillverkade av trä eller andra växter. Medan träden växer tar de upp koldioxid från luften och när de används kommer koldioxiden tillbaka till luften. Den totala mängden koldioxid ökar alltså inte och därför bidrar biobränslen inte till växthuseffekten. • Avgaserna väger mycket mer. När bensinen förbränns i motorn slår atomerna i bensinen ihop sig med syreatomer från luften och bildar oxider. Atomerna från bensinen tillsammans med syreatomerna från luften kommer att väga mer än vad bensinen gjorde från början. TESTA DIG SJÄLV 4.5 1. När började luftföroreningarna öka kraftigt? 2. Vilka oxider orsakar surt regn? 3. Vad är smog? 4. Var är problemen med smog störst? 5. När bildas kolmonoxid och på vilket sätt är den farlig? 6. Hur uppkommer surt regn och vad ställer det till med? Försök förklara varför det är lättare att minska utsläpp av sot och småpartiklar än av gasformiga oxider. Facit 4.5 1. Luftföroreningarna började öka kraftigt vid industrialismens genombrott eftersom man började elda med kol. Det var för ungefär 200 år sedan. 2. Surt regn orsakas främst av svaveldioxid och kväveoxider. 3. Smog är en blandning av dimma, rök och andra luftföroreningar. 4. I storstäderna där utsläppen är som störst. 5. Kolmonoxid bildas vid förbränning om det är ont om syre. Kolmonoxiden är giftig eftersom den hindrar syret att transporteras med de röda blodkropparna. Man kvävs. 6. När man förbränner fossila bränslen så bildas både svaveldioxid och kväveoxider. De reagerar med vatten i luften och bildar syror som kommer ner med regnet. Det sura regnet skadar byggnader och grundvattnet genom att syrorna lakar ut metaller som sedan kommer ner i vårt dricksvatten. Även växter och djur skadas av försurningen. • Man kan mycket enkelt avlägsna sot och småpartiklar i luftutsläppen med hjälp av filter. Men oxiderna fastnar inte i några filter eftersom molekylerna är så små. TESTA DIG SJÄLV 4.6 1. Hur stor del av alla atomer på jordytan är väteatomer? 2. Varför användes väte i luftskepp förr i tiden? Varför används det inte längre? 3. Vad används väte till idag? 4. Många människor tycker det är svårt att skilja på väte och kväve. Vilka likheter finns det mellan dem? Vilka skillnader? På jorden är vätgas ovanligt, men i solen och på den stora planeten Jupiter är den mycket vanlig. Försök förklara vad det kan bero på. Facit 4.6 1. 90 % av alla atomer på jordytan är väteatomer. 2. Det är lätt och billigt att framställa. Men väte är brandfarligt och olyckor kan lätt hända. 3. Väte används bland annat vid margarintillverkning, som raket- och bilbränsle samt vid tillverkning av ammoniak och saltsyra. 4. Båda är grundämnen, gaser och sitter samman två och två i molekylerna. Kväve kväver eld medan väte brinner. • Väte är så lätt så att jordens gravitation inte räcker till för att hålla kvar gasen. Solen och Jupiter är mycket större himlakroppar och har därför den gravitation som krävs för att hålla kvar vätet.